γ-聚谷氨酸的抗氧化及对UV辐射致皮肤细胞光老化的修复作用
王薛雪,李 莎,任战坤,王 瑞,詹伊婧,符 婵,徐 虹
(1.南京工业大学 食品与轻工学院,江苏 南京 211800;2.南京轩凯生物科技有限公司,江苏 南京 211800)
皮肤作为人体抵御外界侵害的第一道防线,易受外界影响而导致光老化,紫外线照射产生的过量自由基是皮肤光老化的主要原因[1-2]。自由基具有高度的活泼性和极强的氧化反应能力,能通过氧化作用攻击皮肤细胞内的生物大分子,如核酸、蛋白质、糖类和脂质等,使之发生变性、交联或断裂[1-2],造成皮肤在分子、细胞及组织器官水平的各种损伤[3-4],加速皮肤衰老进程甚至诱发各种疾病[5-6]。皮肤成纤维细胞由于具有分泌胶原、保持细胞弹性和支持表皮细胞等作用[7],是进行体外抗衰老研究的常用对象。因此,寻找天然抗氧化物用于修复皮肤光老化问题已成为目前的研究热点之一,受到人们的广泛关注。
近年来,随着酶、活性肽、多糖等抗氧化活性功能的不断发掘,天然高分子抗氧化剂得到广泛研究[7-9]。γ-聚谷氨酸(γ-PGA)是由微生物发酵制备的一种天然带负电荷的高分子聚合物材料,因其强大的保水能力而广泛应用于保湿型化妆品中,其分子量最高可达2.0×106[10]。目前已有研究发现γ-PGA具有清除1,1-二苯基-2-三硝基苯肼自由基(·DPPH)的能力[11],但其抗氧化、抗皮肤光老化效果及与γ-PGA分子量的关系尚未明确。
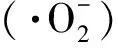
1 材料与方法
1.1 主要试剂与仪器
γ-PGA,南京轩凯生物科技有限公司;抗坏血酸(VC)、焦性没食子酸(邻苯三酚)、浓盐酸、H2O2、FeSO4·7H2O、水杨酸、乙醇均为分析纯,中国医药(集团)上海化学试剂公司;三羟甲基氨基甲烷(Tris)、·DPPH、DMEM高糖培养基、青链霉素、胰酶-EDTA、磷酸缓冲盐溶液(PBS)、透明质酸(HA)、3-(4,5-二甲基噻唑-2)-2(MTT)均为生物试剂,上海化学试剂公司;小牛血清,杭州四季青生物工程有限公司;一氧化氮(NO)检测试剂盒、DCFH-DA荧光探针,南京建成生物工程研究所;去离子水,实验室自制。
752 s型紫外可见分光光度计,上海棱光技术有限公司;HH-3A型数显恒温水浴锅,国华电器有限公司;KQ5200型超声波清洗器,南京实验仪器厂;BSA224S型分析天平,上海天平仪器厂;SW-CJ-1B型标准型净化工作台,苏州净化设备厂;紫外光辐照计,北京师范大学光电仪器厂;Heracell 150i型细胞培养箱、MultiskanGO酶标仪、Lumina荧光分光光度计,Thermo公司。
1.2 实验方法
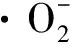
(1)
式中:A1为邻苯三酚自氧化的反应速率,A2为加入γ-PGA后的邻苯三酚自氧化的反应速率。
1.2.2 ·OH清除率测定
·OH清除率的测定采用Fenton反应法[13],以VC为阳性对照。反应体系:0.50 mL的9 mmol/L FeSO4溶液,0.50 mL的9 mmol/L水杨酸乙醇溶液和2.50 mL的γ-PGA溶液或VC溶液,混合均匀后,加入0.5 mL 8.8 mmol/L的H2O2,置于37 ℃中水浴15 min。取出后待冷却至室温,在510 nm下测其吸光度,具体计算见式(2)。
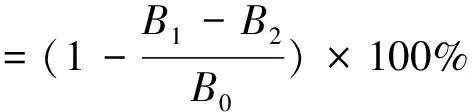
(2)
式中:B1为加入γ-PGA的吸光度,B2为用水代替H2O2溶液的吸光度,B0为不加γ-PGA的吸光度。
1.2.3 ·DPPH清除率测定
·DPPH清除率的测定参照Zeng等[14]采用的方法。反应体系:0.05 mg/mL ·DPPH的乙醇溶液0.50 mL,加入2.5 mLγ-PGA溶液或VC溶液,以2.5 mL的去离子水代替γ-PGA溶液为对照组。避光反应10 min后在519 nm下测其吸光度,具体计算见式(3)。
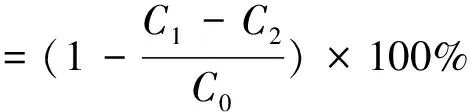
(3)
式中:C1为加入γ-PGA的吸光度,C2为用乙醇溶液代替·DPPH溶液的吸光度,C0为不加γ-PGA的吸光度。
1.2.4 小鼠皮肤成纤维细胞的培养及实验分组
实验采用L929小鼠皮肤成纤维细胞,在标准实验条件下培养:使用含100 g/L小牛血清和10 g/L的青霉素-链霉素的DMEM高糖培养基培养细胞,置于37 ℃、5%(体积分数)CO2、饱和湿度的生化培养箱中,每隔2~3 d更换一次培养基,细胞使用0.25%胰酶-EDTA消化传代。细胞存活率检测采用96孔板进行,接种密度为2×104个/孔;细胞形态观察、细胞内活性氧(ROS)水平及细胞内NO水平均采用6孔板进行,细胞接种密度为2.5×106个/孔,待细胞完全贴壁后,进行分组处理。
实验分组为正常对照组(CK组)、光老化模型组(UV组)和γ-PGA处理组。细胞培养至完全贴壁后,弃去培养基,每孔均加入100 μL(96孔板)或1 mL(6孔板)的PBS,再进行紫外UVA照射[15](辐照距离为10 cm,辐照时间为30 min,辐照剂量为5 J/cm2),弃去PBS,每孔均先加100 μL(96孔板)或1 mL(6孔板)的不含小牛血清的DMEM培养基,后按组处理,CK组和UV组加入100 μL(96孔板)或1 mL(6孔板)PBS,γ-PGA组各加100 μL(96孔板)或1 mL(6孔板)不同分子量1 mg/mL的γ-PGA溶液(γ-PGA溶液采用0.22 μm的滤头过滤除菌)共同培养24 h。
1.2.5 细胞存活率的测定
采用MTT法进行细胞存活率检测[16],于96孔板中分组处理的细胞培养24 h后,每孔加入20 μL 5 g/L的MTT溶液,37 ℃避光反应4 h后吸弃上清液,每孔加入200 μL二甲基亚砜(DMSO),微量振荡10 min使结晶紫充分溶解,于590 nm下测其吸光度,具体计算见式(4)。
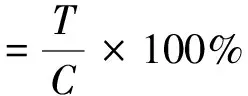
(4)
式中:T为UV组或γ-PGA组细胞的吸光度,C为CK组细胞的吸光度。
1.2.6 细胞形态观察
采用倒置生物显微镜观察不同处理组的L929细胞形态并拍照记录。
1.2.7 细胞中ROS水平测定
6孔板中分组处理的细胞培养24 h后,吸弃培养基,加入1 mL的10 μmol/L DCFH-DA荧光探针,37 ℃孵育30 min后收集细胞,用荧光分光光度计进行荧光检测,激发波长为485 nm,发射波长为525 nm[17]。
1.2.8 细胞中NO水平测定
6孔板中分组处理的细胞培养24 h后,吸取上清液培养基,收集细胞,1 000 r/min离心5 min后弃去上清液,用之前吸取的上清液培养基将细胞吹打重悬,反复冻融3次以裂解细胞,12 000 r/min离心5 min后收集裂解产物备用。NO含量的检测使用NO检测试剂盒,在波长550 nm处[9],用酶标仪测定吸光度。
1.2.9 统计学分析
所有数据均来自3次以上平行实验,采用PASW软件对数据进行统计学分析,单因素方差分析进行显著性检验,P<0.05则认为结果具有显著性差异。
2 结果与讨论
2.1 清除的能力
分别测定不同分子量的γ-PGA不同浓度的溶液对超氧阴离子自由基的清除能力,结果见图1。

图1 γ-PGA对的清除能力
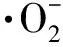
2.2 清除·OH的能力
分别测定不同分子量的γ-PGA不同浓度的溶液对·OH的清除能力,结果见图2。
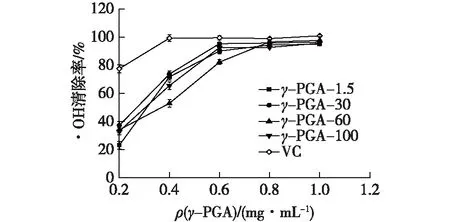
图2 γ-PGA对·OH的清除能力
由图2可知,不同分子量的γ-PGA对·OH都具有较强的清除作用,且随着γ-PGA浓度的增加,清除效果逐渐增强。在低质量浓度(<0.6 mg/mL)情况下,γ-PGA-1.5、30、60和100的最高清除率分别为90.03%、95.26%、82.18%和92.48%;在质量浓度为0.6 mg/mL时,各分子量的γ-PGA都可以清除80%以上的·OH,其中γ-PGA-30的清除率最佳;在高质量浓度(>0.8 mg/mL)情况下,不同分子量的γ-PGA对·OH的清除效果相近,在质量浓度为0.8 mg/mL时,γ-PGA-1.5、30、60和100的清除率分别为94.28%、95.75%、96.56%和92.64%,清除率都可以达到90%以上,与VC清除率相近。其中,6.0×105的γ-PGA在质量浓度为1 mg/mL时,最高清除率可达97.55%。γ-PGA对·OH超强的清除能力很有可能是γ-PGA螯合了溶液中的Fe2+,阻断了·OH的生成所导致的[19]。
2.3 清除·DPPH的能力
分别测定不同分子量的γ-PGA不同浓度的溶液对·DPPH的清除能力,结果见图3。

图3 γ-PGA对·DPPH的清除能力
由图3可知,不同分子量的γ-PGA对·DPPH都具有一定的清除作用,但在实验浓度区间内,各分子量γ-PGA对·DPPH的清除率与浓度没有明显的线性关系,所以认为·DPPH清除率与γ-PGA的浓度不相关。同时从图3可以明显看出,各分子量γ-PGA对·DPPH的清除率(从大到小):γ-PGA-30、γ-PGA-1.5、γ-PGA-60、γ-PGA-100,其中3.0×105的γ-PGA对·DPPH的清除效果最好,远高于其他分子量的γ-PGA,其在质量浓度为5 mg/mL时,清除率达到74.64%。γ-PGA-30对·DPPH优异的清除效果可能是其在溶液中的高级结构,而不是γ-PGA本身所导致的[20]。
2.4 对光老化细胞的修复作用
紫外照射会严重损伤真皮层中的成纤维细胞,皮肤成纤维细胞的增殖能力对皮肤的正常修复起着决定性作用。分别测定不同分子量γ-PGA对紫外照射后的L929细胞的修复作用,结果如图4所示。
由图4可知:紫外光照射后立即加入γ-PGA溶液,可以一定程度恢复因紫外线造成的细胞损伤,降低细胞的死亡率。与正常组的细胞存活率100%相比,紫外线造成了细胞较大的损伤,UV组的细胞存活率显著降低(P<0.01),仅为55.37%,γ-PGA对细胞的修复效果(从大到小)为γ-PGA-30、γ-PGA-60、γ-PGA-1.5、γ-PGA-100,结果具有显著差异性(P<0.05)。
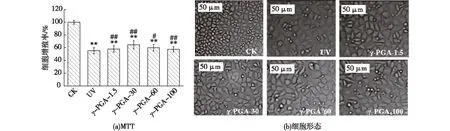
*表示P<0.05 vs.CK;**表示P<0.01 vs.CK;#表示P<0.05 vs.UV;##表示P<0.01 vs.UV
与CK组相比,UV组细胞数量明显减少,且少部分细胞脱离贴壁状态,悬浮于培养基中,部分贴壁的细胞梭型不明显,细胞边缘不清晰。紫外照射后加入γ-PGA的细胞形态较UV组都有一定程度的改善,细胞数量有所增加,悬浮细胞减少,贴壁的细胞梭型明显。说明γ-PGA能有效修复光老化细胞,其中γ-PGA-30的细胞形态呈现清晰的不规则多边形,圆形的悬浮细胞较其他组少许多,与CK组相似,细胞排列紧密,数量也比其他γ-PGA组多,这与MTT的结果相符合,因此认为γ-PGA-30对光老化细胞的修复作用最佳。
2.5 对光老化细胞中ROS及NO含量的影响
紫外照射会导致细胞中的氧自由基ROS、氮自由基NO含量明显上升,细胞中自由基含量的多少对光老化皮肤修复作用的评价有着重要意义。分别测定不同分子量γ-PGA对紫外照射后的L929细胞中ROS及NO含量的影响,结果如图5所示。

图5 γ-PGA对光老化细胞中ROS、NO含量的影响
由图5可知,与CK组相比,UV组细胞中的ROS、NO含量显著上升(P<0.01)。而γ-PGA的加入可以减少细胞中的ROS、NO含量。γ-PGA可以显著抑制紫外照射造成的ROS含量上升(P<0.01),γ-PGA组的ROS含量低于UV组,其中γ-PGA-30组细胞内的ROS相对含量为210.9,只有UV组的一半,其他分子量的γ-PGA的结果更接近CK组。表明γ-PGA可以有效抑制小鼠光老化细胞中ROS含量的增加,减轻紫外对细胞造成的氧化损伤。
γ-PGA的加入可以显著抑制紫外照射造成的NO含量上升(P<0.01),γ-PGA组的NO含量比UV组明显降低,其中γ-PGA-1.5、γ-PGA-30组细胞内的NO含量不到UV组的一半,甚至略低于CK组。表明γ-PGA可以有效抑制小鼠光老化细胞中NO含量的增加,从而修复紫外照射导致的细胞氧化损伤。其中γ-PGA-30对光老化细胞的修复作用最为明显,这可能是因为γ-PGA-30在溶液中具有独特的易于清除自由基的三维结构。
3 结论
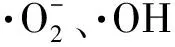
2)紫外光照射后立即加入γ-PGA溶液,可以一定程度修复光老化细胞的损伤,降低细胞的死亡率,其中分子量为3.0×105的γ-PGA对光老化细胞的修复作用最佳。
3)γ-PGA可以显著减少光老化细胞中ROS、NO含量的上升,从而修复光老化细胞的氧化损伤,其中分子量为3.0×105的γ-PGA对光老化细胞中ROS、NO含量上升的抑制效果最为明显。

