4种核酸提取方法对3种新型冠状病毒核酸检测试剂检测性能的比较与分析
张运洪,秦维超,游凤霞,何 玲,赵文斌,赵宇宏
重庆市江津区中心医院检验科,重庆 402260
2019年12月底,发生了以呼吸道为主要症状的不明原因肺炎,经二代测序、病毒分离和鉴定等手段,确定是由一种新型冠状病毒(SARS-CoV-2)感染引起[1-2],其导致的肺炎被命名为新型冠状病毒肺炎(COVID-19)[3]。流行病学数据表明,SARS-CoV-2正在发生人际传播[4]。采用实时荧光定量PCR(qPCR)检测SARS-CoV-2核酸阳性是诊断COVID-19的“金标准”[5]。
本研究拟通过对3例SARS-CoV-2感染患者不同时间点送检标本、不同核酸提取方法、不同qPCR扩增试剂检测结果进行比较分析,评价不同核酸提取方法、不同扩增试剂盒性能,讨论目前SARS-CoV-2核酸提取方法、扩增试剂不足之处,提高筛查准确性,为COVID-19核酸检测标准化提供实验室参考。
1 资料与方法
1.1一般资料 收集本院3例COVID-19确诊病例(鼻咽拭子SARS-CoV-2核酸检测阳性,临床CT影像存在双肺感染),经规范治疗后病毒核酸呈弱阳性,在不同时间点(2020-02-15、2020-02-16、2020-02-18)分别采集3份鼻咽拭子标本,记为标本1、标本2、标本3。
1.2仪器与试剂 主要仪器有多孔磁力架、圣湘Nathch S全自动核酸提取仪、Eppendorf ThermoMixer振荡恒温金属浴、Eppendorf Centrifuge 5427R高速冷冻离心机、宏石SLAN-96S qPCR仪、宏石SLAN-96P qPCR仪。
1.3方法
1.3.1核酸提取 选取2个企业生产的4种RNA提取方法,分为A~D组提取方法。A组(普通一步法):取等量的原始标本和核酸裂解液混匀作为提取产物,最后按说明书要求点样。B组(浓缩一步法):取200 μL原始标本12 000 r/min高速离心10 min,去掉上清液,再加入30~50 μL核酸裂解液混匀作为提取产物,最后按说明书要求点样;C组(机器磁珠法):圣湘S1006磁珠提取试剂配套圣湘Nathch S全自动核酸提取系统提取产物,中间核酸裂解采用常温平置30 min,最后按说明书要求点样;D组(手工磁珠法):圣湘S1002磁珠提取试剂,利用磁力架手工提取产物,中间核酸裂解采用60 ℃,500 r/min匀速振荡10 min,最后按说明书要求点样。见表1。
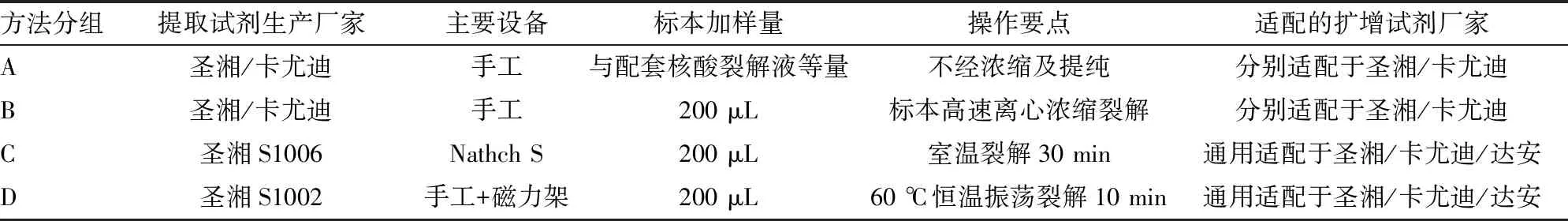
表1 各核酸提取方法的基本情况
1.3.2扩增检测 选取 3 个企业生产的3种SARS-CoV-2 ORF 1ab/N 基因扩增试剂,检测方法均为多重qPCR,分为E~G组。E组:湖南圣湘(批号:2020001),F 组:北京卡尤迪(批号:T2001-27Y),G 组:中山达安(批号:2020003)。G 组试剂不适用核酸提取方法 A和B,不参与核酸提取方法 A组和B 组研究。E组和G组试剂均以非添入的内源细胞管家基因作内标,F组试剂未设计内标。使用SLAN-96S或SLAN-96P qPCR仪根据不同厂家试剂说明书设置反应程序后扩增检测并对检测结果进行阴性、阳性的判定。见表2。
1.4质量控制 每批试验均带阴性对照 2~3 孔和阳性对照 1 孔(除使用试剂盒自带阴性对照外,还使用实验用蒸馏水或生理盐水作为阴性对照随机插入标本中检测),按照标准操作程序严格执行。E 组和 G 组试剂还设计有内源性管家基因内标,可以监控取样和检测全过程;F 组试剂未设计内标无此监控。
2 结 果
2.1不同核酸提取方法/不同核酸扩增试剂检测结果 按标准操作程序检测得到有效检测结果,见表3。
2.2不同核酸提取方法的结果分析 分析结果显示,核酸提取方法 D 最优,C次之,从优到劣为:D>C>B>A。见表4。
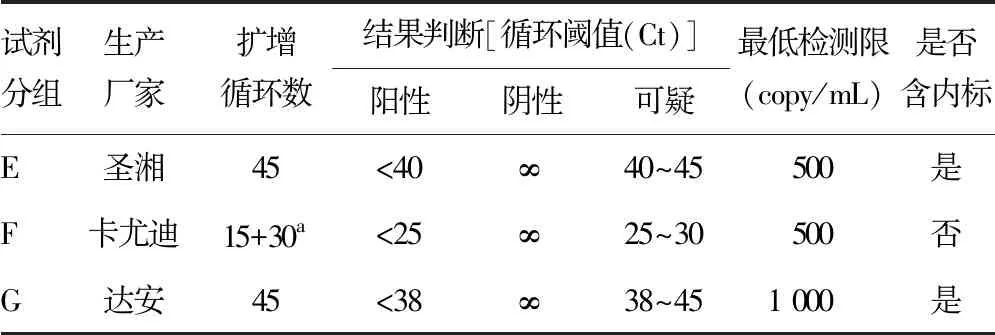
表2 各核酸扩增试剂的基本情况
2.3不同核酸扩增试剂检测的结果分析 因扩增试剂G不适用提取方法A和提取方法B,本统计未列入提取方法A和提取方法B的数据。分析结果显示,ORF 1ab基因扩增检测能力试剂G最好,N基因扩增检测能力试剂E最好,ORF1ab/N基因同时检出能力试剂E优于G,但两者均不理想。见表5。
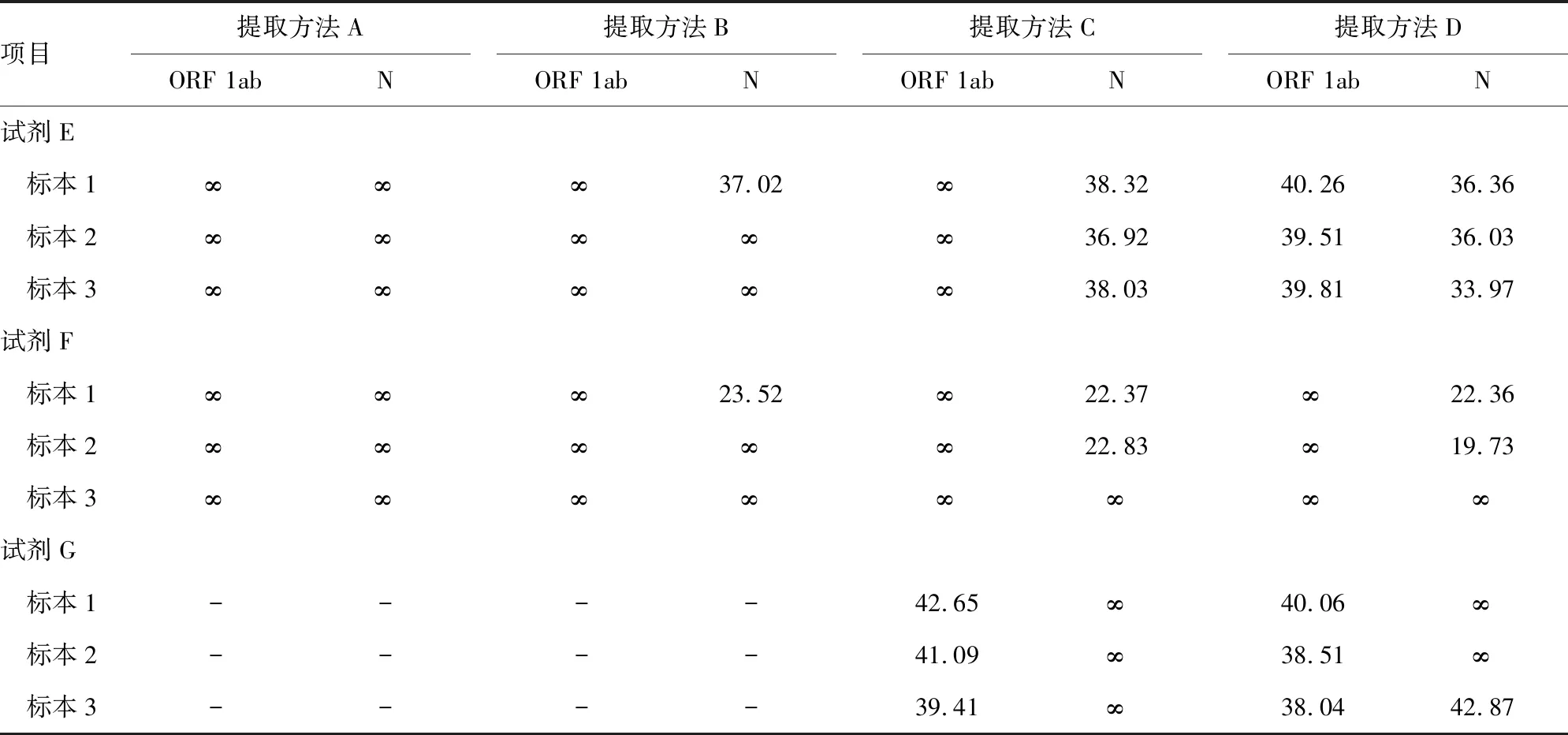
表3 不同核酸提取方法/不同核酸扩增试剂检测结果(Ct值)

表4 不同核酸提取方法的检出率[n(%)]
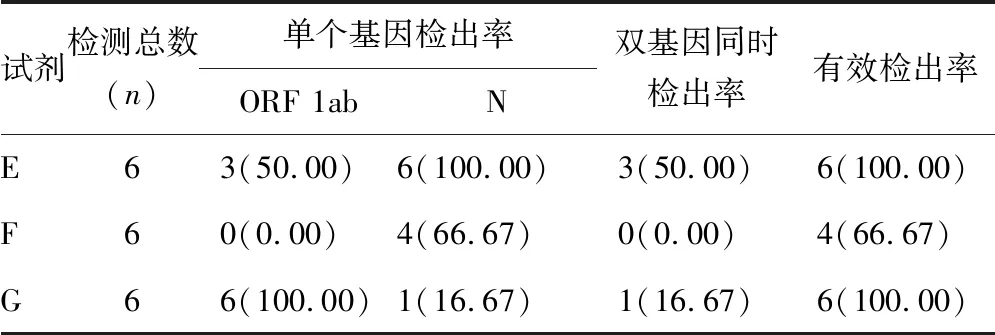
表5 不同核酸扩增试剂检出率[n(%)]
3 讨 论
本研究所提供标本均来源于COVID-19确诊患者,病毒核酸呈弱阳性,检测出的Ct值大多在40左右的灰区,但均有明显的抬头曲线和拐点,结合各试剂检出情况,综合判断各标本的SARS-CoV-2为低水平。本研究采用4种核酸提取方法,3种核酸扩增试剂,进行RNA的提取和扩增,对3个低水平SARS-CoV-2进行检测,根据检测结果比较不同核酸提取方法及不同核酸扩增试剂的性能。结果显示:核酸提取方法D最优,C次之,从优到劣为:D>C>B>A。ORF 1ab基因扩增检测试剂G能力最好,N基因扩增检测试剂E能力最好,试剂E和G检测能力可互补。双基因同时检出能力试剂E优于G,但两者均不理想,3种试剂均亟待进一步优化,提高检测性能。本文中采用的核酸提取方法D联合扩增试剂E是本研究中最有力的检测手段。
本研究中手工磁珠法提取效率最高,但步骤繁琐,对操作人员熟练程度要求高,不同人员之间结果差别大,且本实验室为提高阳性率还用到了特殊的恒温振荡金属浴。由于手工磁珠法和机器磁珠法两者有效检出率一致,可以在有条件的实验室同时采用。手工磁珠法在本实验室一般用于复查和验证。
手工磁珠法与机器磁珠法比较,笔者认为最大不同是前者可以在60 ℃的温度下边孵育边振荡,可以更充分地促进核酸释放,一般保持10 min裂解时间即可。而机器磁珠法通常是在室温下进行核酸裂解释放,通常要保持30 min以上裂解时间,可能也没有充分裂解释放。还有本次机器磁珠法提取试剂是通用型的核酸提取试剂,而手工磁珠法提取试剂是专门针对RNA的提取试剂,可能后者优化更好。
浓缩一步法优于普通一步法,两者虽都能直接裂解释放核酸,但都没有进行核酸提纯,对于复杂标本的抗干扰能力均较弱。厂家均没有推荐优先使用这2种核酸提取方法,提示可在没有更好提取方法时使用,若在某些条件下非要使用一步法,建议在裂解前先进行浓缩并洗涤。
试剂E检测低水平SARS-CoV-2的ORF 1ab基因能力有欠缺;试剂G检测低水平SARS-CoV-2的N基因能力有欠缺,且试剂G检测ORF 1ab基因有多次Ct值介于40~45,信号极弱,极易漏检。双基因同时检出能力试剂E优于G,试剂G对3个低水平标本双基因均没有同时检出。试剂E和试剂G能力互补,联合检测对SARS-CoV-2的ORF 1ab基因和N基因检出有利;F试剂对低水平SARS-CoV-2的ORF 1ab基因和N基因检测能力待观察。建议有条件时,可采用2种或2种以上试剂平行检测避免漏检。
由于此次疫情暴发之初,相应的核酸检测试剂难于进行完整的临床验证。全国有上百家分子诊断企业陆续开发出了相应的核酸检测试剂盒。为了迅速控制疫情,国家药品监督管理局启动相应审批程序,陆续批准了一批SARS-CoV-2核酸检测试剂盒,但试剂盒质量也存在参差不齐的情况。厂家说明书中给定的最低检测限,是基于出厂前最优的提取方法和最好的实验条件得出的结论,临床验证数据缺乏,还有厂家试剂未设计内标系统来监测实验过程。在特殊情况下,临床使用中要注意配套使用提取方法,必要时进行验证,否则会影响检测阳性率。本实验研究提示,建议对核酸提取避免使用快速一步法,减少可能出现漏诊或者假阴性的情况。
SARS-CoV-2是一种RNA病毒,约3万个碱基,不同区域和其他冠状病毒的相似性有所不同,有些区域相似度在90%以上,因此核酸检测试剂往往选择相似度低的区域进行,这样就可以特异地识别SARS-CoV-2[6]。区域识别是通过引物和探针的结合来实现,因此试剂中的探针和相应区域的高度匹配决定了病毒核酸检测具有很好的特异性,一旦检测到,即为阳性,证明有病毒的存在。
ZHU等[7]在研究中获得3个完整SARS-CoV-2基因组,并设计了几种针对SARS-CoV-2基因组ORF 1ab、N和E 3个靶标区域的特异度和灵敏度的检测方法,以检测临床标本中的病毒RNA。CHU等[8]研发了2个一步qPCR检测方法来检测病毒基因组的2个不同区域(ORF 1ab和N),该方法可以实现SARS-CoV-2在标本中的快速检测。其研究还表明,在临床标本中使用qPCR检测N基因灵敏度更高。
郭元元等[9]也对6种国产SARS-CoV-2核酸检测试剂盒的检测性能进行了比较与分析,其结果显示弱阳性患者的核酸可能不易检出,各试剂的结果存在一定的差异,其建议为满足低水平检测能力要求,实验室在使用新试剂前,或在更换试剂批号时,应做相应的性能验证,以满足实验室的检测要求。陈炜等[10]研究显示痰标本中的病毒核酸量高于咽拭子标本,痰标本的检测效果优于咽拭子标本,这可能与SARS-CoV-2侵袭感染下呼吸道和肺有关。由于咽拭子不易采集到足量的合格标本导致早期诊断的不准确性,因此使用咽拭子病毒核酸检测作为筛查手段需谨慎。
总之,对于SARS-CoV-2核酸检测结果的准确性,需要从标本类型、标本采集保存与运输,以及患者感染周期等影响因素来综合分析,了解在不同标本中病毒水平及出现的时间,是确诊SARS-CoV-2感染患者及判断患者治疗恢复的关键点。另外,人员操作、核酸提取、试剂盒性能等都是造成检测结果假阴性或假阳性的原因,故实验室在做好质量控制的同时结合临床评价试验数据进行分析也是重要的环节[11]。在被感染者中检出核酸,需同时满足以下4个条件,即(1)被感染者的细胞中有一定量的病毒;(2)采集标本时,必须采集到含有病毒的细胞;(3)可靠的体外诊断试剂;(4)规范的临床核酸检测实验室(合理的分区、有能力的检测人员和严格的质量管理体系)。
本研究仅为初步探索性分析,存在一定不足,样本量有限,缺少重型/危重型病例,缺少连续观察,病例追踪时间短,观察时间点不统一。目前检测手段尚需继续完善,避免假阴性结果影响其分析和判断,需扩大样本量及更高质量的研究来获得更为准确的结论。

