黑刺粉虱危害对黄金芽茶叶生化成分含量及抗氧化酶活力的影响
李程锦, 宋长远, 王 鹏, 陈珍珍, 许永玉,*
(1.山东农业大学植物保护学院, 山东泰安 271018;2.山东省烟台市农业科学研究院, 山东烟台 265500)
植物在长期进化过程中形成了复杂的防御系统,大量的研究表明,植物在遭受昆虫取食后,其体内的生理生化及代谢可发生相应的改变,引起植物体内与防御有关物质含量的变化。茶树体内含有大量的生物活性成分,如多酚类物质、生物碱、糖类、氨基酸等,这些成分中有些在昆虫取食后不利于昆虫生长发育抑制了昆虫的繁殖,使茶树对昆虫产生了抗性。咖啡碱是茶叶中重要的内含成分,虽然没有证据表明咖啡碱能直接影响昆虫的生长发育,但通过对侧多食跗线螨Polyphagotarsonemuslatus(刘奕清等, 1999)、假眼小绿叶蝉Empoascavitis(毛迎新等, 2009)的研究均发现咖啡碱含量高的茶树品种抗虫性较强。茶多酚是茶树体内多种酚类及其衍生物的总称,具有浓烈的苦涩味和收敛性,可引起害虫的拒食,从而起到保护茶树的作用(张贻礼等, 1999),儿茶素作为多酚类的一种,对叶螨类害虫有一定的忌避作用(谭济才和邓欣, 1994)。茶树所含氨基酸种类繁多,其中有些氨基酸可对昆虫发育产生负面影响,如高浓度的谷氨酸、甘氨酸、丝氨酸、苏氨酸等对昆虫生长发育有较强的抑制作用,这些氨基酸含量高的茶树品种表现出较强的抗虫性(刘奕清等, 1999)。糖分是昆虫必需的营养成分,可溶性糖含量高的茶树品种更有利于昆虫的生长繁殖,被害指数高,品种抗虫性较弱,反之害虫发育不良、繁殖率下降,茶树品种表现出抗虫性(许宁等, 1996; 刘奕清等, 1999; 张贻礼等, 1999)。当植物受到昆虫或其他不利环境条件的胁迫时,活性氧物质会在体内产生并积聚,对机体产生毒害作用。植物体内的超氧化物歧化酶(SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)和其他氧化酶可以有效地清除这些自由基并抑制活性氧物质对植物的伤害,提高机体的抗压能力(刘明杨等, 2016)。
随着山东茶区茶叶种植面积的不断扩大,害虫的种类逐渐增多,为害程度逐渐加重。文献研究和目前田间调查可以看出,自2004年至今,黑刺粉虱Aleurocanthusspiniferus在山东茶园发生较为普遍,在局部茶园危害重,是山东茶园的主要害虫之一(郭见早和冯志花, 2004; 邱忠莲和袁洪刚, 2005; 段永春等, 2010)。黑刺粉虱隶属半翅目(Hemiptera)粉虱科(Aleyrodidae),除直接刺吸为害外,其排泄物产生的茶煤病Neocapnodiumtheae也会降低茶树叶片的光合作用,影响茶树的生长。黑刺粉虱成虫喜欢聚集在未完全展开的嫩叶上刺吸为害,且偏好在茶树上部幼嫩叶片产卵,卵孵化后除1龄幼虫可以活动外,其余幼虫阶段均固着刺吸为害,可直接影响茶叶的产量和品质。黄金芽Camelliasinensiscv.Huangjinya为1998年由浙江余姚市德氏茶场发现的自然黄化变异单株培育而成的珍稀黄化茶树品种,可采制名优茶,其新稍伸展能力大,芽体较小,目前通过引种栽培,已成为可在山东种植的优良品种。本研究团队前期调查发现,黑刺粉虱在黄金芽品种上的发生量高于其他品种。为探求黑刺粉虱为害和黄金芽生长发育间的关系,本研究测定分析了黑刺粉虱不同为害程度对茶叶中茶多酚、可溶性糖、游离氨基酸、咖啡碱、儿茶素等生化成分含量和3种抗氧化酶(SOD, POD和CAT)活性的影响,对全面了解黑刺粉虱在黄金芽上的动态规律、黄金芽受害后的反应和两者间的互作关系提供基础,同时也为该虫在茶园的科学防控提供理论依据。
1 材料与方法
1.1 供试茶树
试验地点为泰安市道朗镇茶溪谷茶园(36°12′48.09″N, 116°56′4.27″E),园内以黑刺粉虱和小绿叶蝉为主要发生害虫,尤其以黑刺粉虱发生严重。近几年来,我们指导茶园经营者在非采茶期使用联苯聚酯压低虫口密度,而后通过使用黄板诱杀成虫,茶园适时台刈以及喷洒苦参碱、藜芦碱等绿色防控措施,黑刺粉虱的危害得到了较好的控制。目前茶园内局部茶丛发生较重,可能是由于茶园园区内种植红叶石楠、樱花、松树、柿子树等造成环境郁闭引起的。试验茶树为5年生黄金芽。
1.2 茶树叶片样品收集
采样方法参考Tian等(2018)以芽下第3片叶片观察小贯小绿叶蝉Empoascaonukii刺吸为害对茶树的影响的方法,于2018年9月份采集黑刺粉虱幼虫为害不同级别的黄金芽茶树芽下第3片叶片。按照在叶片上固着不动的2龄、3龄幼虫的数量进行黑刺粉虱为害等级的划分,共分为5个级别:Ⅰ级1~20头,Ⅱ级20~40头,Ⅲ级40~60头,Ⅳ级大于60头。以未经黑刺粉虱危害的芽下第3片叶片作为对照(CK),每个级别和对照分别采200个叶片备用。
1.3 茶叶生化成分含量测定
将部分采集的茶叶于110℃微波杀青5 min后,80℃烘干,并用磨碎机细磨成粉末后经60目筛网筛除杂质。每个生物学重复称取储备的样品3.0 g放入500 mL锥形瓶中,加入450 mL沸水,然后将其置于沸水浴中浸提45 min,每10 min振荡一次。浸提完毕后,趁热减压过滤。残渣用少量热蒸馏水洗涤2~3次,待茶汤冷却至室温后用蒸馏水定容至500 mL,备用。每个生化成分含量的测定均设3个生物学重复。
茶多酚的测定按国家标准(GB/T 8313-2008)进行测定。吸取备用茶汤1.0 mL,注入25 mL容量瓶中,加入4.0 mL蒸馏水、5.0 mL酒石酸亚铁溶液,充分混匀,再用pH 7.5磷酸盐缓冲液定容至刻度。以试剂空白溶液作参比,在波长540 nm处测定吸光度。
游离氨基酸含量按照国家标准(GB/T 8314-2013)进行测定。准确吸取备用茶汤1.0 mL,注入25 mL容量瓶中,加入0.5 mL的2%茚三酮溶液和0.5 mL的pH 8.0磷酸缓冲液,摇匀于沸浴中加热15 min,取出冷却至室温后用蒸馏水定容至刻度,静置10 min后,以试剂空白溶液作参比,在波长570 nm处测定吸光度。
咖啡碱含量按照国家标准(GB/T 8312-2013)进行测定。准确吸取8.0 mL茶汤于100 mL容量瓶中,加入4.0 mL 0.01 mol/L盐酸溶液和0.8 mL 碱式醋酸铅溶液,用水定容至刻度,混匀静置后过滤。取滤液50 mL于100 mL容量瓶中,加入0.2 mL 4.5 mol/L硫酸溶液定容至刻度,混匀静置后过滤。以试剂空白溶液作参比,在274 nm波长处测定吸光度。
儿茶素总量测定采用香荚兰素比色法进行测定。称取磨碎的茶样1 g(精确至 0.01 g),加20 mL 95%乙醇,在80℃~85℃水浴上提取30 min,使乙醇保持微沸。过滤冷却后用95%乙醇定容至25 mL。吸取10 μL试液,加入盛有1 mL 95%乙醇的刻度试管中。摇匀后加入5 mL 1%香荚兰素盐酸溶液,加塞摇匀显红色。静置40 min,以试剂空白作参比,在500 nm波长处测定吸光度。
可溶性糖含量的测定采用蒽酮法进行测定。吸取1 mL茶汤于25 mL容量瓶再加入8 mL蒽酮试剂,摇匀于沸水浴中加热7 min,立即取出于冷水中冷却至室温。于波长620 nm处测定吸光度,空白对照以1 mL水替代茶汤。
1.4 茶叶抗氧化酶活性的测定
将采集到的不同为害级别的黄金芽叶片鲜叶按重量体积比(g∶mL)为1∶9(CAT)、1∶4(SOD)、1∶9(POD)的比例加入生理盐水研磨匀浆后,25℃ 2 500 r/min离心10 min,取上清用于组织匀浆蛋白浓度及酶活性测定。每处理均设3个生物学重复。
组织匀浆蛋白浓度测定:根据检测试剂盒考马斯亮蓝法(南京建成生物工程研究所)测定各样品中的匀浆蛋白浓度。
CAT, SOD和POD的活力测定严格按照检测试剂盒(南京建成生物工程研究所)进行。根据说明中的公式计算活力值。CAT, SOD和POD的活力测定波长分别为405, 550和420 mm。SOD活性单位定义为每克组织在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个反应单位;POD活力定义为在37℃条件下,每毫克组织蛋白每min催化1 μg底物的酶量定义为一个酶活力单位;CAT活力定义为每毫克组织蛋白每秒分解1 μmol的H2O2的量为一个活力单位。
1.5 数据分析
黑刺粉虱不同为害级别间生化成分及抗氧化酶活力的差异用SPSS19.0软件进行分析。通过Shapiro-Wilk检验和方差同质性检验(homogeneity of variance test)分析数据分布的正态性和方差齐性,得到所有数据均为正态分布,方差具有同质性,随后进行单因素方差分析(one-way ANOVA),对不同处理间的差异进行Tukey HSD多重比较分析(P<0.05)。
2 结果
2.1 黑刺粉虱为害不同级别下黄金芽茶叶生化成分含量的变化
随着黑刺粉虱刺吸黄金芽为害级别的增加,茶叶中茶多酚含量逐渐降低(图1)。除为害级别为Ⅰ级时的茶多酚含量(23.20%±0.67%)与对照之间(25.21%±0.23%)没有显著性差异(P=0.256)外,其余各为害级别的茶多酚含量均显著低于未受到为害的(F4,10=13.650,P<0.001),且以危害级别为Ⅳ级时茶多酚含量最低,为18.82%±0.21%。黑刺粉虱为害不同级别对黄金芽茶叶中游离氨基酸、咖啡碱、可溶性糖及儿茶素含量的影响均无显著性差异(游离氨基酸:F4,10=2.001,P=0.170; 咖啡碱:F4,10=0.656,P=0.636; 可溶性糖:F4,10=0.734,P=0.589; 儿茶酚:F4,10=1.004,P=0.450)。
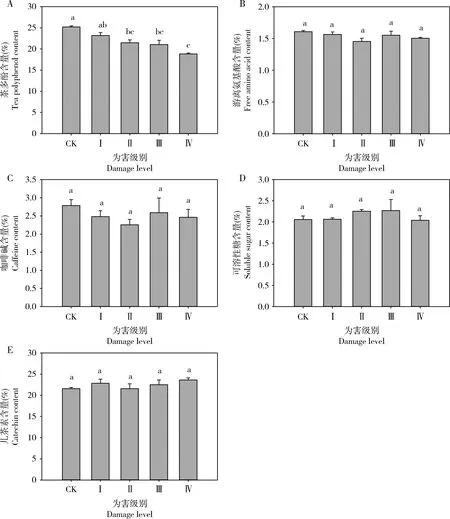
图1 黑刺粉虱为害不同级别下黄金芽芽下第3叶内生化成分含量的变化
2.2 黑刺粉虱为害不同级别下黄金芽茶叶抗氧化酶活力的变化
黑刺粉虱为害黄金芽后,当为害级别达到Ⅰ级和Ⅳ级时黄金芽茶叶中POD活力(分别为57.14±3.98和39.74±0.56 U/mg pro)较未经为害的(34.51±2.20 U/mg pro)有显著的提高,而达到Ⅱ级(28.81±1.01 U/mg pro)和Ⅲ级(20.84±1.29 U/mg pro)时显著降低,各为害级别间的活力均存在显著性差异(F4,10=140.348,P<0.001);当黑刺粉虱为害级别达Ⅰ级时黄金芽茶叶中CAT活力最高,为28.05±0.40 U/mg pro,且显著高于其他为害等级,达到Ⅳ级(13.10±0.60 U/mg pro)时的活力显著降低(F4,10=46.546,P<0.001);黄金芽茶叶中SOD活力随着黑刺粉虱为害等级的增加显著下降(P<0.05),除为害级别为Ⅰ级时SOD活力(863.60±46.06 U/mg pro)与CK(783.11±17.52 U/mg pro)相比无显著性差异(P>0.05)外,其余为害等级间均存在显著性差异(F4,10=171.668,P<0.001),且以为害级别为Ⅳ级时SOD活力最低,为442.73±10.54 U/mg pro。
3 讨论
3.1 黑刺粉虱为害对黄金芽茶叶生化成分含量的影响
茶树体内的茶多酚、游离氨基酸、咖啡碱、可溶性糖、儿茶素等物质的含量变化影响茶叶的口感和品质,也是茶树表现对害虫抗性的生化基础。本研究以黄金芽芽下第3叶为研究对象,依据是黑刺粉虱成虫产卵于新展开的嫩芽上,随着幼虫的孵化生长及新芽的出现而变成第3-4叶,且第3-4叶具有相对较大的叶面积和较强的光合能力,干物质积累较大(王峰等, 2016),其同化产物为新芽发育提供重要营养物质。本研究的结果可以看出,黑刺粉虱不同为害级别对茶叶内茶多酚、游离氨基酸、咖啡碱、可溶性糖、儿茶素含量的变化有不同的影响(图1)。
植物被昆虫为害后,体内部分生化成分的种类及数量会有所改变,包括营养物质含量和次生代谢物的变化,而寄主植物的营养状况也是影响植食性昆虫的生长、发育和繁殖的重要因素,同时也是影响其寄主选择性的重要因素(陈常颂等, 2007)。糖类是生物体内能量的主要来源,葛超美等(2018)研究发现,可溶性糖含量高的茶树品种被害指数高,茶树抗性品种新梢的含糖量明显低于易感品种。李传明等(2017)对烟粉虱的研究发现,辣椒叶片中可溶性糖含量随烟粉虱为害呈明显下降趋势,抗虫品种的下降幅度大于感虫品种。本研究的结果显示,黑刺粉虱为害不同等级下的黄金芽体内可溶性糖的含量与对照没有明显变化,可能是由于茶树自身应对虫害损失提高了自身的补偿能力。研究表明,在适当的条件下,植物可以通过一系列生理变化对虫害引起的损失进行补偿或超补偿(Trumbleetal., 1993; Lennartssonetal., 1998),且茶树对茶尺蠖Ectropisobliqua取食危害的光补偿反应也印证了这一观点(童鑫等, 2007)。植物中酚类被认为可以通过植食性昆虫取食诱导并参与植物的抗虫作用中去(Czerniewiczetal., 2017);葛超美等(2018)研究灰茶尺蠖Ectropisgrisescens对茶树的选择性研究发现其与茶树体内茶多酚含量呈负相关,说明茶多酚含量越高茶树抗性越强。本研究发现,茶叶受危害后,体内茶多酚的含量显著下降,可能也会降低茶叶对黑刺粉虱的抵抗能力,而且随着为害等级的增加茶多酚含量显著下降,抗性的降低也可能使黑刺粉虱发生加重。王敏(2016)对小绿叶蝉的研究也发现相似的变化趋势,即随着危害程度的提高茶多酚含量显著降低。此外,儿茶素是茶叶体内主要的酚类成分。冉伟等(2018)研究发现,茶尺蠖幼虫为害提高了茶树儿茶素合成途径的代谢强度和儿茶素类化合物的积累。本研究发现,黑刺粉虱为害黄金芽后体内儿茶素含量有一定的升高,但是与对照差异不显著(图1),说明影响茶多酚含量显著降低是其他种类的酚酸类的减少造成的,需进一步研究。氨基酸是植食性昆虫的主要氮源之一,并且植食性昆虫取食添加氮元素的食物,通常会发育得更快而且能够更好地存活和繁殖(Mattson, 1980; Woods, 1999; Leeetal., 2002; Chenetal., 2009)。Tomczak(2001)研究发现二斑叶螨Tetranychusurticae的为害会降低菊花叶片中游离氨基酸的浓度;对茶橙瘿螨的研究发现茶树新梢中氨基酸浓度较高时能在一定程度上能抑制其取食和繁殖,茶树抗性与氨基酸含量呈正相关(陈华才等, 2000);灰茶尺蠖幼虫也不喜食游离氨基酸含量高的叶片(葛超美等, 2018)。本研究中黑刺粉虱的为害并没有引起黄金芽体内游离氨基酸含量的变化(图1)。植物体内咖啡碱与植物的抗虫性可能存在一定的关系,Wang等(2016)研究发现了6个茶咖啡因合成酶(Tcs)基因,并推断可能与抗虫性有关,黑刺粉虱为害后黄金芽体内咖啡碱的含量有所降低,但差异并不显著,咖啡碱是否影响茶树对黑刺粉虱的抗性还需要深入研究。
3.2 黑刺粉虱为害对黄金芽茶叶抗氧化酶活力的影响
植物通过抗氧化酶加强抗氧化作用提高对逆境的抗性,从而防止自由基毒害(Inbaretal., 1999; McKenzieetal., 2002)。刺吸式昆虫的刺吸为害会导致植物体内氧代谢的失调,体内活性氧物质的过度积累,造成生物膜的过氧化损伤,引起叶绿体、线粒体等细胞器的功能降低及DNA等其他大分子生物的降解和失活,最终引起细胞的凋亡(周丹丹等, 2009)。一旦体内活性氧的含量超标,寄主植物便会启动自身的活性氧清除系统包括酶促活性氧清除系统(如SOD, POD和CAT)和非酶促性活性氧清除剂(如类胡萝卜素)等,对氧化胁迫具有一定的适应及抵抗能力。受黑刺粉虱为害后黄金芽体内的POD, CAT和SOD活力随着为害等级的增加,均出现先升高后显著降低的变化趋势,且均在为害等级为Ⅰ级时有最大值(图2),这说明黄金芽对黑刺粉虱的为害并不能诱导形成明显的抗氧化能力。当为害等级达到Ⅰ级,即黑刺粉虱刺吸为害较轻时,黄金芽体内的POD和CAT活性会迅速上升,可会及时将过剩的自由基清除;随着黑刺粉虱虫量增多,为害等级增加,产生自由基的速度可能已经超过SOD, CAT和POD的降解速度,使活性氧过度积累,造成生物膜的过氧化和叶绿体、线粒体等细胞器的功能损耗,导致黄金芽发育不良。
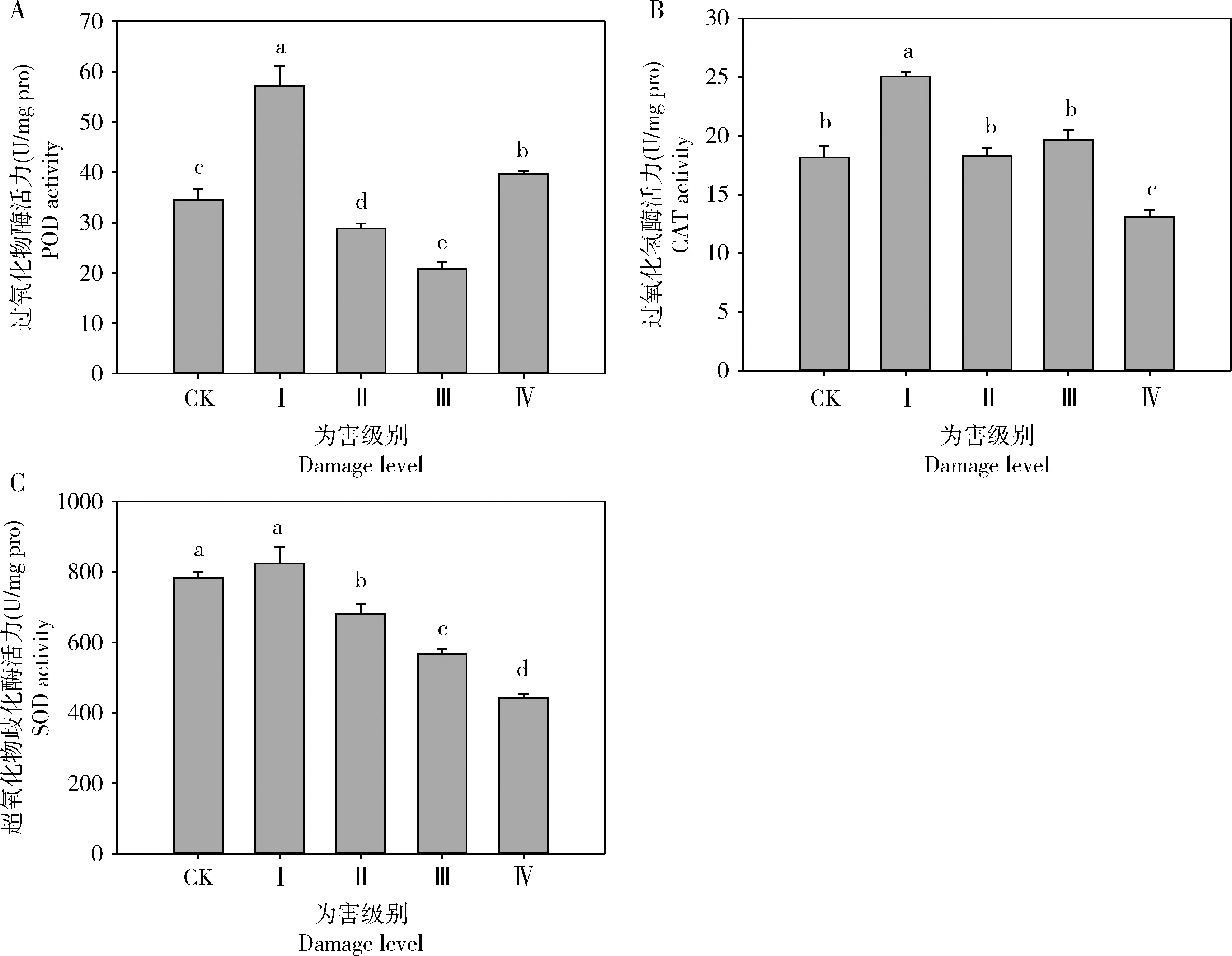
图2 黑刺粉虱为害不同级别下黄金芽芽下第3叶内抗氧化酶活力的变化
郑雨婷等(2017)通过对比不同茶树品种应对茶小绿叶蝉为害后体内抗性物质的变化,发现不同学者对茶树抗叶蝉性能与茶叶化学成分之间的说法不一致,需要进一步求证。本研究则是通过研究黑刺粉虱密度增加是否会引起茶树自身防御物质的改变,从而判断茶树自身是否对黑刺粉虱为害有一定的防御能力。王庆森等(2009)测定了12种茶树叶片组织结构与黑刺粉虱的发生关系,并发现黑刺粉虱的生殖与存活与气孔密度呈显著的正相关,与叶片下表皮厚度呈显著的负相关。Tian等(2018)测量叶片组织发现黄金芽栅栏组织厚度和海绵组织厚度均大于福鼎大白,这可能是田间黄金芽上黑刺粉虱发生量较大的原因,还需要进一步研究。
3.3 结语
综上所述,黑刺粉虱为害对黄金芽茶叶体内与抗性提高相关的生化物质咖啡碱和儿茶素含量,以及与抗逆补偿相关的游离氨基酸和可溶性糖含量均没有显著性影响,但茶多酚含量显著降低,3种抗氧化酶活性随黑刺粉虱为害级别增加呈现先升高后显著降低的趋势,说明黄金芽抗黑刺粉虱为害的能力较弱,需要加强黄金芽上黑刺粉虱发生的科学管理。

