糜子溶磷内生真菌的筛选及其鉴定
杨 刚,余仲东,赵世伟,3,郭威震,李 喆
(1.西北农林科技大学 资源环境学院,陕西 杨凌 712100;2.西北农林科技大学 林学院,陕西 杨凌 712100;3.西北农林科技大学 水土保持研究所,陕西 杨凌 712100)
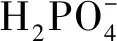
糜子(Panicummiliaceum)最早发源于中国,相较于其他农作物具有更悠久的历史。经过长期的自然选择和栽培驯化,糜子越来越能够适应干旱、半干旱地区的贫瘠和干涸,这使得它具有了抗旱、耐贫瘠的优点,并且由于它对氮、磷等营养元素的吸收性好而且生育期很短,使它成为了如今干旱、半干旱地区的主要农作物之一,在解决粮食问题的同时,糜子更为干旱、半干旱带来较为可观的经济效益,这使它成为了国家和人民重点种植推广的作物,并成为了我国抗灾备荒、增产增收必不可却的农作物[13-15]。近年来,由于干旱、半干旱地区磷肥及一些高浓度复合肥的大量使用,不仅使得土壤中磷素过剩,利用率低,还导致了一系列的环境污染问题。小麦、玉米、水稻等大众农作物根际土壤和植株体内的溶磷菌已被广泛筛选和开发利用,溶磷机理也逐步得到阐明[16],极大地促进了这些农产品的“绿色生产”,而对于糜子内生菌的开发利用目前尚无研究报道。本试验从产自宁夏回族自治区和甘肃省的糜子种子中分离、筛选出具有高效溶磷能力的菌株,通过盆栽试验研究了这些溶磷真菌对糜子苗期生长发育的影响及其解磷效果,以期为糜子的“绿色生产”和高效栽培提供技术依据。
1 材料与方法
1.1 材 料
选用产自宁夏回族自治区(固糜21号、宁糜11号、宁糜14号)和甘肃省(陇糜9号、陇糜13号、陇糜14号)两地不同品种健康饱满的糜子种子,于2018年10月采集后装于自封袋中,在实验室中4 ℃保存,用于进行快速的分离培养。供试培养基包括:PDA培养基(马铃薯200 g,葡糖糖20 g,琼脂15 g,自来水1 000 ml自然pH值);NBRIP培养基:葡萄糖10 g,Ca3(PO4)25 g,MgSO4·7H2O 0.25 g,MgCl2·6H2O 5 g,KCl 0.2 g,(NH4)2SO40.1 g,蒸馏水1 000 ml,琼脂16 g,pH值6.5~7.5,液体培养基不加琼脂。营养琼脂培养基:蛋白胨10 g,牛肉膏3 g,氯化钠5 g,琼脂17 g,蒸馏水1 000 ml,pH值为7.2。
1.2 方 法
1.2.1 溶磷真菌的分离 将采自宁夏(固糜21号、宁糜11号、宁糜14号),甘肃(陇糜9号、陇糜13号、陇糜14号)不同品种健康饱满的糜子种子在自来水下洗净后转移至超净台。消毒方法参考López-López等[17]的消毒方式并稍加改进。第一轮消毒,1 g种子首先用40 ml自来水冲洗3次,然后用40 ml蒸馏水冲洗3次。清洗后的种子用40 ml 3.5%次氯酸钠溶液浸泡5 min,然后用50 ml无菌蒸馏水洗涤3次。第2轮消毒,将种子浸泡在40 ml 96%乙醇中5 min,然后用50 ml无菌蒸馏水进行5次彻底清洗。检查表面消毒,将100 μl最终冲洗水在营养琼脂平板培养,在28 ℃下培养4 d,若无任何细菌真菌生长,则表明消毒完成。将表面消毒灭菌后的糜子种子分别接入PDA培养基(规格:90 mm一次性培养皿),每个PDA培养皿中均匀放置3粒种子,5次重复。在恒温培养箱中培养7~12 d,温度设置为25 ℃,通过观察菌落形态的差异并进行纯化,直至得到单一的纯菌落。菌落编号后用斜面PDA保存于4 ℃冰箱中备用。
1.2.2 溶磷真菌的筛选 将上述分离纯化得到的菌株分别接种于NBRIP固体平板培养基上,26 ℃恒温培养箱培养20 d,测定菌落直径(d)和溶磷圈直径(D),并计算D/d,对得到的菌株进行初步筛选。将初步筛选得到的具有溶磷作用的菌株接种于PDA培养基,恒温培养箱26 ℃扩繁培养10 d;将扩繁后的菌株在超净工作台进行无菌操作,取5个直径5 mm的菌块接种至盛有50 ml灭菌NBRIP液体培养基的锥形瓶中(锥形瓶规格:150 ml),以接种无菌PDA培养基块为对照(CK),每个菌株3个重复,恒温振荡仪振荡培养7 d(27 ℃,120 r/min),振荡完毕后用定性滤纸过滤,用pH计测定pH值并采用钼锑抗比色法测上清液有效磷含量,用UV-1800紫外可见分光光度计在880 nm处测定OD值,计算上清液有效磷含量的溶磷率,结合溶磷圈大小确定不同菌株对无机磷的溶解能力。
溶磷率=〔(接菌培养基中可溶性磷含量—接培养基的对照组中的可溶性磷含量)/加入的无机磷源的总磷量〕×100%
1.2.3 盆栽试验 将筛选后的溶磷内生菌打碎孢子团,加无菌水制作菌悬液,菌悬液分生孢子浓度1.0×106个/ml,将灭菌后的固糜21号种子,在菌悬液中浸泡24 h后播种,试验采用石英砂+蛭石(体积比2∶1)的混合灭菌基质每盆1.55 kg,将磷酸三钙以6 g/kg混合施入基质(模拟土壤中的无机磷成分),装入规格为内径18.5 cm,外径21 cm,高11.5 cm,底径14 cm的塑料花盆内。试验对5种供试溶磷真菌菌液和不加菌液的无菌水(对照)分别设置4磷素梯度即施加无P,1/5 P,1/2 P,全P Hoagland灭菌营养液(见表1),共24个处理,每处理3重复,共72盆。将浸泡后的固糜21号种子进行播种,每盆浇灌稀释1/2后的全P灭菌Hoagland营养液500 ml后覆膜,出苗一周后去掉薄膜选择长势相近的植株间苗(每盆保留10株)并进行磷素控制,各磷素梯度每10 d浇灌灭菌Hoagland营养液500 ml,各菌悬液500 ml。试验将于2019年5月10日于中国科学院固原生态试验站旱棚内进行,于2019年6月20日收获。
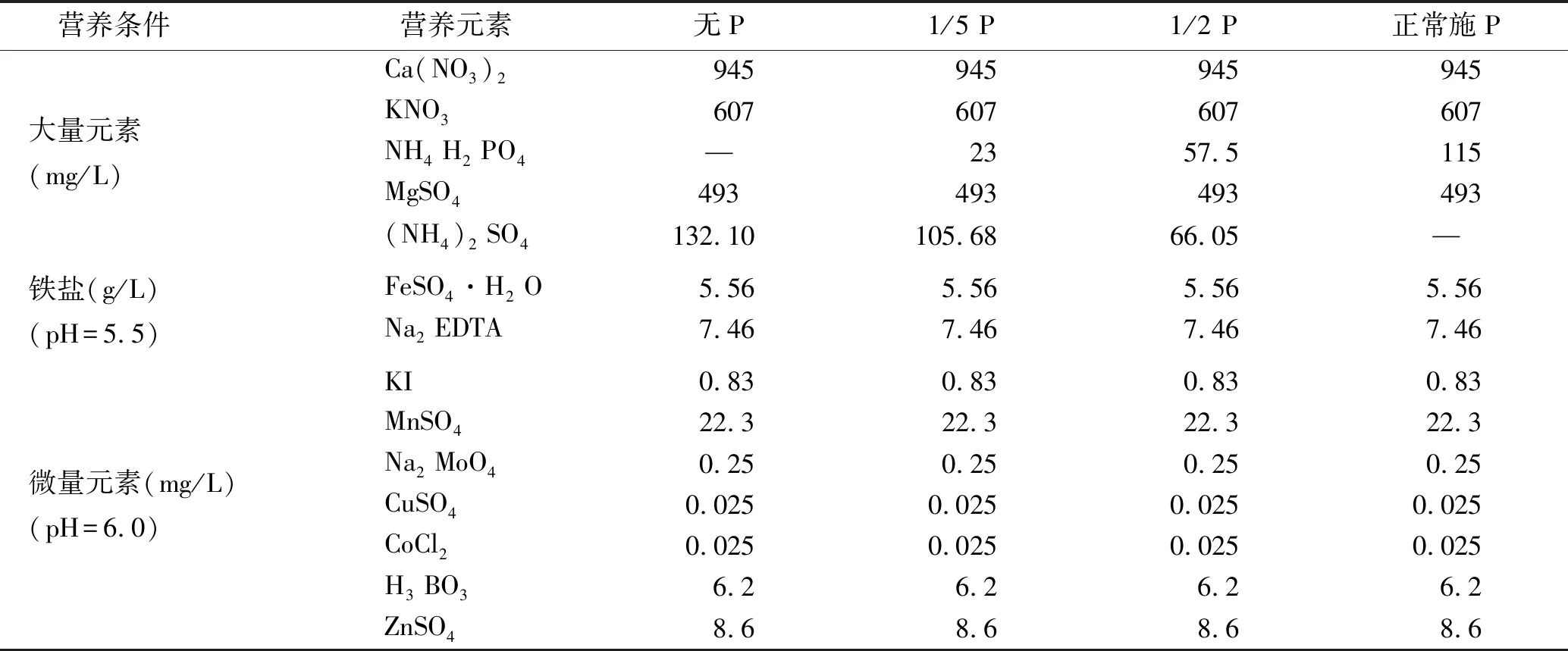
表1 不同磷素(P)梯度Hoagland营养液
1.2.4 测试指标 于2019年6月20日用叶绿素测定仪LYS-A型测试糜子SPAD值,用LI-6800便携式光合仪测试糜子净光合速率。采集糜子植株测其株高、鲜重,105 ℃下杀青30 min,75 ℃烘干至恒重后测定干重。将植株干样粉碎后用H2SO4-H2O2消煮,钼黄比色法测定植株全磷含量。
1.2.5 溶磷内生真菌的鉴定 利用通用引物ITS1/ITS4(ITS1:5‘-TCCGTAGGTGAACCTGCGG-3’,ITS4:5‘-TCCTCCGCTTATTGATATGC-3’)对溶磷内生菌菌株核糖体基因转录间隔区进行扩增。PCR体系为:Premix TaqTM 15 μl(Takara Biotechnology Co.,Ltd.,Dalian,China No.RR003A),DNA 2 μl,ITS1引物1 μl,ITS4引物1 μl,ddH2O 11 μl。PCR循环条件:94 ℃预变性5 min,94 ℃变性30 s,54 ℃退火30 s,72 ℃延伸45 s,40次循环,72 ℃延伸10 min。取3 μl PCR扩增产物,在混有0.01%EB核酸染剂的1%琼脂糖凝胶上进行电泳,紫外凝胶成像仪下进行检测。PCR扩增产物纯化后送上海生工生物技术有限公司测序。将测序所得结果通过Chromas软件进行校订,校订后的序列提交GenBank数据库,并在NCBI的GenBank数据库中用Blast程序与数据库中的序列进行比对,寻找匹配度最高的生物序列进行溶磷内生真菌的鉴定。初步确定溶磷内生菌的分类学地位。对溶磷效果明显的菌株,下载同源序列,用Clastw比对后,采用MEGA 6.0软件构建NJ系统树,拓扑树检验重复1 000次。
1.2.6 数据处理 运用Excel和IBM SPSS Statistics 20.0软件进行数据处理和统计分析,LSD法进行多重比较,判断差异显著性;采用Origin 2016软件绘图,MEGA 6.0软件构建系统树。
2 结果与分析
2.1 溶磷真菌的初步筛选
溶磷圈指的是在溶磷微生物的作用下,将无机磷固体培养基中的难溶性磷酸盐溶解,在菌落周围形成的透明地带,一般将溶磷圈直径(D)与菌落直径(d)的比值(D/d)视为初步筛选溶磷菌株能力大小的指标之一。D/d值越大,其溶磷能力也就越强[18-19]。从宁夏、甘肃当地糜子种子内分离的内生真菌中,固糜21号分离得到4株,宁糜11号5株,宁糜14号4株,陇糜9号3株,陇糜13号3株,陇糜14号6株。在以磷酸三钙为唯一磷源的固体培养基中能产生溶磷圈的菌株有5株。其中2株来自甘肃省,编号为LM1和LM2;3株来自宁夏,编号为GM1,GM2,GM3。在连续观察5株菌株20 d内发现,5株菌株生长至16 d时,D/d值基本趋于稳定,整体表现为:GM1>GM3>LM1>LM2>GM2,其中GM1,GM3号菌株D/d值达到了1.59和1.47,初步判断这两株菌株溶磷能力强于其他菌株(见图1)。

注:LM1,LM2分别代表来自甘肃省糜子品种的2株菌株;GM1,GM2,GM3分别代表来自宁夏回族自治区糜子品种的3株菌株。下同。
2.2 溶磷真菌的复筛及溶磷能力的比较
将5株可溶性溶磷真菌在NBRIP液体培养基中培养,并测定其培养液中的可溶性磷含量及pH值(见表2)。5株溶磷内生真菌对Ca3(PO4)的溶解能力很强,各菌株培养液中的可溶性磷含量及溶磷率均显著(p<0.05)高于空白对照,各菌株可溶性磷含量在164.88~323.48 μg/ml,溶磷率范围在3.26%~6.43%。其中,GM3号菌株的溶磷效果最好,显著(p<0.05)高于其他菌株,溶磷率为6.43%,可溶性磷含量达到了323.48 μg/ml。GM1,GM2,LM1,LM2依次次之,溶磷率分别达到了5.26%,4.36%,3.56%和3.26%,可溶性磷含量分别为264.75,219.65,180.03,164.88 μg/ml。这与初步筛选得到的结果基本一致,进一步确定GM3,GM1号菌株溶磷能力较强。
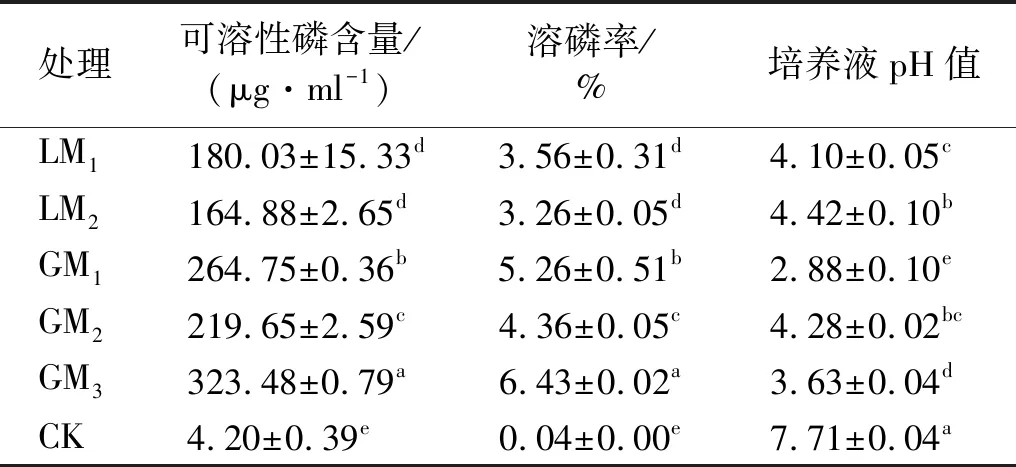
表2 溶磷真菌对Ca3(PO4)2的溶解能力
从培养液中的pH值看,各处理均显著(p<0.05)低于对照,其中GM1,GM3号菌株培养液的pH值最低,分别为2.88,3.63。LM1,LM2,GM2号菌株的培养液pH值在4.1~4.4。从溶磷率与pH值的变化趋势来看,随着溶磷率的提高,pH值大致呈下降的趋势。相关性分析表明,5株溶磷真菌溶磷率(X)与其pH值(Y)呈极显著负相关(r=-0.899**,p<0.001),线性回归方程为:
Y=-0.678X+7.093
2.3 接种溶磷真菌对糜子苗期生理特征及植株全磷的影响
2.3.1 接种溶磷真菌对糜子苗期生长的影响 在不施P的情况下,GM3号处理下的糜子干重较对照增加178%(见表3)。在施1/5 P及常量施P时,不同菌株对糜子的苗期株高、鲜重、干重的影响不明显。在施1/2 P时,GM3,GM1号菌株均能够显著(p<0.05)增加糜子苗期株高和鲜重,株高较对照分别增加了24.9%和26.5%,鲜重较对照分别增加了44.52%,42.89%。

表3 不同磷素梯度下溶磷真菌对糜子苗期生长的影响
从5株溶磷真菌在4种不同磷素梯度下对糜子苗期株高、鲜重、干重的影响来看,GM1,GM3号菌株较于其他菌株对糜子苗期的生长促进作用更大,而且在磷素梯度为1/2 P时对糜子株高、鲜重、干重的增加更加明显。
2.3.2 溶磷真菌对糜子苗期叶绿素的影响 SPAD值是衡量植物叶绿素相对含量的一个参数。由图2可知,不施P时,各处理间糜子的SPAD值在16.97~19.21。常量施P时,各处理间糜子的SPAD值在18.88~21.29。在这两种磷素梯度下,各菌株处理下的SPAD值较对照虽有变化,但差异并不明显。施1/5 P时,GM3,GM2号菌株处理下的糜子SPAD值显著(p<0.05)高于对照,达到了20.63和20.3,较对照分别提高20.67%和18.71%。施1/2 P时,GM3,GM1号菌株处理下的糜子SPAD值为21.46和21.6,与对照相比,增加22.28%,23.07%。整体来看,在不施P及常量施P的情况下,各菌株对糜子SPAD值的影响并不大。在施P为1/5,1/2时,GM3号菌株均能显著增加糜子SPAD值。
2.3.3 溶磷真菌对糜子苗期净光合速率的影响 如图3所示,不施P时,GM1,GM2,GM3号菌株处理下的糜子净光合速率较对照分别提高45.12%,48.92%和52.2%。施1/5 P时,GM3号菌株处理下的糜子净光合速率显著(p<0.05)高于其他处理,达到了23.2 μmol/(m2·s),较对照提高145.76%,同时,LM1,GM1,GM2处理下的糜子净光合速率均显著(p<0.05)高于对照,分别提高48.47%,74.58%,69.49%。施1/2 P时,GM3号菌株处理下的糜子净光合速率为25.87 μmol/(m2·s),显著(p<0.05)高于其他处理,与对照相比提高104.18%,同时,LM1,GM1,GM2处理下的糜子净光合速率均显著(p<0.05)高于对照,分别提高40.34%,60.22%,55.25%。常量施P时,GM3号菌株处理下的糜子净光合速率为25.47 μmol/(m2·s),显著(p<0.05)高于对照,较对照提高61.71%。整体看来,在不同磷素梯度下,各菌株处理下的糜子苗期净光合速率与对照相比有明显差异,GM3号菌株在4种磷素梯度下均能显著增加糜子净光合速率且增幅最大。
2.3.4 溶磷真菌对糜子植株苗期全磷的影响 由图4可以看出,不施P时,GM3号菌株能够显著(p<0.05)增加糜子植株全磷含量,为8.87 mg,较对照增加290.74%。施1/5 P时,与对照相比,GM3号菌株处理下的糜子植株全磷显著(p<0.05)增加了168.35%,含量达到了10.09 mg/盆。施1/2 P时,GM3号菌株处理下的糜子植株全磷含量为12.39 mg/盆,较对照显著提高121.25%。常量施P时,各处理下的糜子植株全磷与对照相比无显著差异。在缺磷或少磷情况下,GM3号菌株均能显著提高糜子植株全磷含量。

注:不同字母表示不同处理间差异达0.05显著水平,未标注则差异不显著。下同。
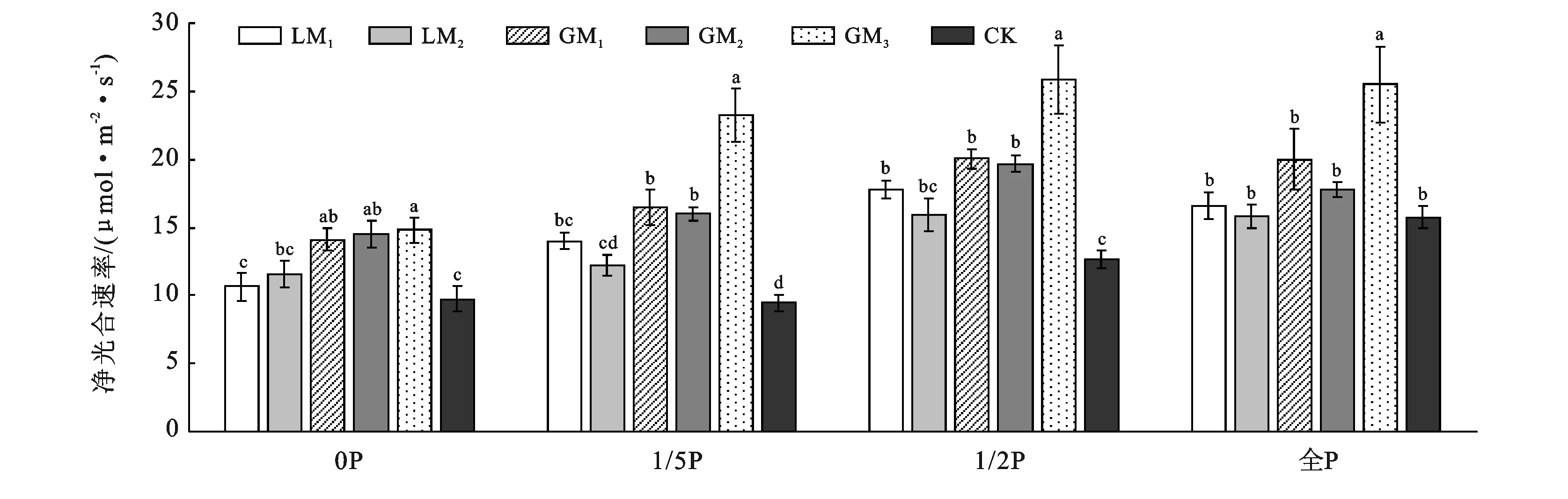
图3 溶磷真菌对糜子苗期净光合速率的影响

图4 溶磷真菌对糜子植株苗期全磷的影响
2.4 溶磷真菌的初步鉴定
采用CTAB法分别提取5株溶磷真菌的DNA,并利通用引物ITS1/ITS4对5株溶磷真菌菌株核糖体基因转录间隔区进行扩增。PCR扩增产物纯化后送上海生工生物技术有限公司双向测序。
将测序所得结果通过Chromas软件进行校订后,将5株溶磷内生真菌的18 SrDNA ITS区序列分别与GenBank中的菌株序列进行相似性分析进行初步鉴定(结果见表4)。
由表4可见,LM1,LM2,GM1为黄丝曲霉属(Talaromycessp.),GM2,GM3为青霉属(Penicilliumsp.),初步确定了5株溶磷内生菌的分类学地位。从以上5种溶磷内生真菌在盆栽试验的综合表现来看,菌株GM3号表现最为优异,为本试验得到的促生潜力菌株。
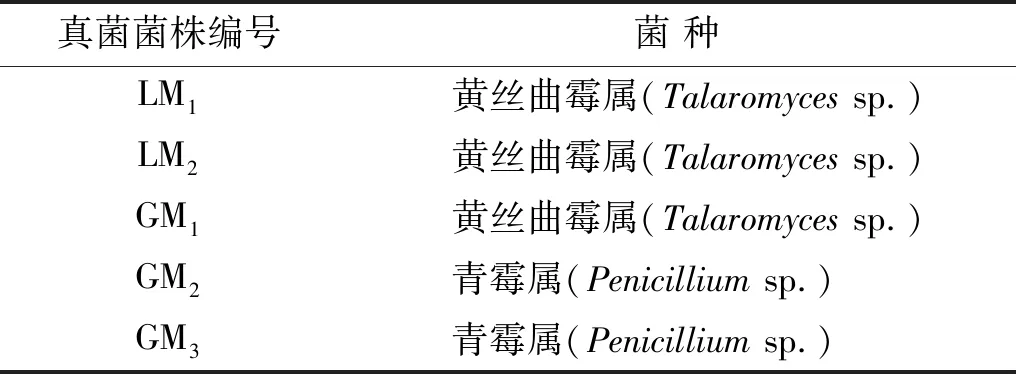
表4 溶磷内生真菌初步鉴定结果
GM3的ITS rDNA经PCR扩增后,扩增产物长度为500~520 bp。从NCBI数据中下载GM3的同源序列,用Clastw比对后,采用MEGA 6.0软件使用临近(NJ)法对GM3菌株及所下载相似度较高菌种的ITS序列构建系统发育树(见图5),鉴定菌株GM3为产黄青霉(Penicilliumchrysogenum),GenBank序列登记号为MT229079,系统发育树按一定比例绘制,分支长度用于推断系统发育树的进化距离。
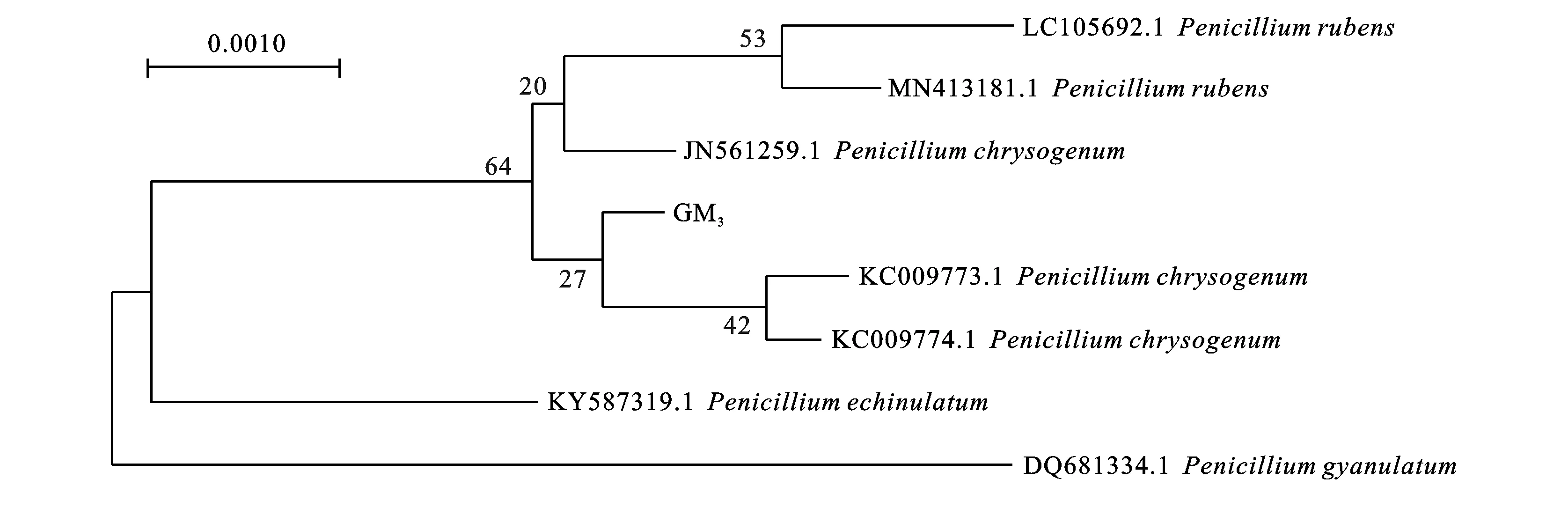
图5 产黄青霉GM3菌株的系统发育树
3 讨 论
通过溶磷圈直径、菌落直径及二者比值只能直观定的表示溶磷真菌的溶磷能力,只通过这种方式来判断溶磷能力大小并不准确和可靠[20-21],若想进一步确定溶磷能力的强弱还需要定量的测定培养液中的可溶性磷含量。如图1可以看出,GM1,GM3号菌株D/d值达到了1.59和1.47,而在表2中GM1,GM3号菌株可溶性磷含量分别为264.75,323.48 μg/ml,两种方法得到的结果有差异,这可能是由于不同菌株对环境的适应性不同所致。
溶磷真菌类主要有青霉菌(Penicillium)、曲霉菌(Asperillus)、根霉(Rhizopus)、镰刀菌(Fu-sarium)、小菌核菌(Selerotium)等[22]。本研究从糜子种子内得到的5株溶磷真菌,其中:LM1,LM2,GM1为黄丝曲霉属(Talaromycessp.),GM2,GM3为青霉属(Penicilliumsp.)。其中溶磷效果较好的GM3号菌株经系统鉴定为产黄青霉(Penicilliumchrysogenum)。溶磷微生物溶磷过程非常复杂,存在多种机理,主要机制包括质子的释放、有机酸的产生和酸性磷酸酶的生物合成作用[23-24]。微生物分泌有机酸机制是人们目前广泛接受的学术理论[25]。越来越多的研究表明,溶磷量与培养液中的pH值存在一定的负相关性[22,26]。在本试验中,从溶磷真菌复筛的结果中可以看出,各菌株培养液中的pH值均显著低于对照并且随着溶磷率的提高,pH值大致呈下降的趋势。经相关性分析5株溶磷真菌的溶磷率与培养液中的pH值呈极显著负相关,这与徐冰等[27]、刘辉等[28]的研究结果基本一致。
在植物根系接种溶磷真菌不仅可以提高植物吸收磷素,转化难溶性磷为有效磷[9],还能够增强叶片的光合作用,提高植物的碳素营养,促进植物生长,增加植物的生物量或干重[29]。
在本次的盆栽试验中,供试的5个曲霉科菌株都对苗高、鲜重、叶绿素含量、光合速率、植株磷素累积有促进作用,其中GM3效果较好。
在不施P的情况下,GM3号处理下的糜子干重较对照显著增加178%。施1/2 P时,GM3号菌株能够显著(p<0.05)增加糜子苗期株高和鲜重,株高较对照增加24.9%,鲜重较对照增加44.52%。叶绿素是植物进行光合作用的主要色素并且在光合作用的光吸收中起核心作用,而净光合速率指的是植物光合作用积累的有机物,很大程度上能反映出植物的营养状况和健康程度[30]。施1/5 P和1/2 P时,GM3号菌株处理下的糜子SPAD值分别达到了20.63,21.46,净光合速率分别达到了23.2和25.87 μmol/(m2·s)且显著(p<0.05)高于对照。磷不但是植物体中许多重要化合物的成分,而且以多种方式参与植物的新陈代谢[1]。在缺P,1/5 P及1/2 P情况下,GM3号菌株较对照分别增加了290.74%,168.35%,121.25%的植株全磷含量,这表明在缺磷或者少磷的情况下GM3号菌株均能有效增加糜子的磷素累积。溶磷真菌将难溶的磷酸三钙中的磷释放出来,一部分供真菌自身生长繁殖所需在菌体中积累起来,另一部分可被植物吸收利用[31]。在常量施P情况下,磷素对于苗期糜子的生长发育已经足够,溶磷菌株的作用可能很大程度被减弱甚至掩蔽。盆栽试验中虽然验证了溶磷真菌对糜子生理特征的影响,但其机理性仍需进一步的研究。
曲霉科真菌是Class 1型内生真菌,可通过种子进行垂直传播,对糜子适应干旱和半干旱环境具有重要的作用[32]。青霉和曲霉是沙漠植物常见的内生真菌,他们的菌丝含有明显的色素,又称为色素真菌[33-34],这些色素可以帮助植物吸收紫外线,提高植物耐高温和干旱的能力。本研究在分离的糜子中,20%的种子发现有这些真菌,他们在糜子适应性、产量和品质方面的作用尚需要进一步研究。
4 结 论
从宁夏、甘肃不同糜子品种内共分离得到25株内生真菌,其中的5个内生菌株属曲霉科真菌,它们具有一定的溶磷能力,经初步鉴定后发现LM1,LM2,GM1为黄丝曲霉属(Talaromycessp.),GM2,GM3为青霉属(Penicilliumsp.),其中GM3经鉴定为产黄青霉(Penicilliumchrysogenum)。GM1,GM3号菌株为溶磷能力较强的菌株,可溶性磷含量分别为264.75和323.48 μg/ml,溶磷率分别高达5.26%和6.43%。5株溶磷真菌的溶磷率与pH呈极显著负相关(r=-0.899**,p<0.001),这表明溶磷菌的溶磷能力可能与其分泌的酸有关。在1/5 P和1/2 P处理下,GM3产黄青霉(Penicilliumchrysogenum)处理下的糜子SPAD值分别为20.63和21.46,较对照提高20.67%,22.28%;净光合速率分别达为23.2和25.87 μmol(m2·s),较对照提高145.76%,104.18%;植株全磷含量分别为10.09和12.39 mg/盆,较对照提高168.35%,121.25%,均显著高于对照。表明GM3对糜子促生作用明显,表现出了良好的溶磷效果,研究结果为旱地糜子生产实现“减肥减药”提供了一个新的技术途径。

