鸡源复合益生菌对青年白羽肉杂鸡免疫球蛋白和Toll样受体通路的影响
桂雪儿,王 志,李思婷,贺濛初,朱 杰,冯士彬,吴金节,*
(1.安徽农业大学 动物科技学院,安徽 合肥 230061; 2.宣城木子禽业专业合作社,安徽 宣城 242000)
益生菌是一类对宿主有益的活性微生物,定植于机体肠道、生殖系统内,能改善宿主微生态平衡,发挥有益作用。截至目前,已有多种益生菌被应用于家禽生产,应用最多的是乳酸菌、芽孢杆菌和酵母菌。益生菌在肠道生长和定殖后,对肠道免疫产生重要作用。有研究发现,许多益生菌对机体免疫能产生刺激作用,肠道内有益菌群数的增加可抑制有害菌群的生长繁殖,从而增强家禽的抗病能力和免疫能力[1-5]。Toll样受体(toll-like receptors,TLRs)是一类I型跨膜糖蛋白模式识别受体,通过识别病原相关分子模式激活天然免疫。髓样分化蛋白88(myeloid differentiation protein 88,Myd88)是Toll样受体信号通路中的关键接头蛋白,起传递信息的作用。TLRs在家禽各个器官中都参与抗病原菌感染作用,其中Toll样受体2(TLR2)和Toll样受体4(TLR4)通过影响下游Myd88依赖通路,改变肿瘤坏死因子受体相关因子-6(tumor necrosis factor receptor-related factor-6,TRAF-6)和激活蛋白-1(activator protein,AP-1)表达,影响血清中免疫球蛋白含量[6-10]。
白羽肉杂鸡父本是快大鸡,母本是商品蛋鸡,因其生长快速,常用于规模化生产。为了提高白羽肉杂鸡的抗病能力和免疫能力,基于同源益生菌适用性更优原则,本试验从健康白羽肉杂鸡肠道中分离乳酸菌和芽孢杆菌,经液体发酵制成鸡源复合益生菌制剂,旨在探讨其对肉鸡免疫球蛋白和Toll样受体通路的影响,为鸡源复合益生菌的临床应用提供试验依据。
1 材料与方法
1.1 试验材料
复合益生菌为安徽农业大学动物科技学院临床兽医实验室提供的分离筛选自白羽肉杂鸡肠道中的乳酸菌BNCC134981和枯草芽孢杆菌L61,对其进行液体发酵后实测有效活菌数为1×108CFU·mL-1。
1.2 试验饲粮
饲粮配制参考NRC(1994)家禽营养需要,基础饲粮组成及其营养水平见表1。经测算,配制的饲粮代谢能为13.26 MJ·kg-1。
1.3 试验设计
单因素完全随机分组试验设计,将180只初始体质量相近的白羽肉鸡作为父本、海兰白作为母本的28日龄健康白羽肉杂鸡随机分为3组,A组饲喂基础饲粮,B组在基础饲粮中添加1011CFU·kg-1益生菌,C组在基础饲粮中添加2×1011CFU·kg-1益生菌,每组3个重复,每个重复20只,各重复初始体质量无显著差异。采用拌料喂鸡,安徽宣城木子禽业专业合作社养鸡场提供试验场地和试验动物。试验期21 d,按常规免疫程序进行预防免疫。
1.4 样本采集与处理
白羽肉杂鸡34、41、48日龄时,颈静脉采血,分离血清,-20 ℃保存。白羽肉杂鸡48日龄时,每组随机挑选5只体质量相近的鸡空腹屠宰,采集空肠样品,放于-20 ℃冰箱中冷冻贮藏备用。
1.5 指标检测
1.5.1 免疫球蛋白ELISA检测
按照ELISA试剂盒详细步骤要求,检测34、41、48日龄白羽肉杂鸡血清IgG、IgM、IgA水平。
1.5.2 RT-qPCR法检测空肠TLR2、TLR4、Myd88、TRAF-6、AP-1 mRNA相对表达量
Trizol法提取鸡空肠RNA,使用分光光度计检测RNA纯度,反转录为cDNA进行qPCR检测。反应体系为20 μL:cDNA模板2 μL,上、下游引物各0.5 μL,qPCR mix 10 μL,ddH2O 7 μL。利用Primer Premier 5.0软件设计试验所用特异性引物,并由南京擎科生物科技有限公司合成,引物序列见表2。
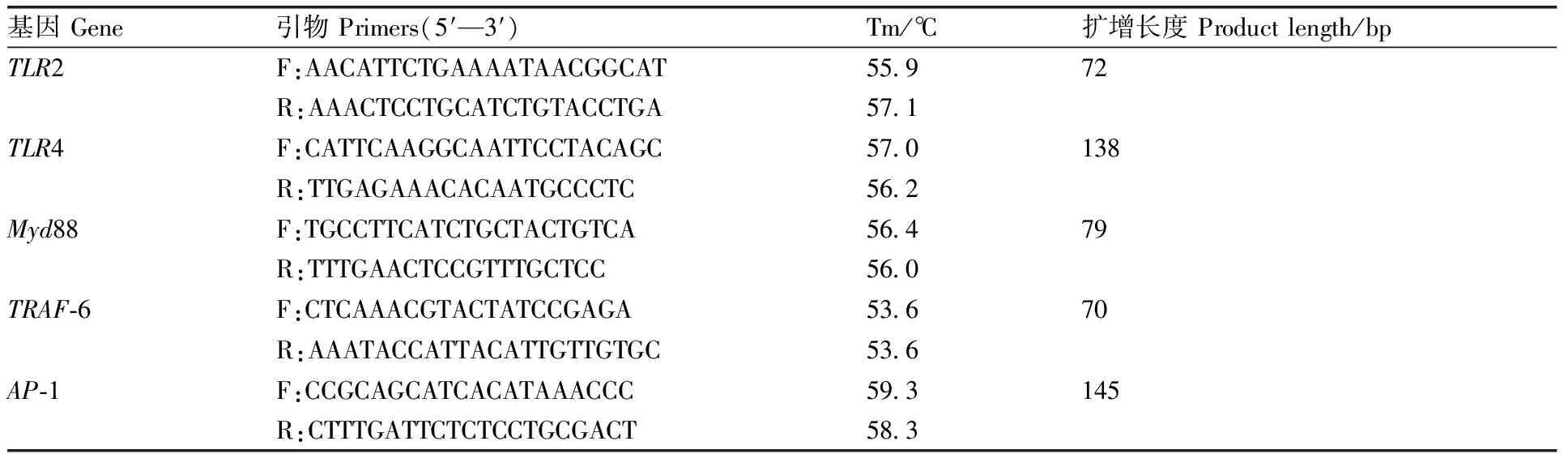
表2 基因引物参数Table 2 Primer sequences of genes
1.5.3 Western blot法检测空肠TLR2、TLR4、Myd88、TRAF-6、AP-1蛋白表达量
将空肠组织样品在冰上研磨,加入混有蛋白酶抑制剂和蛋白磷酸酶抑制剂的RIPA裂解液,漩涡振荡器混合均匀,置于冰上20 min,使细胞充分裂解,14 000×g离心10 min,收集上清液。蛋白浓度测定按照BCA蛋白浓度测定试剂盒说明书进行操作,并根据标准曲线计算蛋白浓度。将提取的蛋白质样品煮沸5 min,在SDS-PAGE凝胶中电泳,然后转移至PVDF膜。用牛血清白蛋白(BSA)在室温下封闭膜4 h后,放入一抗在4 ℃孵育过夜,将膜洗涤3次,并用二抗在室温下水平振荡孵育45 min,洗膜后放入凝胶成像系统(BIO-RAD)中成像。
1.6 数据处理
采用Excel 2010对数据进行初步处理,SPSS 23.0软件进行多重比较分析,结果用平均值±标准差表示,以P<0.05作为差异显著性。Western blot结果采用AlphaEase FC软件进行分析。
2 结果与分析
2.1 益生菌对血清中免疫球蛋白含量的影响
由表3可知,与A组相比,B组和C组血清中IgG、IgM水平在34、41、48 d均显著增加(P<0.05);C组血清IgG、IgA和IgM水平与B组差异不显著(P>0.05)。
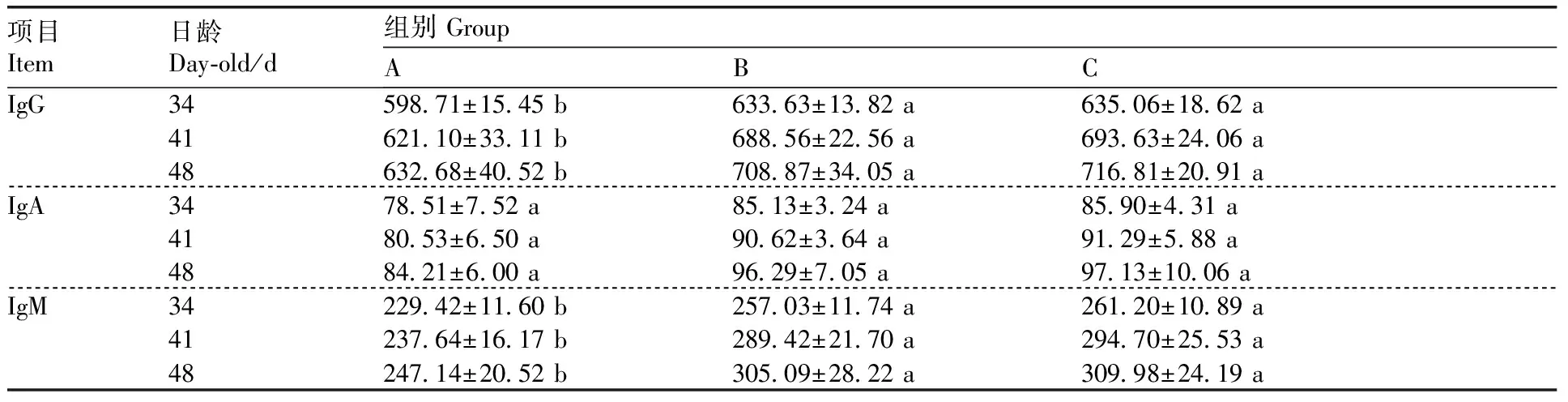
表3 益生菌对鸡血清免疫球蛋白水平的影响Table 3 Effect of probiotics on serum immunoglobulin levels of chicks μg·mL-1
2.2 益生菌对空肠TLR2、TLR4、Myd88、TRAF-6、AP-1m RNA相对表达量的影响
由图1可知,与A组相比,B组空肠TLR2、TLR4、TRAF-6、Myd88、AP-1 mRNA相对表达量显著(P<0.05)提高;C组空肠TLR2、TLR4、TRAF-6、Myd88、AP-1 mRNA相对表达量显著(P<0.05)提高。C组空肠MyD88蛋白mRNA相对表达量比B组显著(P<0.05)提高。
2.3 益生菌对TLR2、TLR4、Myd88、TRAF-6、AP-1蛋白表达量的影响
由图2可知,与A组相比,B组和C组空肠TLR2、TLR4、TRAF-6、Myd88蛋白表达量显著(P<
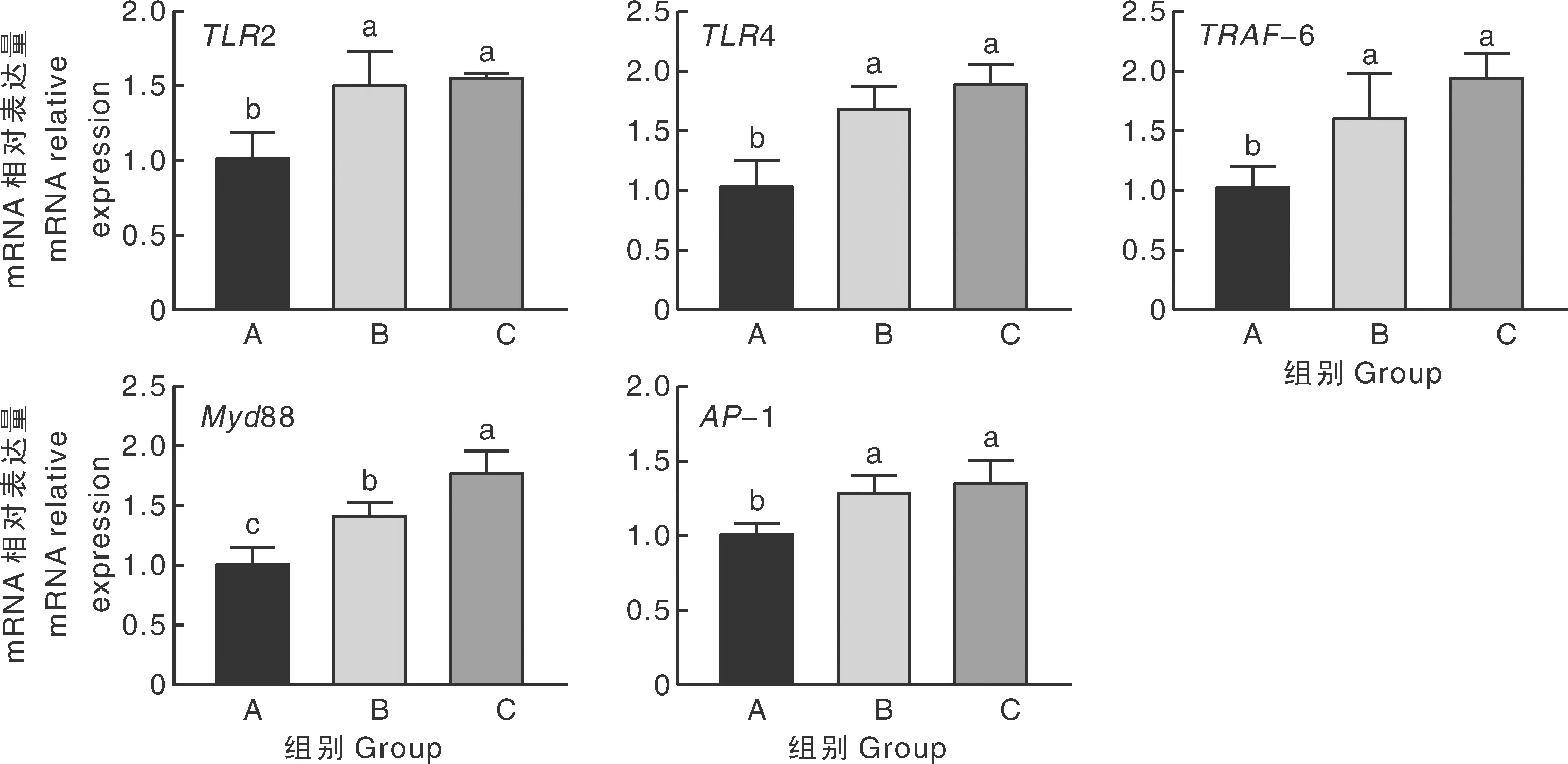
柱状图上无相同小写字母表示差异显著(P<0.05)。下同。Difference lowercase letters above the columns represent significant difference at P<0.05. The same as below.图1 益生菌对空肠TLR2、TLR4、AP-1、TRAF-6、Myd88 mRNA相对表达量影响Fig.1 Effect of probiotics on the relative expression of TLR2、TLR4、AP-1、TRAF-6、Myd88 mRNA in jejunum
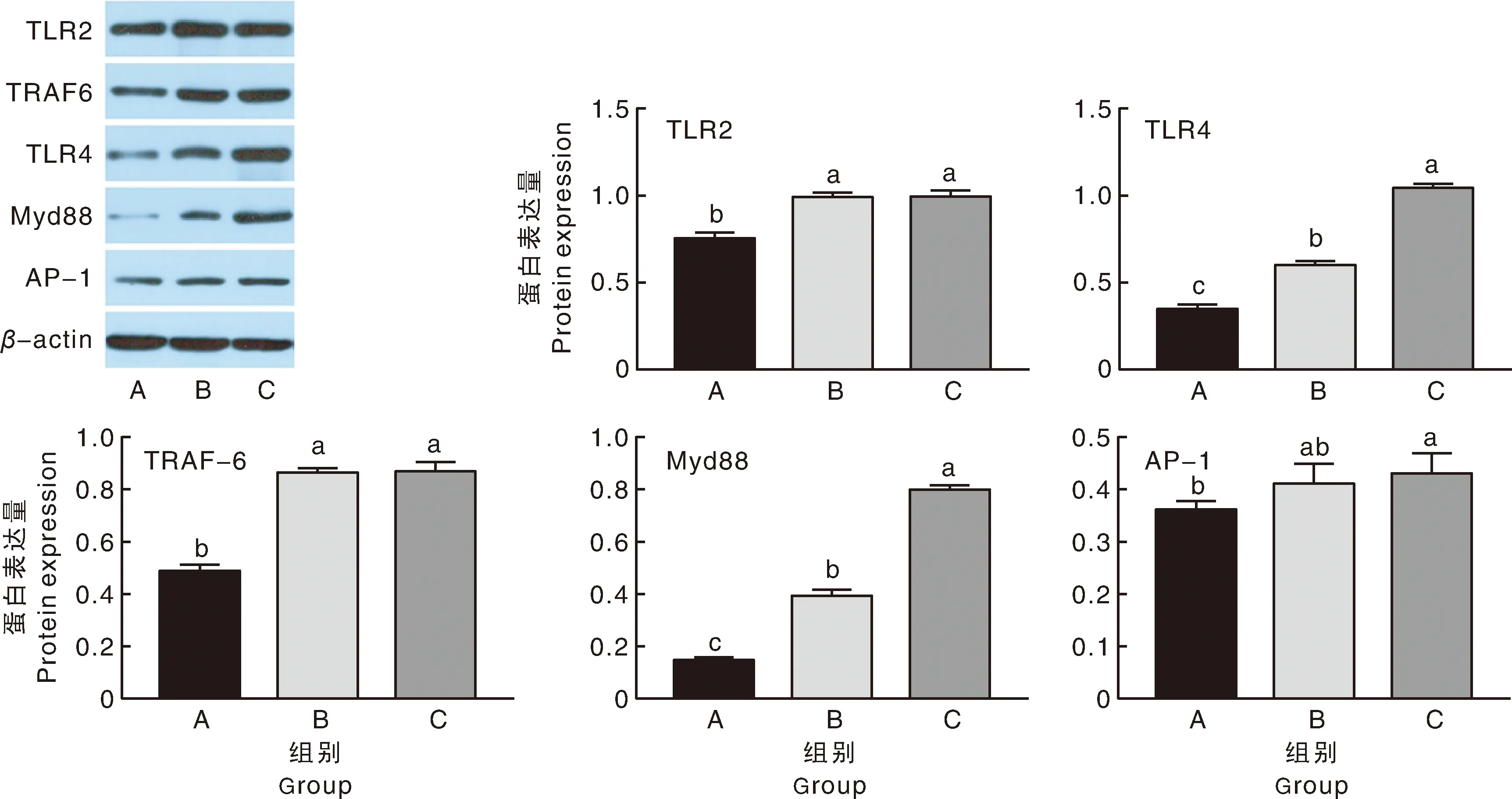
图2 益生菌对TLR2、TLR4、TRAF-6、Myd88、AP-1蛋白表达量的影响Fig.2 Effect of probiotics on the protein expression of TLR2、TLR4、TRAF-6、Myd88、AP-1
0.05)提高;C组空肠的AP-1蛋白表达量显著(P<0.05)高于A组。C组的TLR4、Myd88蛋白表达量比B组的显著(P<0.05)提高。
3 结论与讨论
本试验结果表明,饲料中添加不同浓度的鸡源复合益生菌能提高白羽肉杂鸡血清中IgG和IgM含量,提高鸡肠道中的TLR2、TLR4、TRAF-6、Myd88、AP-1蛋白的表达量和TLR2、TLR4、TRAF-6、Myd88、AP-1 mRNA的相对表达量,通过Toll样受体通路增强机体免疫功能。
IgG、IgM、IgA是体液免疫的主导效应分子,在体液免疫中起重要的作用,免疫球蛋白的含量也是衡量动物机体免疫机能的重要指标。IgG由脾脏和淋巴组织中的浆细胞产生,是体液免疫应答产生的主要抗体,在增强机体免疫力方面具有重要作用;IgM具有抗菌及中和毒素的作用;IgA以2种形式存在,具有多种抗体活性[11]。吕春炎[12]在肉鸡饲粮中添加黄芪、女贞子和益生菌合用,肉鸡的IgG、IgA、IgM均显著提高;王元心[13]在雏鸡饲粮中添加益生菌,其局部体液中免疫球蛋白含量不同程度高于对照雏鸡;王佳丽等[14]等在肉鸡饲粮中添加复合益生菌,显著提高了免疫球蛋白的含量,改善了肉鸡体液免疫功能。本试验分别在基础日粮中添加鸡源复合益生菌,在34、41、48 d检测血清IgG、IgM、IgA水平。从本试验结果可得,添加鸡源复合益生菌后,明显增加血清中IgG和IgM含量,表明该复合益生菌可以促进肉鸡免疫球蛋白的分泌,增强体液免疫。
Toll样受体是膜结合受体,可以识别细胞外微生物,并将信号传递到细胞内引起免疫反应,在天然免疫反应中不仅可以清除病原体,而且可通过识别病原体相关分子过程中有效建立获得性免疫体系。Myd88是Toll样受体通路中的重要转导蛋白,传递了多种不同受体的活化信号,其通过调节下游蛋白TRAF-6等信号分子,促使AP-1和其他激酶的活化,继而导致相关基因的转录,以此来参与机体的免疫反应[15-20]。覃初斌等[21]在肉鸡饲粮中添加布拉氏酵母和枯草芽孢杆菌B10,肉鸡空肠黏膜Toll样受体TLR2、TLR4和相关信号蛋白Myd88、TRAF-6等基因表达水平显著上调。彭承英[22]在肉鸡饲粮中添加益生菌,35日龄肉鸡空肠的TLR2基因表达水平显著提高。从本试验结果可得,添加鸡源复合益生菌后,肠道中的TLR2、TLR4、TRAF-6、Myd88、AP-1蛋白的表达量和TLR2、TLR4、TRAF-6、Myd88、AP-1蛋白mRNA的相对表达量都显著提高,且添加鸡源复合益生菌后,血清中的IgG、IgM含量也随之升高。表明此复合益生菌改善了Toll样受体通路中相关蛋白的表达,提高了血清中免疫球蛋白的水平,通过Toll样受体通路有效调节肉鸡肠道的免疫功能,促进肉鸡的健康生长。

