滋补脾阴方药对糖尿病脑病大鼠脑组织PDHE1α蛋白表达的影响
孙晓霞,战丽彬,赵淑元
滋补脾阴方药对糖尿病脑病大鼠脑组织PDHE1α蛋白表达的影响
孙晓霞1,战丽彬1,赵淑元2,3
1.南京中医药大学中医学院·中西医结合学院中医脾藏象现代研究实验室,江苏 南京 210023;2.大连医科大学,辽宁 大连 116044;3.山西医科大学第一医院,山西 太原 030001
观察滋补脾阴方药对糖尿病脑病大鼠脑组织PDHE1α蛋白表达的影响,探讨其改善糖尿病脑病大鼠认知功能的作用机制。SPF级雄性SD大鼠随机分为空白对照组、糖尿病脑病组和滋补脾阴方药组,每组5只。采用高脂饮食加小剂量链脲佐菌素(STZ)注射法建立2型糖尿病大鼠模型。于STZ注射后第7、12、16日分别进行空腹血清胰岛素(FSI)检测、口服葡萄糖耐量试验(OGTT)及胰岛素耐量试验(ITT)。滋补脾阴方药组给予滋补脾阴方药灌胃,其余组给予等体积生理盐水灌胃,共16 d。采用Morris水迷宫实验检测大鼠空间学习记忆能力;Western blot检测大鼠海马和皮质PDHE1α蛋白表达。糖尿病脑病组大鼠随机血糖、FSI水平较空白对照组明显升高(<0.01)。OGTT结果显示,糖尿病脑病组大鼠从30 min开始,各时间点血糖均高于空白对照组大鼠(<0.01),且120 min血糖仍高于0 min血糖。ITT结果显示,糖尿病脑病组大鼠血糖下降速率低于空白对照组。水迷宫实验结果显示,第3日起,糖尿病脑病组大鼠逃避潜伏期较空白对照组明显延长(<0.05),出现空间记忆能力损伤;滋补脾阴方药组大鼠第3、5日逃避潜伏期较糖尿病脑病组明显缩短(<0.05,<0.01)。Western blot结果显示,糖尿病脑病组大鼠海马和皮质PDHE1α蛋白表达明显低于空白对照组(<0.01,<0.05),滋补脾阴方药组大鼠PDHE1α蛋白表达较糖尿病脑病组明显升高(<0.05)。糖尿病脑病认知功能损伤可能与PDHE1α蛋白表达降低有关,滋补脾阴方药可能通过提高脑组织PDHE1α蛋白表达改善糖尿病脑病大鼠的学习记忆能力。
滋补脾阴方药;糖尿病脑病;PDHE1α;蛋白表达;大鼠
糖尿病病程延长所引起的诸多并发症是糖尿病致死、致残的主要原因[1]。其中,糖尿病脑病是糖尿病主要的慢性并发症之一,以获得性认知和行为缺陷为特征,伴有大脑形态改变和神经生理功能的异常[2-3]。糖尿病脑病临床主要表现为学习记忆能力下降,理解力及判断力障碍,伴有表情淡漠、反应迟钝、思维呆滞等,严重者可出现痴呆等精神疾患,丧失生活自理能力[4]。已有研究表明,糖尿病患者相比未患糖尿病者罹患痴呆风险高约2倍[5]。因此,揭示糖尿病脑病发病机制并寻找到有效防治策略意义重大。课题组前期研究运用蛋白质组学方法对糖尿病脑病大鼠海马中蛋白质进行分离、鉴定及信息库查询,发现参与能量代谢的多个蛋白差异点位于线粒体,并成功鉴定出差异表达蛋白点——PDHE1α,提示线粒体能量代谢障碍可能在糖尿病脑病发病机制中发挥重要作用,该变化可能与PDHE1α有关[6]。滋补脾阴方药是战丽彬教授根据《不居集》资成汤化裁而成。前期研究发现,滋补脾阴方药在改善糖尿病大鼠学习记忆能力方面作用显著[6-8],为进一步探讨其对糖尿病脑病大鼠认知功能的影响,我们建立糖尿病脑病大鼠模型并予滋补脾阴方药干预,观察大鼠学习记忆能力及其对模型大鼠脑组织PDHE1α蛋白表达的影响,旨在从蛋白水平探讨滋补脾阴方药新靶点,为糖尿病脑病临床治疗提供新思路。
1 材料与方法
1.1 动物及分组
SPF级雄性SD大鼠15只,体质量(200±20)g,大连医科大学实验动物中心提供,动物许可证号SCXK(辽)2008-0002。大鼠饲养于SPF级动物房,温度(22±3)℃、湿度50%,明暗交替12 h。适应性喂养3 d,将大鼠随机分为空白对照组、糖尿病脑病组和滋补脾阴方药组,每组5只。
1.2 药物和饲料
滋补脾阴方药(红参30 g,山药15 g,茯苓15 g,白芍15 g,丹参12 g,白扁豆15 g,莲肉20 g,石菖蒲10 g,远志10 g,檀香4.5 g,橘红9 g,炙甘草9 g),饮片购自大连美罗医药公司,常规水煎,浓缩为含原药材3.29 g/mL,过滤,4 ℃冰箱保存。普通饲料按中华人民共和国《实验动物大鼠小鼠配合饲料》(GB14924.3-2001)标准生产。高脂饲料配方在Reed配方[9]基础上稍作修改。每公斤高脂饲料含酪蛋白236 g、蔗糖100 g、氢化植物油100 g、麦芽糊精120 g、玉米淀粉242.62 g、DL-甲硫氨酸3.54 g、猪油100 g、碳酸氢钙4.72 g、纤维素40 g、维生素混合物11.8 g、矿物质混合物41.3 g、乙氧喹0.02 g。普通饲料和高脂饲料均由南京安立默科技有限公司提供。
1.3 主要试剂与仪器
十二烷基硫酸钠(批号L4509)、溴酚蓝(批号B8026)、四甲基乙二胺(批号T9281)、过硫酸铵(批号A3678)、巯基乙醇(批号D9163),美国Sigma公司;增强化学发光(ECL)试剂盒(批号12015196001),Roche公司;Anti-PDHE1α,美国Invitrogen公司;胰岛素放免试剂盒,北京原子高科股份有限公司。台式高速冷冻离心机(美国Thermo),超微量核酸蛋白测定仪(美国GE Healthcare),垂直电泳仪(美国GE Healthcare),半干式转膜仪(中国Jim-X),凝胶成像系统(美国UVP),DMS-2 Morris水迷宫记录与测试系统(中国医学科学院药物研究所)。
1.4 糖尿病模型制备
采用高脂饮食结合小剂量链脲佐菌素(STZ)腹腔注射建立2型糖尿病模型[10]。适应性喂养3 d,空白对照组大鼠喂食普通饲料,模型组喂食高脂饲料至开始药物干预。4周后,模型按30 mg/kg比例腹腔注射1%STZ溶液,空白对照组予等量柠檬酸缓冲液腹腔注射。
1.5 糖尿病模型特征评估
1.5.1 随机血糖
STZ注射72 h后尾静脉采血测定大鼠随机血糖,以随机血糖>16.7 mmoL/L作为判定糖尿病模型造模成功的依据。随后2周监测1次随机血糖,随时剔除随机血糖低于16.7 mmoL/L的大鼠。
1.5.2 空腹血清胰岛素
STZ注射后第7日,大鼠禁食12 d,乙醚麻醉,眶后静脉丛采血,提取血清,4 ℃静置2 h,3000 r/min离心10 min,-20 ℃保存。采用放射免疫分析技术测量空腹血清胰岛素(FSI),以判定糖尿病模型大鼠是否存在高胰岛素血症。
1.5.3 口服葡萄糖耐量试验
STZ注射后第12日,大鼠禁食14 h,50%葡萄糖溶液按2 g/kg体质量灌胃,分别于服糖前(0 min)及服糖后30、60、90、120 min尾静脉采血测量血糖水平,以确定糖尿病模型大鼠是否存在糖耐量异常。
1.5.4 胰岛素耐量试验
STZ注射后第16日,大鼠禁食6 d,腹腔注射普通短效胰岛素(0.75 U/kg体质量),尾静脉采血测定注射前(0 min)及注射后30、60、90 min血糖水平,以判断糖尿病模型大鼠是否存在胰岛素抵抗。
1.6 一般观察
每日观察大鼠的形态、毛色、粪便、活动状态等,每日测量大鼠体质量、肛温、摄食量和饮水量。
1.7 药物干预
STZ注射7周后,滋补脾阴方药组按10 mL/kg标准给予滋补脾阴方药药液灌胃,每日1次,共16 d。余组灌服等剂量生理盐水。见图1。
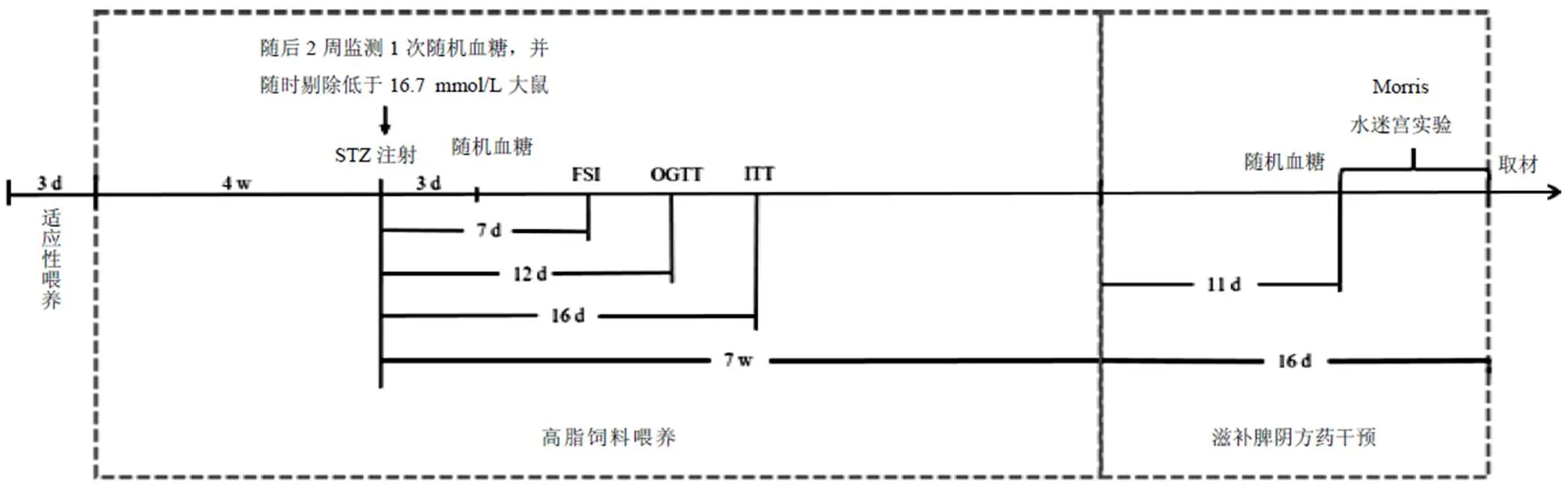
图1 糖尿病大鼠模型建立与滋补脾阴方药干预示意图
1.8 Morris水迷宫实验
动物认知损伤随糖尿病病程延长而自然出现,目前尚未见诱导糖尿病认知损伤的研究。故本研究在成功建立糖尿病模型基础上,进行药物干预11 d,采用Morris水迷宫实验检测大鼠空间学习记忆能力,以此判定糖尿病脑病模型是否建立成功。实验装置分为圆形水池和自动录像分析系统两部分。Morris水迷宫实验共计5 d。第1日为适应性训练,将池中平台撤去,使大鼠在池中自由游泳120 s,之后4 d每日训练1次。训练时随机选择一个象限中心作为入水点,将大鼠面壁轻轻放入水池,迫使大鼠学习寻找设于水面以下平台。如大鼠在水中游泳一段时间后爬上平台,并在平台上停留时间超过3 s,则认为大鼠找到平台,记录大鼠找到平台时间。若大鼠入水120 s内未能找到平台,则将其引至平台,使之在平台停留60 s,潜伏期记为120 s。
1.9 取材
大鼠腹腔注射4%水合氯醛麻醉,冰台断头,暴露脑组织,冰上快速取出海马与皮质,置于1.5 mL冻存管中,液氮速冻后转移至-80 ℃冰箱保存。
1.10 Western blot检测海马和皮质PDHE1α蛋白的表达
提取大鼠海马和皮质组织蛋白后,根据蛋白浓度计算上样量。配制10%SDS-聚丙烯酰胺凝胶,加样后进行电泳、转膜。5%脱脂牛奶封闭。按1∶800比例稀释一抗进行孵育,4 ℃过夜。次日以1×TBST洗膜10 min×3次,加入二抗(1∶2500),TBST洗膜10 min×3次,ECL显影分析。
1.11 统计学方法
2 结果
2.1 随机血糖、空腹血清胰岛素、口服葡萄糖耐量试验和胰岛素耐量试验结果
腹腔注射STZ 72 h,糖尿病模型大鼠出现多饮、多尿、多食等糖尿病表现。模型组大鼠随机血糖、FSI水平明显高于空白对照组,差异有统计学意义(<0.01),见表1。口服葡萄糖耐量试验(OGTT)结果显示,糖尿病模型大鼠30 min开始,各时间点血糖均明显高于空白对照组,差异有统计学意义(<0.01),且120 min血糖仍高于0 min,见表2。胰岛素耐量试验(ITT)结果表明,糖尿病模型大鼠血糖下降速率低于空白对照组(<0.01),见表3。

表1 2组随机血糖和FSI水平比较(±s)
注:与空白对照组比较,**<0.01

表2 OGTT 2组各时间点血糖比较(±s,mmoL/L)
注:与空白对照组比较,**<0.01

表3 ITT 2组各时间点血糖比较(±s,mmoL/L)
注:与空白对照组比较,**<0.01
2.2 滋补脾阴方药对模型大鼠食水量、体质量、肛温和随机血糖的影响
与空白对照组比较,糖尿病脑病组大鼠食水量增加,形体消瘦,表现为糖尿病临床特征;与糖尿病脑病组比较,滋补脾阴方药组大鼠被毛较前光泽,活动量增加,易激惹程度下降,大鼠摄食量、饮水量和随机血糖有所降低,摄食量差异有统计学意义(<0.05)。结果见表4。
2.3 滋补脾阴方药对模型大鼠学习记忆能力的影响
Morris水迷宫实验结果显示,自第3日起,糖尿病脑病组大鼠逃避潜伏期较空白对照组显著延长,差异有统计学意义(<0.05),提示大鼠出现空间记忆能力损伤,糖尿病脑病大鼠模型造模成功;实验第3、5日,滋补脾阴方药组大鼠逃避潜伏期较糖尿病脑病组明显降低,差异有统计学意义(<0.05,<0.01)。结果见表5。

表4 各组大鼠食水量、体质量、肛温和随机血糖比较(±s)
注:与空白对照组比较,*<0.05,**<0.01;与糖尿病脑病组比较,▲<0.05

表5 Morris水迷宫实验各组大鼠逃避潜伏期比较(±s,s)
注:与空白对照组比较,*<0.05;与糖尿病脑病组比较,▲<0.05,▲▲<0.01
2.4 滋补脾阴方药对模型大鼠海马和皮质PDHE1α蛋白表达的影响
滋补脾阴方药组大鼠海马和皮质PDHE1α蛋白表达较空白对照组明显降低(<0.01,<0.05),滋补脾阴方药组大鼠PDHE1α蛋白表达较糖尿病脑病组明显升高(<0.05)。结果见图2。
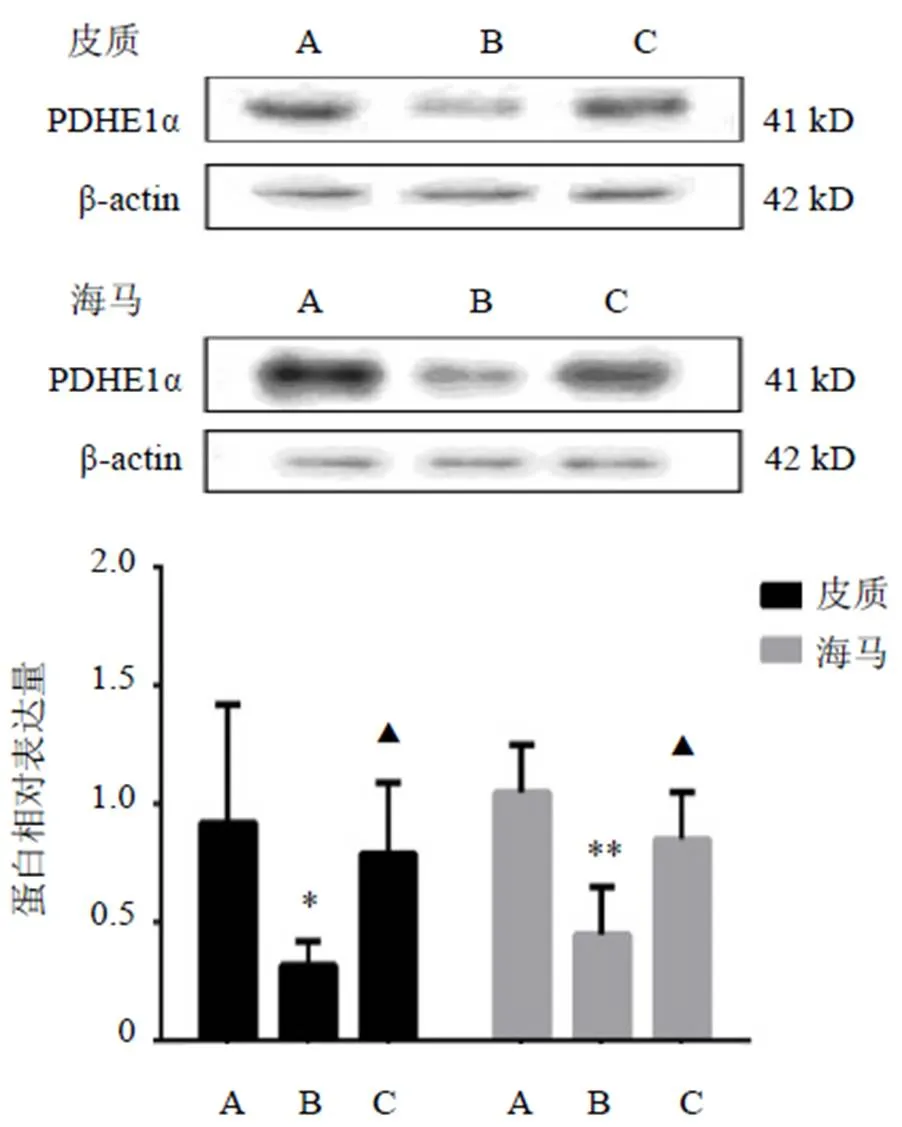
注:A.空白对照组;B.糖尿病脑病组;C.滋补脾阴方药组;与空白对照组比较,*P<0.05,**P<0.01;与糖尿病脑病组比较,▲P<0.05
3 讨论
采用高脂饲料结合小剂量STZ诱导制备2型糖尿病动物模型是目前常用方法[11-12]。STZ通过自由基损伤胰岛β细胞,影响β细胞正常生理功能,导致胰岛素合成减少,进而诱发糖尿病,是目前应用最广泛的糖尿病动物模型化学诱导剂[13]。胰岛功能受损和胰岛素抵抗是2型糖尿病发病机理中的2个关键因素。本实验中糖尿病模型组大鼠喂食高脂饲料4周后,体质量较普通饲料喂养大鼠增加,表明高脂饲料导致大鼠肥胖。注射STZ 72 h后,糖尿病模型大鼠随机血糖均大于16.7 mmol/L,已达到糖尿病诊断标准。为进一步证实2型糖尿病模型造模是否成功,本研究在STZ注射后第7、12、16日分别进行FSI测定、OGTT和ITT。糖尿病模型大鼠较空白对照组FSI水平升高,提示模型组大鼠存在高胰岛素血症。OGTT是诊断糖尿病的金标准,是评价糖代谢紊乱的一项敏感指标[14]。通过OGTT能检测糖尿病动物模型是否存在糖耐量异常,评价模型可靠性[15]。本实验OGTT结果显示,模型组大鼠调节葡萄糖机能受损,存在糖耐量异常,与2型糖尿病特征相符。胰岛素抵抗是2型糖尿病的根本原因,也是导致各种糖尿病并发症的“动力源泉”[16]。ITT是评价胰岛素抵抗的重要指标之一。正常情况下,血糖浓度下降越快说明受试者的胰岛素敏感性越好,反之则说明存在胰岛素抵抗。ITT结果显示,模型组大鼠血糖降低速率较空白对照组下降,提示胰岛素敏感性降低,胰岛素抵抗形成,符合2型糖尿病特征。以上结果均说明本实验成功建立2型糖尿病动物模型。在此基础上,我们采用Morris水迷宫实验判断糖尿病大鼠是否存在学习记忆功能障碍。结果发现,水迷宫实验第3、4、5日各组逃避潜伏期差异均有统计学意义。糖尿病脑病组大鼠找到平台所需时间长于空白对照组,说明糖尿病模型大鼠存在学习记忆障碍。据此,我们判定糖尿病脑病模型建立成功。
中医学中虽未见有关糖尿病脑病明确定义,但关于其临床表现及发病机制的论述散见于历代医学古籍中,属消渴合并“健忘”“呆证”等范畴。《圣济总录》言:“消渴日久,健忘怔忡”。《兰室秘藏》也记载了消渴患者出现的脑病症状“上下齿皆麻,舌根强硬,肿痛,四肢痿弱……喜怒健忘”。消渴以阴虚为本,燥热为标。脾之气阴亏虚是导致糖尿病的主要病机。脾阴是脾脏功能活动的内在基础,是指水谷所化营血、津液、脂膏之类,具有灌溉脏腑、补益脑髓等作用。若脾阴不足,则脾失健运,水谷精微不能上荣于脑,脑髓失养,神机失聪,出现健忘或痴呆。故脾阴虚与糖尿病脑病的发生密切相关。目前中医药在防治糖尿病及其并发症领域应用广泛,疗效显著[17-19]。滋补脾阴方药是治疗脾阴虚证代表方剂,由红参、山药、白扁豆、莲肉、茯苓、石菖蒲、远志等组成,诸药共奏培补后天、滋补脾阴、安神益智之效。本课题组前期在探索糖尿病认知功能障碍发病机制及防治策略的相关研究中发现,滋补脾阴方药可能通过降低大鼠海马、皮质中β-淀粉样蛋白1-42水平,调节线粒体数量、形态,提高线粒体膜电位、降低活性氧调节脑组织线粒体功能,或调节肠道菌群稳态等作用机制以改善模型大鼠的认知功能障碍[20-23]。本实验中高脂饲料喂养结合小剂量STZ注射构建2型糖尿病模型大鼠,成模8周后出现认知功能损伤,经滋补脾阴方药干预后,水迷宫实验结果显示,糖尿病脑病组大鼠寻找平台时间缩短,接近正常大鼠水平,进一步说明滋补脾阴方药可改善糖尿病脑病模型大鼠学习记忆能力,提高认知功能。
丙酮酸脱氢酶复合体(PDHc)在细胞线粒体呼吸链能量代谢中发挥着重要作用。丙酮酸脱氢酶(PDH)是PDHc的核心结构之一,是糖酵解产物丙酮酸代谢为乙酰辅酶A过程中的一种关键限速酶,调控着PDHc催化反应速率。乙酰辅酶A是物质能量代谢中的枢纽性物质,其通过三羧酸循环和氧化磷酸化,推动ATP合成,为细胞和组织提供生命活动所需能量。同时,乙酰辅酶A也是神经递质乙酰胆碱的重要来源。研究表明,乙酰胆碱与老年痴呆症状改善显著相关[24]。大脑能量代谢紊乱是导致大脑功能障碍的重要因素。在糖尿病状态下,胰岛素抵抗或分泌不足,可使机体PDHc水平下调。而PDHE1α水平降低是导致丙酮酸脱氢酶系缺陷最常见原因。PDHE1α缺乏将导致丙酮酸被还原为乳酸,体内乳酸堆积,同时乙酰辅酶A含量降低,造成机体能量生成减少,脑组织能量代谢水平下降,进而影响人体学习记忆能力。本实验中糖尿病脑病组大鼠海马和皮质PDHE1α蛋白表达较空白对照组明显降低,说明糖尿病脑病认知功能损伤可能与PDHE1α表达降低有关。经滋补脾阴方药干预后,滋补脾阴方药组较糖尿病脑病组大鼠脑组织PDHE1α蛋白表达明显升高,提示滋补脾阴方药可能通过提高脑组织PDHE1α蛋白表达改善糖尿病脑病大鼠的学习记忆能力。
[1] BANSAL V, GASSENHUBER J, PHILLIPS T, et al. Spectrum of mutations in monogenic diabetes genes identified from high-throughput DNA sequencing of 6888 individuals[J]. BMC Medicine,2017,15(1):213.
[2] SHI S, YIN H J, LI J, et al. Studies of pathology and pharmacology of diabetic encephalopathy with KK-Ay mouse model[J]. CNS Neurosci Ther,2019,26(3):1-11.
[3] RIEDERER P, KORCZYN A D, ALI S S, et al. The diabetic brain and cognition[J]. Journal of Neural Transmission,2017,124(11):1431-1454.
[4] WANG Z G, HUANG Y, CHENG Y, et al. Endoplasmic reticulum stress- induced neuronal inflammatory response and apoptosis likely plays a key role in the development of diabetic encephalopathy[J]. Oncotarget,2016,7(48):78455-78472.
[5] EXALTO L G, WHITMER R A, KAPPELE L J, et al. An update on type 2 diabetes, vascular dementia and Alzheimer's disease[J]. Exp Gerontol,2012,47(11):858-864.
[6] SHI X , LU X G, ZHAN L B, et al. The effects of the Chinese medicinerecipe on the hippocampus in a rat model of diabetes-associated cognitive decline:a proteomic analysis[J]. Diabetologia,2011,54(7):1888-1899.
[7] 胡守玉,梁丽娜,战丽彬,等.滋补脾阴方药对脾阴虚糖尿病大鼠大脑皮质内质网应激的影响[J].中国中医药信息杂志,2014,21(1):46-49,53.
[8] 梁丽娜,马葳,战丽彬,等.滋补脾阴方药对脾阴虚糖尿病大鼠脑组织和外周组织丙酮酸脱氢酶1α蛋白表达的影响[J].中国中医药信息杂志,2014,21(11):52-55.
[9] REED M J, MESZAROS K, ENTES L J, et al. A new rat model of type 2 diabetes:the fat-fed, streptozotocin-treated rat[J]. Metabolism,2000,49(11):1390-1394.
[10] 孙铮,战丽彬,姜如娇,等.滋补脾阴法对糖尿病脑病大鼠皮质线粒体膜电位和活性氧的影响[J].中国老年学杂志,2016,36(8):1804-1806.
[11] 蒲梦如,申甚莉,张永兰,等.京尼平苷对链脲佐菌素诱导的糖尿病大鼠糖脂代谢的影响[J].中国药学杂志,2019,54(9):699-702.
[12] 朱华,郭亚茜,杜晓鹏,等.链脲佐菌素诱导糖尿病大鼠模型肠道菌群变化[J].中国实验动物学报,2018,26(3):349-356.
[13] GUNDALA NAVEEN K V, DAS UNDURTI N. Arachidonic acid-rich ARASCO oil has anti-inflammatory and antidiabetic actions against streptozotocin+high fat diet induced diabetes mellitus in Wistar rats[J]. Nutrition,2019,66:203-218.
[14] 肖继,闫卫利.代谢组学分析方法在2型糖尿病中的应用研究[J].医学综述,2014,20(14):2599-2601.
[15] THEODORAKIS M J, KATSIKI N, ARAMPATZI K, et al. Modeling the oral glucose tolerance test in normal and impaired glucose tolerant states:a population approach[J]. Current Medical Research and Opinion,2017,33(2):9.
[16] 施丽俊,裴建.针灸治疗2型糖尿病研究进展[J].中国老年学杂志,2018,38(7):1784-1785.
[17] 周凯伦,王旭.基于体质辨识探讨2型糖尿病合并高尿酸血症精准治疗[J].中国中医药信息杂志,2019,26(8):8-11.
[18] 金惠英,金京国.健脾滋阴消渴方治疗2型糖尿病气阴两虚证临床疗效及对胰岛素敏感性和胰岛β细胞功能的影响[J].中国中医药信息杂志,2019,26(7):35-39.
[19] 艾力亚斯•阿不拉,赖敬波.三黄汤联合利拉鲁肽注射液治疗老年2型糖尿病合并肥胖临床研究[J].中国中医药信息杂志,2019,26(3):29-33.
[20] 李萌.糖尿病认知功能障碍与Aβ、脑白质病变的关系及滋补脾阴方药的作用[D].大连:大连医科大学,2012.
[21] SUN Z, ZHAN L, LIANG L, et al. ZiBu PiYin recipe prevents diabetes-associated cognitive decline in rats:possible involvement of ameliorating mitochondrial dysfunction, insulin resistance pathway and histopathological changes[J]. BMC Complementary and Alternative Medicine,2016,16(1):200.
[22] 孙铮,战丽彬,孙晓昕,等.滋补脾阴方药对糖尿病认知功能障碍大鼠皮质线粒体功能障碍预防作用机制[J].世界科学技术-中医药现代化, 2015,17(8):1639-1645.
[23] 周雯.基于泛素化蛋白质组学及肠道菌群的滋补脾阴方药对情志应激所致糖尿病认知功能障碍的研究[D].南京:南京中医药大学,2019.
[24] HAAM J, YAKEL J L. Cholinergic modulation of the hippocampal region and memory function[J]. Journal of Neurochemistry,2017, 142:111-121.
Effect ofRecipe on Protein Expression of PDHE1α in Brain Tissue of Diabetic Encephalopathy Rats
SUN Xiaoxia1, ZHAN Libin1, ZHAO Shuyuan2,3
To investigate the effect ofRecipe (ZBPYR) on cognitive function in diabetic encephalopathy (DE) rats, and to reveal the role of PDHE1α in the treatment of cognitive function in DE rats.SPF male Sprague-Dawley rats were randomly divided into control group, DE group and ZBPYR group, with 5 rats in each group. A rat model of type 2 diabetes was established by high-fat diet plus low-dose streptozotocin (STZ) injection. Fasting serum insulin (FSI) levels, oral glucose tolerance test (OGTT), and insulin tolerance test (ITT) were performed on days 7, 12, and 16 after STZ injection. The ZBPYR group was treated with ZBPYR. The remaining groups were given equal volume of normal saline for 16 days. Morris water maze was used to detect changes in cognitive ability. The expression of PDHE1α protein in hippocampus and cortex of rats was detected by Western blot.The random blood glucose and FSI of DE group were higher than those of the control group (<0.01). OGTT showed that the blood glucose of DE group was higher than that of the control group at 30 min (<0.01), and the blood glucose was still higher than 0 min at 120 min. The results of ITT experiments showed that the blood glucose decline rate in the DE group was lower than that in the control group. From the third day of water maze experiment, the latency in DE group was longer than that in control group (<0.05), and the damage of spatial memory appeared. The latency in ZBPYR group was shorter than that in DE group on the 3rd and 5th day (<0.05,<0.01). The results of Western blot showed that the levels of PDHE1α in hippocampus and cortex of DE group were lower than those in control group (<0.01,<0.05), and the expression of PDHE1α in ZBPYR group was increased compared with DE group (<0.05).The cognitive impairment of DE may be related to the decreased expression of PDHE1α protein. ZBPYR may improve the learning and memory ability of DE rats by increasing the expression of PDHE1α protein in brain tissue.
Recipe; diabetic encephalopathy; PDHE1α protein; expression; rats

R285.5
A
1005-5304(2020)09-0063-06
10.3969/j.issn.1005-5304.202001179
国家自然科学基金(81730111、30772847);江苏高校优势学科建设工程资助项目(中西医结合)(2018年)
战丽彬,E-mail:zlbnj@njucm.edu.cn
(2020-01-11)
(2020-02-23;编辑:华强)

