Eu2+掺杂UCr4C4-型窄带发射荧光材料的研究进展及应用
王金迪,黄 帅,尚蒙蒙*
(1.山东大学 材料工程与科学学院,山东 济南 250061; 2.青岛大学 化学化工学院,山东 青岛 266071)
1 引 言
基于荧光材料转换型白光发光二极管(pc-wLEDs)的固态照明(SSL)正迅速改变着照明和显示行业。除了众所周知的pc-wLEDs在家庭和办公室照明中的应用外,这些高效的白色光源也越来越多地被用作液晶显示器(LCD)中的替代背光单元[1-3]。目前LED研究的主要目标是保持色度稳定、降低能耗和提高光质量,其中,由白光LED发出的红光、绿光和蓝光(RGB)的颜色坐标所确定的发光色域的改善已成为一个热点问题,因为它能使颜色更生动,更多地吸引消费者的注意[4-7]。背景光源所用的荧光材料要求具有窄的发射带、特定的峰值位置、高的量子效率和良好的热稳定性[8-9]。使用高效的红、绿、蓝窄带发射荧光材料可以为高性能的pc-wLEDs奠定良好的基础[2]。为了开发可显示更加明亮和生动图像的背光技术,具有窄带发射的新型绿色、红色发光材料已成为研究热点之一[5,7,10-11]。
目前,由于对发光材料的应用要求极高(一般要求在高达200 ℃的温度下具有很高的转换效率和抗降解性),所以适合于高亮度pc-wLEDs应用(蓝光输出>100 W/cm2)的红色发光材料很少。虽然Eu2+掺杂的氮化物荧光材料,如(Ba,Sr)2Si5N8∶Eu2+(λem=590~625 nm,半峰宽(FWHM)≈2 050~2 600 cm-1)[12]和(Ca,Sr)-SiAlN3∶Eu2+(λem= 610~660 nm,FWHM≈2 100~2 500 cm-1)[13]已在商用pc-wLEDs照明中得到应用,但是这些材料很大一部分光是在人眼灵敏度范围之外产生的(>700 nm),这极大地限制了具有暖白光发射的高质量pc-wLEDs(CRI>90)可达到的最大发光效率。具有较窄发射带的材料,例如硫化物材料Sr1-xCaxS∶Eu2+(λem=615~650 nm,FWHM≈1 550~1 840 cm-1)具有吸引人的发光特性,但仍存在着局限性。例如,硫化物发光材料随着温度的升高会发生严重的发光猝灭,其易水解且生成具有毒性的H2S气体这些特性都阻碍了硫化物荧光材料的实际应用[14]。
此外,限制显示色域的蓝/绿色荧光材料对于提高pc-wLEDs的应用也极为重要,而改进绿色荧光材料,使其在CIE图中达到更好的定位也成为了当今的主要挑战[15]。目前绿光发射的材料主要有量子点(QD)和稀土掺杂的荧光材料,例如CsPbBr3QD和β-SiAlON∶Eu2+[16-18]。但是,β-SiAlON∶Eu2+的宽带发射和CsPbBr3较差的热稳定性以及在周围环境中的降解行为,限制了它们的商业应用。因此,开发新型、环保、具有卓越发光性能的新一代红色和绿色荧光材料已迫在眉睫。
Eu2+的5d轨道位于最外层,4f-5d跃迁对局部环境的变化非常敏感,所以通过调节基质的晶体结构,可以实现Eu2+掺杂荧光材料不同发光性能的调节,如KxCs1-xAlSi2O6∶Eu2+、[Rb(1-x)K(x)]3LuSi2O7∶Eu2+等[19-22]。获得具有小斯托克斯位移、窄带发射的Eu2+掺杂的发光材料的前提是选取具有致密度κ≥0.5(κ是晶胞中的原子所占的体积与该晶胞所占体积之比)的刚性网络结构基质,其阳离子排列有序且仅提供一个晶体学掺杂位点,限制Eu2+激发态的局部结构弛豫[4,23]。只有了解Eu2+窄带发射与基质结构的关系,才能设计制备高效的窄带发光材料,进一步改善pc-wLEDs的发光特性。本文概述了具有UCr4C4型结构的Eu2+离子掺杂的窄带氮化物、氮氧化物及氧化物发光材料的研究进展,对UCr4C4型窄带荧光材料的结构、发光性质及应用进行了介绍,并对其未来的发展进行了总结和展望。
2 Eu2+离子的发光特性及UCr4C4型基质化合物的晶体结构
2.1 Eu2+离子的发光特性
Eu2+具有4f7电子构型,是目前使用最广泛的激活剂之一,它可将(近)紫外或蓝光辐射转化为可见光,且发射带的形状、位置取决于其所处的晶体场强度,如图1所示。Eu2+离子4f65d1激发态的能量通常低于最低激发态6p的能量,因此大多数化合物中的Eu2+离子因其4f65d1-4f7跃迁而呈现带状发射。而Eu2+的5d轨道处于最外层,会受到周围晶体场、对称性、阴离子极化性和基质晶体共价性的强烈影响[24-27]。其中,当较大的电子云重排效应和较强的晶体场作用于Eu2+时,5d能级会降低,从而导致激发和发射的能量降低,光谱位置红移。此外,电子云重排效应与基质中配体离子的电荷和半径密切相关,当基质中的配位环境变化时, Eu2+离子4f65d1-4f7跃迁产生的发光颜色也会随之发生变化。研究表明:当掺杂基质具有刚性结构、高的致密度(κ≥0.5)、阳离子有序且仅有一个晶体学掺杂位点时,Eu2+可产生具有较小斯托克斯位移的窄带发射。以UCr4C4型矿物结构为模型的Eu2+激活的窄带发光材料是目前研究最多、性能最好、最具有应用潜力的一类窄带发射荧光材料。

图1 (a)某一结构单元中发光中心Eu2+离子的发光示意图;(b)Eu2+离子的发光能级结构示意图。
2.2 UCr4C4型晶体结构
如图2所示,UCr4C4结构原型为四方晶系,空间群为I4/m,晶胞参数为a=b=0.079 363 nm,c=0.030 754 nm,V=0.000 193 70 nm3,Z=2。碳原子占据四个铬原子和两个相邻铀原子形成的八面体空隙[29]。表1为UCr4C4矿物结构模型的原子参数。以UCr4C4矿物结构为模型的化合物通式可写为Me(A,B)4X4,其中Me为碱金属或碱土金属离子,A和B为配位离子。在结构上,[AX4]和[BX4]四面体通过共边或共顶点形式连接形成[001]方向的vierer环,而Me原子容纳于环形通道内,形成致密度κ(AB/X)=1的刚性结构。基于Eu2+离子的发光特性,研究者们利用Eu2+取代UCr4C4矿物结构中唯一高度对称的阳离子Me格位设计实现Eu2+离子的多色窄带发光。2014年,Schnick 课题组首次研究了FWHM 仅为 50 nm(1 180 cm-1)的新型UCr4C4结构氮化物窄带红色荧光材料Sr[LiAl3N4]∶Eu2+[10]。之后多个课题组在UCr4C4模型的基础上又相继设计研究了UCr4C4型氮化物窄带红色荧光材料如Me[Mg2Al2N4](Me=Ca,Sr,Ba,Eu)、Me-[Mg3SiN4]∶Eu2+(Me=Sr,Ba,Ca)等[30-32],UCr4C4型氧化物窄带蓝色荧光材料如NaLi3SiO4∶Eu2+、AELi2[Be4O6]∶Eu2+(AE=Sr,Ba)等[33-34],UCr4C4型氮氧化物窄带(橘)黄色荧光材料Na1-xEux-[Li3-2xSi1-xAl3xO4-4xN4x]等[35],UCr4C4型氧化物窄带青色及绿色荧光材料如Na0.5K0.5Li3SiO4∶Eu2+、RbLi(Li3SiO4)2∶Eu2+等[1,36]。
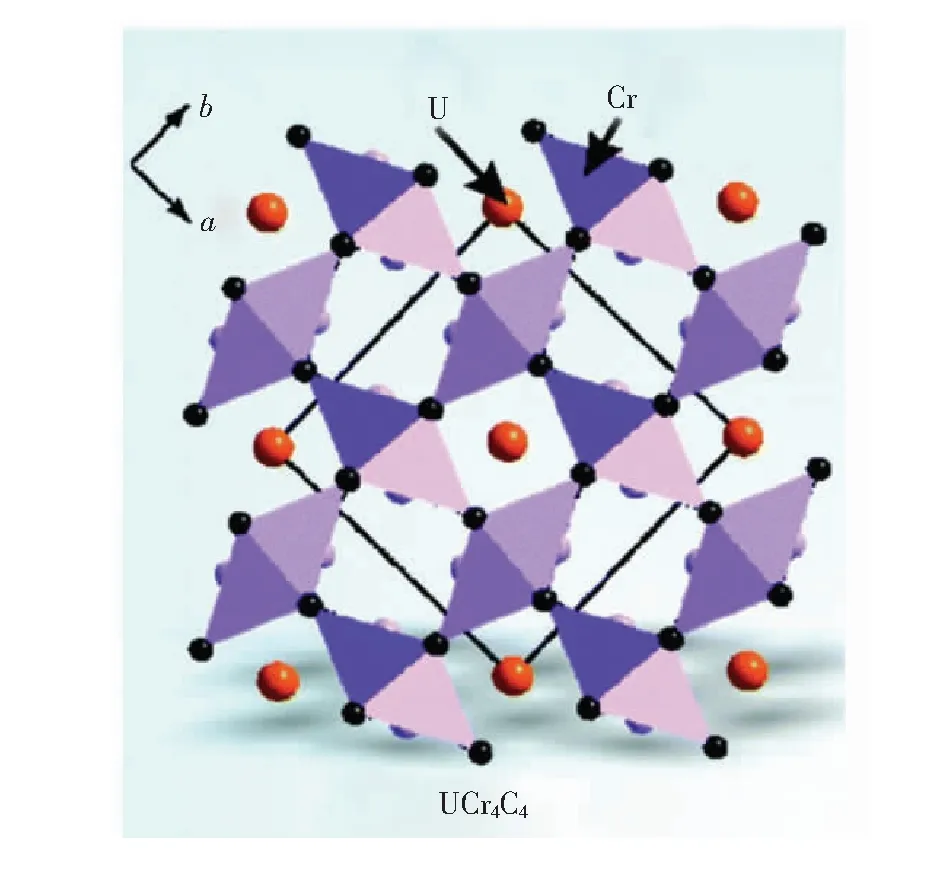
图2 UCr4C4矿物结构模型[28]

表1 UCr4C4矿物结构模型的原子参数
UCr4C4型氮(氧)化物窄带荧光材料主要呈红光发射,而UCr4C4型氧化物荧光材料主要发射蓝、绿光,这主要是由于O2-的形成能低于N3-的形成能,氧化物中化学键的共价性低于氮化物,因此氧化物中Eu2+的5d能级高于氮化物。接下来本文将重点介绍几种性能优异且具代表性的Eu2+掺杂UCr4C4型氮化物、氮氧化物及氧化物窄带荧光材料。
3 UCr4C4-型窄带发光材料的合成方法
UCr4C4型窄带荧光材料的合成方法通常为固相法。以FWHM仅为20.7 nm、热稳定性高达93%的超窄带蓝绿光发射Na0.5K0.5Li3SiO4∶Eu2+(NKLSO∶Eu2+)为例,具体方法如下[1]:使用传统的固态反应合成NKLSO:xEu2+(x=0~15%)样品。将化学计量的Na2CO3(分析纯)、K2CO3(分析纯)、Li2CO3(分析纯)、SiO2(分析纯)和Eu2O3(99.99%)与适量乙醇均匀混合并研磨半小时;将研磨好的混合物在空气条件下550 ℃预烧5 h,然后在管式炉中与N2-H2(10%)混合还原气氛下在750 ℃下烧结4 h;最后将获得的样品冷却至室温,再研磨成细粉,以进行进一步表征。
4 结构相关的UCr4C4-型窄带发射荧光材料的发光性能及应用
4.1 UCr4C4-型氮化物窄带发射荧光材料
如表2所示,虽然Me[LiAl3N4]、Me[Mg3SiN4]、Me[Mg2Al2N4](Me=Ca2+,Sr2+,Ba2+)及BaLi2-[(Al2Si2)N6]化合物结构参数不完全相同,但都属于UCr4C4型化合物。其中,Me[LiAl3N4]、Me[Mg3SiN4]和Me[Mg2Al2N4](Me=Ca2+,Sr2+,Ba2+)化合物的结构框架都是由(Mg,Si)N4/(Al, Mg)N4/(Li, Al)N4-四面体通过边角共享形成vierer环,与之不同的是BaLi2[(Al2Si2)N6]化合物的结构框架由(Al,Si)N4四面体相连形成沿[001]方向的两种类型的vierer环层,并通过公共角连接,沿[100]相互对应。这几种化合物中Me均与8个N原子配位并容纳于vierer环形通道内部,且化合物均为致密度κ=1的刚性结构。而致密度较高的刚性结构会限制Eu2+的几何弛豫,减小发光的斯托克斯位移,产生较窄的发射带。由于Me(Ca2+、Sr2+、Ba2+)与Eu2+的离子半径相似,所以当Eu2+在这几种氮化物中掺杂时有望占据Me位点。由于Eu2+对基质的局部环境非常敏感,所以当Eu2+在不同的基质环境中其发光性能也是有差异的。下面以Eu2+掺杂的Sr[LiAl3N4]和BaLi2[(Al2Si2)N6]化合物为例介绍其发光性能及应用。所列举的其他几种Eu2+掺杂氮化物荧光材料的发光性能参数均记录在表2中。

表2 已报道的Eu2+ 掺杂UCr4C4基氮化物、氮氧化物和氧化物窄带荧光材料的晶体结构和发光性质对照
4.1.1 Sr[LiAl3N4]∶Eu2+

图3(a)显示了Sr[LiAl3N4]∶0.4%Eu2+的激发和发射光谱。Sr[LiAl3N4]∶0.4%Eu2+在466 nm处出现最大吸收值,在654 nm处产生了FWHM为50 nm的发射带。当激发波长为440 nm时,该材料的外(内)量子效率接近52(76)%。用于暖白光高功率pc-wLEDs中的市售红色CaAlSiN3∶Eu2+荧光材料,其激发和发射光谱如图3(a)中灰色曲线所示。当以440 nm的蓝光激发时,CaAlSiN3∶Eu2+的外(内)量子效率为74(96)%。相比于Sr[LiAl3N4]∶0.4%Eu2+,市售CaAlSiN3∶Eu2+的大部分发射是在人眼敏感度较低的光谱区域产生的(虚线),这导致pc-wLEDs的发光效率受到了极大的限制。此外,Sr[LiAl3N4]∶0.4%Eu2+的FWHM明显较窄,发射光集中在可见光谱区域,进一步增强了红光发射的色饱和度。对于高质量的固态照明而言,在蓝色光谱范围内具有较强吸收且能产生红色窄带发射的荧光材料是非常具有应用价值的。图3(b)中将市售的高显色指数LED的发射光谱(灰色曲线)与Lu3Al5O12∶Ce3+(绿色)、(Ba, Sr)2Si5N8∶Eu2+(橙色)和Sr[LiAl3N4]∶Eu2+(红色)荧光材料混合的pc-LED的光谱(粉红色曲线)进行了比较,两种pc-LED都具有2 700 K的相关色温(图3(b)插图),但由窄带Sr[LiAl3N4]∶Eu2+制备所得的pc-LED的发光效率较市售白光LED提高了14%,并且具有卓越的色彩再现性(Ra=91,R9=57)。图3(c)显示了Sr[LiAl3N4]∶Eu2+样品光致发光强度的温度依赖性曲线,在500 K时,发光强度仅下降5%,这与Ce3+掺杂的石榴石荧光材料的优异性能相当[10]。

图3 (a)Sr[LiAl3N4]∶0.4%Eu2+(蓝色)和CaAlSiN3∶Eu2+(浅灰色)的激发光谱和λexc = 440 nm时,Sr[LiAl3N4]∶0.4%Eu2+(粉红色)和CaAlSiN3∶Eu2+(深灰色)的发射光谱。虚线表示人眼敏感度的上限。(b)相关色温均为2 700 K的pc-LEDs的发光光谱。粉红色曲线:Lu3Al5O12∶Ce3+(绿色荧光材料)、(Ba,Sr)2Si5N8∶Eu2+(橙色荧光材料)和SrLiAl3N4∶Eu2+(红色荧光材料)组合而成的发光二极管。灰色曲线:商用的高效LED。插图显示了两种LED的CIE 1931颜色坐标。(c)Sr[LiAl3N4]∶0.4%Eu2+光致发光强度的温度依赖性曲线[10]。
4.1.2 BaLi2[(Al2Si2)N6]∶Eu2+
如图4(a)所示,BaLi2[(Al2Si2)N6]化合物属于四方晶系,空间群为P4/ncc,晶胞参数为a=b=0.78 282(4)nm,c=0.99 557(5)nm。BaLi2-[(Al2Si2)N6]∶1%Eu2+的激发光谱(图4(b),λem=540 nm)表明其蓝色光谱范围内有较强吸收且最大吸收峰在395 nm处,表明BaLi2[(Al2Si2)N6]∶Eu2+可被(近)紫外或蓝光有效激发而发射绿光。在395 nm激发下,该材料在532 nm处产生了FWHM为57 nm的绿光发射,色坐标(CIE)为(0.30,0.64)。此外,样品在200 ℃时显示出了较低的热猝灭,相对发射强度为70%。良好的性能表明其可作为潜在的绿光发射荧光材料[4]。
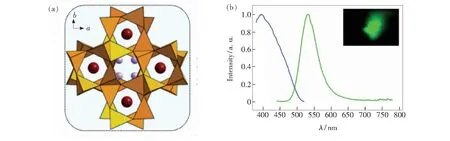
图4 (a)沿[001]的BaLi2[(Al2Si2)N6]晶体结构,(Al, Si)N4四面体(橙色),Li(紫色),Ba(红色);(b)掺杂Eu2+的BaLi2[(Al2Si2)N6]荧光材料的发光特性、激发(蓝线)和发射(绿线)光谱[4]。
4.2 UCr4C4-型氮氧化物窄带发射荧光材料
如表2所示,Sr[Li2Al2O2N2]和Na1-xEux-[Li3-2xSi1-xAl3xO4-4xN4x](x=0.22)是UCr4C4型氮氧化物窄带发射材料的两个典型代表,虽然这两类化合物的空间群和结构参数不同,但均是UCr4C4-结构类型的有序变体,其结构有很大的相似之处。两种化合物的阴离子骨架都是由角和边共享的四面体组成,为致密度κ=1的四面体刚性网络。
以Eu2+掺杂的Sr[Li2Al2O2N2]为例,对其晶体结构、发光性能进行介绍。如图5(a)所示,Sr-[Li2Al2O2N2]化合物中的Sr位点对应于UCr4C4-结构中的铀位置,铝和锂在相应的铬位置上有序排列,而氮和氧在碳的位置上有序排列。[AlON3]8-(灰色)和[LiO3N]8-(橙色)两种四面体交替连接形成一个致密度κ=1的vierer刚性网络通道。容纳在通道中的Sr2+离子位于反转中心,与4个氧原子和4个氮原子配位形成了高度对称的立方体(图5(b))。由于Eu2+(0.139 nm)和Sr2+(0.140 nm)的离子半径几乎相同,因此Eu2+掺杂时有望取代Sr2+位点。如图5(c)所示,Sr[Li2Al2O2N2]∶Eu2+具有370~520 nm范围的激发带,其最大激发峰值在450 nm左右。当用460 nm蓝光激发时,该材料在614 nm处产生了半峰宽为50 nm的窄带红光发射。值得注意的是,相比于前面介绍的Sr[LiAl3N4]∶Eu2+红色荧光材料,Sr[Li2Al2O2N2]∶Eu2+的发射带位于更高能量处,这显著增加了发射带与人眼灵敏度曲线的重叠(图5(c)中的黑色虚线)。此外,当温度为420 K时,发光强度与室温下的初始强度(298 K)相比仅下降了4%(图5(d)),且该材料的量子效率大于或等于80%,这表明其具有较好的发光性能[38]。

图5 (a)沿[001]方向Sr[Li2Al2O2N2]∶Eu2+化合物的2×2×2超晶胞视图,红色球代表锶原子,蓝色球代表氧原子,绿色球代表氮原子,[LiO3N]8-四面体以橙色显示,[AlON3]8-四面体以灰色显示,红色多面体表示Sr2+的立方体配位;(b)O原子和N原子对Sr2+的八配位透视图;(c)Sr[Li2Al2O2N2]∶Eu2+的归一化激发(灰色,λex = 614 nm监测)和发射光谱(红色,λexc = 460 nm)、参考值Sr[LiAl3N4]∶Eu2+(紫色)的发射光谱和人眼灵敏度曲线(黑色虚线);(d)测得的Sr[Li2Al2O2N2]∶Eu2+从298~500 K的相对光致发光强度[38]。
4.3 UCr4C4-型氧化物窄带发射荧光材料
如表2所示,UCr4C4-型具有窄带发射的氧化物荧光材料主要分为硅(锗)酸盐和铍酸盐两类。硅(锗)酸盐主要包括MLi3SiO4、M2(Li3SiO4)、M4(Li3SiO4)4、NaK7[Li3SiO4]8∶Eu2+(M=Rb,Na,K,Li)及CsKNa2(Li3GeO4)4∶Eu2+。这4类化合物的结构既相似又不同。相似之处在于4种类型的化合物均具有UCr4C4型结构基础,由LiO4和SiO4四面体的顶点和边缘共享连接组成致密度κ=1(原子比(Li, Si)∶O)的刚性网络结构,M原子填充在vierer环形通道中,且其余3种化合物均以MLi3SiO4为模型通过组分取代演变而来。不同之处在于4种类型化合物因组分差异最终形成的构相不同,因而具有不同的晶体结构和空间群,如表2所示。例如M2(Li3SiO4)类型中的RbLi(Li3SiO4)2化合物来源于MLi3SiO4类型中的NaLi3SiO4结构,由NaLi3SiO4化合物中Na原子被Rb和Li原子取代得到,而RbNa(Li3SiO4)2化合物可以看做是RbLi(Li3SiO4)2化合物中的两个Li位点被引入的Na取代。而Na位点的取代极大地增强了RbNa(Li3SiO4)2化合物的稳定性,降低了掺杂剂Eu2+周围的晶格弛豫,使其具有更小的斯托克斯位移,产生更窄的发射带。铍酸盐材料目前仅报道了蓝光发射AELi2[Be4O6]∶Eu2+(AE=Sr,Ba)荧光材料。因此,下面我们选取具有代表性的Eu2+掺杂的硅酸盐M2(Li3SiO4)2(M=Rb,Li,Na)、M4(Li3SiO4)(M=Rb,Na,K,Li)及铍酸盐AELi2[Be4O6]∶Eu2+(AE= Sr,Ba)荧光材料为例介绍它们的晶体结构变化、发光性能及应用。
4.3.1M2(Li3SiO4)2(M=Rb,Li,Na)
RbLi(Li3SiO4)2来源于NaLi3SiO4结构,两者具有相同的UCr4C4型结构基础,其中NaLi3SiO4中的Na原子被Rb和Li原子取代。但是这两种化合物属于不同构相,NaLi3SiO4属于四方晶系,空间群为I41/a,而RbLi(Li3SiO4)2属于单斜晶系,空间群为C2/m。图6显示了RbLi(Li3SiO4)2的晶体结构,其中Rb+离子与8个O2-离子配位形成扭曲的立方体,Eu2+取代Rb+位点[33]。1994年,Hoppe[46]就报道了RbNa(Li3SiO4)2的晶体结构,与RbLi(Li3SiO4)2结构基本相同。图7(a)清晰地展示了RbLi(Li3SiO4)2与RbNa(Li3SiO4)2晶体结构图的比较,其中RbNa(Li3SiO4)2可以看作是RbLi(Li3SiO4)2的环形通道中的Li原子被引入的Na原子所取代。在RbLi(Li3SiO4)2结构中,位于b轴上的Li3(2b)和Li4(2a)位点形成互不接触的LiO4四面体。Na的引入取代了这两个Li位点,但与锂离子不同的是钠离子占据了局部对称的4g位置,形成了NaO8正方体,这些立方体通过面相互连接,在RbNa(Li3SiO4)2中的b轴上形成…——NaO8-NaO8——…(图7(a))。与RbLi(Li3SiO4)2相比,这些节点大大提高了RbNa-(Li3SiO4)2化合物的稳定性。严格地说,这两个化合物不是同型的,钠离子的离子半径大于锂离子,使得Li3(2b)和Li4(2a)位点与Na(4g)位点不重合,但两者都属于单斜结构,空间群均为C2/m,致密度κ(Li3Si∶O4)=1且具有相似的细胞参数,除了Li3、Li4和Na,大多数离子都位于相同的Wyckoff位点。图7(b)红色虚线内是两种结构转变的过程,其中Na离子不能穿透O4正方形的中心,而是从该中心向外移动,形成与8个O2-离子的配位。产生了RbLi(Li3SiO4)2中[LiO4]四方到RbNa(Li3SiO4)2中[NaO8]立方的多面体变换,而这种局部结构的变化也会影响Eu2+发射峰的位置[40]。在460 nm蓝光激发下,RbLi(Li3SiO4)2∶Eu2+样品在530 nm处产生了一个FWHM为42 nm的超窄绿光发射带。而RbNa(Li3SiO4)2∶Eu2+的发射峰位于523 nm处,FWHM=41 nm,与RbLi(Li3SiO4)2∶Eu2+荧光材料相比,RbNa-(Li3SiO4)2∶Eu2+的PL光谱显示蓝移,这归因于斯托克斯位移效应[31]。

图6 NaLi3SiO4的晶体结构[33]

图7 (a)RbLi(Li3SiO4)2和RbNa(Li3SiO4)2晶体结构的比较;(b)结构转换机制,论证了由于Na+的离子半径比Li+大,在RbNa(Li3SiO4)2中形成[NaO8]立方而在RbLi(Li3SiO4)2中形成[LiO4]平方[40]。
图8(a)中,RbNa(Li3SiO4)2∶8%Eu2+、RbLi-(Li3SiO4)2∶8%Eu2+和市售β-SiAlON∶Eu2+荧光材料的激发光谱均显示了从紫外到蓝色区域的宽激发带。与β-SiAlON∶Eu2+相比,RbNa(Li3SiO4)2∶8%Eu2+和RbLi(Li3SiO4)2∶8%Eu2+的发射光谱具有更窄的发射带。由图8(b)可看出,RbNa-(Li3SiO4)2∶8%Eu2+的斯托克斯位移(1 680 cm-1)明显小于RbLi(Li3SiO4)2∶8%Eu2+的斯托克斯位移(2 032 cm-1)。斯托克斯位移与掺杂离子周围的晶格弛豫有关,而与RbLi(Li3SiO4)2相比,RbNa(Li3SiO4)2的结构更为紧凑,从而降低了晶格弛豫。RbNa(Li3SiO4)2∶8%Eu2+的发光位于深绿色区域,对于LCD背光源应用领域,它有助于获得比β-SiAlON∶Eu2+更大的色域。在455 nm蓝光激发下,绿色荧光材料RbNa(Li3SiO4)2∶8%Eu2+的内/外量子效率(IQE/EQE)分别为96.2%/44.2%。RbNa(Li3SiO4)2∶8%Eu2+的EQE几乎达到β-SiAlON∶Eu2+的70%(EQE=64.5%),远高于RbLi(Li3SiO4)2∶8%Eu2+(EQE=29%),这与斯托克斯位移的减少密不可分。图8(c)显示了RbNa(Li3SiO4)2∶8%Eu2+刚制备的样品和暴露于环境大气中不同天数样品的发射光谱,其插图显示了暴露于环境大气5,10,15,20 d后,样品的发射强度分别下降到原始样品发射强度的97%、95%、94%和91%,因此,RbNa-(Li3SiO4)2∶8%Eu2+荧光材料的化学稳定性优于RbLi(Li3SiO4)2∶8%Eu2+(74%@7 d)[40],这归因于RbLi(Li3SiO4)2中的[LiO4]四面体被RbNa-(Li3SiO4)2中的[NaO8]立方体取代。此外,荧光材料的热稳定性在白光LED的实际应用中起着重要的作用。从图8(d)可以看出,455 nm蓝光激发下,RbNa(Li3SiO4)2∶8%Eu2+荧光材料具有优异的热稳定性,并且随着温度的升高,发射峰仅显示出从523 nm到519 nm的轻微蓝移。与300 K时的初始强度相比,峰值强度在425 K时仅下降了8.5%,即使在500 K时,峰值强度仍为300 K时峰值强度的88%,但积分强度没有显示出下降,这是由发射带变宽(FWHM从41 nm增加到51 nm,图8(e))导致的。随着温度从300 K升高到425 K,RbNa(Li3SiO4)2∶8%Eu2+的CIE色度坐标从(0.202 3,0.717 5)变为(0.195 9,0.693 4),表明RbNa(Li3SiO4)2∶8%Eu2+具有中等的色度稳定性。用绿色荧光材料RbNa(Li3SiO4)2∶8%Eu2+、商业红色荧光材料KSF∶Mn4+和发射蓝色的InGaN芯片(λem=455 nm)组合制备的pc-wLEDs及其发射光谱如图8(f)所示。经过优化的pc-wLEDs器件在20 mA的电流下显示出明亮的白光,且具有高达111.08 lm·W-1的发光效率,色域达到了113%NTSC(National Television Standards Committee)。除了先前报道的基于Sr2MgAl22O36∶Mn2+荧光材料的pc-wLEDs之外,该pc-wLEDs的显色性能比所报道的其他荧光材料转换的pc-wLEDs更高。该pc-wLEDs的相关色温(CCT)和CIE色坐标分别为5 196 K和(0.339 3,0.337 2)[40]。

图8 (a)RbNa(Li3SiO4)2∶8%Eu2+、RbLi(Li3SiO4)2∶8%Eu2+(红色虚线)、β-SiAlON∶Eu2+(蓝色短虚线)的PLE和PL光谱,插图显示了未研磨的绿色RbNa(Li3SiO4)2∶8%Eu2+荧光材料和365 nm紫外灯下发光的数码照片,坩埚尺寸为11 mm×20 mm;(b)RbLi(Li3SiO4)2和RbNa(Li3SiO4)2基质中Eu2+离子的能级示意图;(c)原始RbNa-(Li3SiO4)2∶Eu2+ 样品和在大气中暴露不同时间后样品的PL谱图,插图显示了归一化积分PL强度随时间的变化关系;(d)以25 K为温度间隔,300~500 K温度范围内RbNa(Li3SiO4)2∶8%Eu2+荧光材料在455 nm激发下随温度变化的发射光谱;(e)RbNa(Li3SiO4)2∶8%Eu2+的归一化积分强度、峰强度和FWHM的温度依赖性变化;(f)使用绿色荧光材料RbNa(Li3SiO4)2∶Eu2+、红色荧光材料KSF∶Mn4+和蓝色InGaN芯片组装的wLED器件在20 mA电流下的发射光谱(λem=455 nm),插图显示了所组装发光wLED的照片[40]。
4.3.2M4(Li3SiO4)4∶Eu2+(M=Rb+,Na+,K+,Cs+)


图9 由RbNa3(Li3SiO4)4到RbNa2K(Li3SiO4)4再到CsNa2K(Li3SiO4)4和CsNaKLi(Li3SiO4)4的阳离子取代结构示意图[42-43]

图10 (a)Na1、Na2和Rb的配位多面体及在80 K时RbNa3(Li3SiO4)4∶Eu2+的发射光谱和高斯拟合[40];(b)~(c)室温下RbNa3(Li3SiO4)4∶8%Eu2+、RbNa2K(Li3SiO4)4∶8%Eu2+和CsNa2K(Li3SiO4)4∶Eu2+∶8%Eu2+的PLE谱和PL谱[42];(d)CsNa1.98K(Li3SiO4)4∶0.02Eu2+样品在75 K时的发射光谱(蓝线)和高斯拟合[43];(e)CsKNa2-yLiy-(Li3SiO4)4和CsKNa1.98-yLiy(Li3SiO4)4∶0.02Eu2+样品的晶胞体积变化图[43];(f)CsKNa1.98-yLyLSO∶0.02Eu2+(0 ≤y≤ 1)(λex=398 nm)的标准归一化PL光谱[43]。
图10(d)是CsNa1.98K(Li3SiO4)4∶0.02Eu2+样品在75 K时的发射光谱和高斯拟合,该发射带拟合为3个发射峰,分别位于484.6 nm(峰1,FWHM=23 nm)、485.1 nm(峰2,FWHM=8 nm)、526.0 nm(峰3,FWHM=53 nm)。峰1和峰2的位置非常接近,这可能与Eu2+占据相似的位点有关。同RbNa3(Li3SiO4)4∶Eu2+的晶体结构相似,CsNa1.98K(Li3SiO4)4∶0.02Eu2+具有两种类型的晶体学位点,分别是较高对称的Cs(4/m)、K(4/m)位点和较低对称的Na(-4)位点。而发射带的宽度与高致密性结构和高晶格对称性有关,所以窄带峰1和峰2可归因于Eu2+占据具有高对称性立方晶格的Cs和K位。与K+(r=0.151 nm,CN=8)相比,Cs+(r=0.174 nm,CN=8)的离子半径比Eu2+(r=0.125 nm,CN=8)大得多,因此峰2源自Eu2+占据Cs位点,而峰1则归属于K位点中Eu2+的占据。而考虑到更近的离子半径,在485 nm处的窄带青色发射主要归因于Eu2+在K位点的占据,基本上可以忽略Cs位点的Eu2+发射。对于拟合峰3,则归因于Eu2+离子占据较低对称性的Na位点。其次,经计算,在CsNa1.98K(Li3SiO4)4∶0.02Eu2+样品中,进入Na位点的Eu2+离子的E(Eu2+的发射峰位置)值小于进入K位点的,这更进一步确定526 nm和485 nm处的峰分别来自Na和K处的Eu2+发射。图9中Li+的引入改变了晶格的局部环境,提高了Na多面体的刚度,而Eu2+激活剂对局部配位环境极其敏感,所以Li+的引入会导致Eu2+的重新分布。如图10(e)所示,当y=0~0.2时Eu2+掺杂的样品晶胞体积小于基质的晶胞体积,这可能是较小的Eu2+离子主要进入较大的K位点所致。而当y=0.8~1.0时,则Eu2+离子主要占据较小的Na位点,所以Eu2+掺杂样品的晶胞体积大于基质的晶胞体积。这些结果表明,随着Li+离子的增加,Eu2+离子从K位点转移到Na位点。而在526 nm和485 nm处的发射峰是分别来自于Na和K位点处Eu2+的发射,因此,随着Li+的增加,在526 nm处的发射峰强度增加,而在485 nm处的发射峰强度降低(图10(f))[43]。
荧光材料所组成器件的性能是实际应用的关键,其中具有代表性的青色CsNa1.48KLi0.5(Li3SiO4)4∶0.02Eu2+荧光材料与UV(370 nm)芯片和红色CaAlSiN3∶Eu2+荧光材料组装的pc-wLED,在3.15 V的电压和20 mA的电流下,发射出了具有较低CCT为 3 084 K,CRI为 84.2和CIE色坐标为(0.402 2,0.418 7)的暖白光。绿色CsNa0.98KLi(Li3SiO4)4∶0.02Eu2+荧光材料与UV(370 nm)芯片、蓝色BaMgAl10O17∶Eu2+荧光材料和红色CaAlSiN3∶Eu2+荧光材料组装的pc-wLED,其流明效率为94.16 lm/W,呈现出CCT=5 045 K、CRI=95.8、CIE色坐标为(0.331 5,0.375 0)的暖白光(图11)[43]。

图11 由n-UV LED芯片(λex=370 nm)激发的荧光材料组装的pc-wLED器件的电致发光(EL)光谱和发光照片[43]。(a)红色CaAlSiN3∶Eu2+荧光材料和蓝绿色CsNa1.48KLi0.5(Li3SiO4)4∶0.02Eu2+(y=0.5)荧光材料;(b)蓝色BaMgAl10O17∶Eu2+荧光材料、红色CaAlSiN3∶Eu2+荧光材料和发出绿色光的CsNa0.98KLi(Li3SiO4)4∶0.02Eu2+(y =1.0)。
4.3.3AELi2[Be4O6]∶Eu2+(AE=Sr,Ba)
AELi2[Be4O6]∶Eu2+(AE=Sr,Ba)化合物的空间群为P4/ncc,其晶体结构如图12所示,BeO4四面体通过边角共享形成沿[001]延伸并填充Li或AE(Sr,Ba)原子的两种不同类型的vierer环通道。化合物高度对称的晶体结构为AE2+(AE=Sr,Ba)和Li+各提供了一个晶体学位点,同时高致密度的网络结构使AELi2[Be4O6]∶Eu2+(AE=Sr,Ba)化合物满足窄带发射荧光材料的要求:较高的化学和热稳定性、大的带隙以及高量子效率(QE)和高温下的色稳定性。化合物的刚性网络结构限制了处于激发态的掺杂剂(Eu2+)的局部结构弛豫,且具有较小的斯托克斯位移,这为其窄带发射奠定了基础。此外,四面体配位的Be原子的引入与四面体配位的Li或Mg化合物相比,Be-配体键具有更强的共价特性,可进一步改善较大的带隙和刚性网络。因此,AELi2[Be4O6]∶Eu2+(AE=Sr,Ba)荧光材料可以产生半峰宽仅为25 nm的窄带发射[34]。

图12 发射超窄带蓝光的AELi2[Be4O6]∶Eu2+(AE=Sr,Ba)化合物的结构示意图[34]
图13(a)显示了BaLi2[Be4O6]∶Eu2+和SrLi2-[Be4O6]∶Eu2+荧光材料的激发和发射光谱,其Eu2+掺杂浓度均为1%。如图所示,SrLi2[Be4O6]∶Eu2+和BaLi2[Be4O6]∶Eu2+荧光材料的发射峰分别位于456 nm和454 nm处,二者的半峰宽均为1 200 cm-1,且两种化合物都显示出由紫外延伸到蓝色光谱区的宽吸收带,表明这两种荧光材料适合于短波蓝色InGaN发光二极管的激发。当在410 nm蓝紫光激发时,BaLi2[Be4O6]∶Eu2+和SrLi2[Be4O6]∶Eu2+荧光材料的内(外)量子效率分别为64%(47%)和47%(16%)。图13(b)显示了两种荧光材料的热猝灭(TQ)行为。在200 ℃时,BaLi2[Be4O6]∶Eu2+与SrLi2[Be4O6]∶Eu2+的相对发射强度分别为83%和76%,均显示出了较低的热猝灭行为,表明这两种荧光材料具有较好的热稳定性[34]。

图13 超窄带蓝光发射AELi2[Be4O6]∶Eu2+(AE=Sr,Ba)荧光材料的光致发光特性。(a)BaLi2-[Be4O6]∶Eu2+(蓝色)和SrLi2[Be4O6]∶Eu2+(绿色)的激发和发射光谱,λexc=400 nm;(b)BaLi2-[Be4O6]∶Eu2+(灰色)和SrLi2[Be4O6]∶Eu2+(黑色)的温度依赖性相对积分光致发光强度,与室温下强度相比,在200 ℃下分别降低了17%和24%[34]。
5 UCr4C4-型窄带荧光材料的性能调控
5.1 光色调控:利用晶体工程策略进行组成调变,实现光谱调控
利用晶体工程策略进行组成调变以优化和设计发光材料从而实现光谱调控是稀土激活荧光材料的重要组成部分。CsKNa1.98(Li3Si1-zGezO4)4∶0.02Eu2+(0≤z≤1)荧光材料依据离子取代实现了从青光到蓝光的光色调控,Ge4+替代Si4+离子后局部晶体结构的变化如图14(a)所示[43]。当半径较大的Ge4+离子取代半径较小的Si4+离子时会导致SiO4四面体的膨胀,从而增强由4个LiO4四面体和4个SiO4四面体包围的Na位点周围的压力,使得Na—O键长度逐渐减小即Na-六面体逐渐收缩。当Na六面体收缩到一定程度时,Eu2+离子将很难占据Na位点,而由Eu2+占据Na位点所产生的发射带也会随之消失。其次,K/Cs位点仅被LiO4四面体包围,这意味着SiO4四面体向Na位点的收缩会增加Si4+与K/Cs位点之间的距离,即K—O和Cs—O的平均键长增加。而且随着Ge4+离子掺杂量的增加,晶体场强和Stokes位移会逐渐减小(图14(b)),5d态的能量逐渐增加[43]。

图14 (a)Si4+离子取代Ge4+离子后局部晶格结构的变化;(b)CsKNa1.98(Li3Si1-zGezO4)4∶0.02Eu2+(z=0,0.5,1)中Eu2+离子的能级示意图[43]。
图15(a)中的PLE光谱显示了CsKNa1.98-(Li3Si1-zGezO4)4∶0.02Eu2+(0≤z≤1)荧光材料具有一个因Eu2+4f-5d跃迁引起的250~430 nm范围的激发带。在CsKNa1.98(Li3Si1-zGezO4)4∶0.02Eu2+(0≤z≤1)荧光材料中,随着Ge4+浓度的增加,晶体场强和Stokes位移逐渐减小,使得Eu2+因占据K/Cs位点而产生的发射峰发生了从485 nm(青色)到458 nm(蓝色)的蓝移,同时,由Eu2+占据Na位点产生的位于526 nm处的长波峰逐渐消失,如图15(b)所示。当z=1时,CsKNa1.98(Li3GeO4)4∶0.02Eu2+荧光材料在458 nm处产生了FWHM仅为26 nm的对称发射带(图15(c))。计算得出CsKNa1.98(Li3SiO4)4∶0.02Eu2+和CsKNa1.98(Li3GeO4)4∶0.02Eu2+荧光材料的颜色纯度分别为69%和93%,这表明Ge4+离子取代 Si4+离子后光谱的蓝移和肩带的消失提高了荧光材料的颜色纯度。图15(d)所示的CsKNa1.98(Li3Si1-zGezO4)4∶0.02Eu2+(0≤z≤1)荧光材料的寿命变化值与PL光谱的蓝移一致,进一步证实了通过晶体工程策略调节Eu2+离子位点选择所实现的光谱调控。不可忽视的是荧光材料的PL强度和热稳定性会随着Ge4+浓度的增加而降低,并且CsKNa1.98(Li3GeO4)4∶0.02Eu2+荧光材料的内量子产率(IQY)仅为10%,因此荧光材料的发光性能仍需进一步优化[43]。

图15 (a)~(b)CsKNa1.98(Li3Si1-zGezO4)4∶0.02Eu2+(0≤z≤1)荧光材料的归一化PLE和PL光谱(λex=398 nm);(c)CsKNa1.98(Li3GeO4)4∶0.02Eu2+荧光材料的PLE和PL光谱;(d)CsKNa1.98(Li3Si1-zGezO4)4∶0.02Eu2+(0≤z≤1)的光致发光寿命曲线,插图显示了不同Ge4+含量下寿命的变化曲线[43]。
5.2 双壳策略以实现稳定性调控
发光材料的稳定性是白色发光二极管实际应用的关键因素。如4.3.1所述,RbLi(Li3SiO4)2∶8%Eu2+荧光材料暴露于环境大气7 d后,样品的综合发射强度下降到原始样品综合发射强度的74%,这表明RbLi(Li3SiO4)2∶8%Eu2+的稳定性较差,即使它具有出色的抗热猝灭性能,也会阻碍荧光材料的进一步商业化。RbLi(Li3SiO4)2与水反应会生成Rb2Si2O5、RbOH、Li4SiO4和LiOH,放出大量的热,并逐渐变成RbOH、Li2SiO3和LiOH,使溶液的pH值迅速达到13。2020年,夏志国课题组创新性地提出了一种有效的保护方案,即将无定形Al2O3的表面涂层和十八烷基三甲氧基硅烷(ODTMS)的疏水改性相结合,以构建防潮双壳结构的RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS复合材料。构造双壳RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTM复合保护层的方法流程如图16所示。图16(a)展示了表面涂层和疏水性表面改性过程的示意图。首先通过原子沉积法(ALD)将Al2O3涂覆在RLSO∶Eu2+表面,前驱体(三甲基铝,TMA)与RLSO∶Eu2+表面的羟基(—OH)反应(图16(b));然后通入N2,将在氮气流中稀释的反应剂(H2O)引入室中,并通过表面官能团和反应剂的反应诱导氧化铝生长(图16(c));最后,十八烷基三甲氧基硅烷(ODTMS)与RLSO∶Eu2+@Al2O3表面上的—OH反应,硅烷之间彼此偶联形成疏水层(图16(d))[47]。

图16 (a)通过ALD对RbLi(Li3SiO4)2∶Eu2+荧光材料进行表面包覆和用ODTMS对RbLi(Li3SiO4)2∶Eu2+@Al2O3进行疏水性表面修饰的示意图;(b)RbLi(Li3SiO4)2∶Eu2+荧光材料表面的示意图;(c)ALD过程中RbLi(Li3SiO4)2∶Eu2+荧光材料表面氧化铝的可能配位机理;(d)RbLi(Li3SiO4)2∶Eu2+@Al2O3与ODTMS之间的键合性质示意图[47]。
图17(a)、(b)显示了RbLi(Li3SiO4)2∶Eu2+、RbLi(Li3SiO4)2∶Eu2+@Al2O3和RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS荧光材料的PL和PLE光谱,除强度外,它们所产生的光谱轮廓基本相同。所有样品的PLE光谱都显示出由Eu2+离子4f-5d跃迁引起的250~300 nm范围的肩带和300~500 nm范围的主发射带,且均产生以530 nm为中心的FWHM为42 nm的窄带绿光发射,这些结果表明,氧化铝和硅烷层并没有改变基体的基本光学性质。但是,激发带和发射带的强度显示出轻微降低(图17(a)、(b)),表明吸收和量子效率略有下降,这是由涂层不完全透明导致的。图17(c)显示了365 nm紫外线灯下3种样品的发光照片,均为绿光发射[47]。

图17 RbLi(Li3SiO4)2∶Eu2+、RbLi(Li3SiO4)2∶Eu2+@Al2O3 和 RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS荧光材料的PLE(a)和PL(b)光谱;(c)这些样品在365 nm紫外灯下发光照片的比较[47]。
如图18(a)所示,当将RbLi(Li3SiO4)2∶Eu2+和RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS粉末样品直接倒入水中时,RbLi(Li3SiO4)2∶Eu2+粉末立即沉入水中,在365 nm紫外光激发下发出非常弱的绿色荧光,而RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS粉末由于其表面具有疏水性仍漂浮在水面上,且在紫外灯照射下显示出强的绿色荧光。从图18(b)中RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS表面的水滴图像可以看出,水滴并没有渗透到样品中,而是像荷叶上的水滴一样附着在样品表面,且样品在表面改性后显示出约142°的水接触角(图18(c))。图18(d)显示了RbLi-(Li3SiO4)2∶Eu2+、RbLi(Li3SiO4)2∶Eu2+@Al2O3、RbLi(Li3SiO4)2∶Eu2+@ODTMS和RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS样品(0.1 g)浸泡在1 mL水中时荧光发射强度随时间变化的对比图。相比于RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS样品,未改性的RbLi(Li3SiO4)2∶Eu2+荧光材料具有严重的降解趋势。在水中浸泡30 min后,RbLi-(Li3SiO4)2∶Eu2+的PL强度急剧下降至初始强度的10.7%,而RbLi(Li3SiO4)2∶Eu2+@Al2O3、RbLi-(Li3SiO4)2∶Eu2+@ODTMS和RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS在同一时间后仍保持初始强度的24%、50%和86%。此外,RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS浸入水中一小时后仍保持原始强度的76%,这一结果表明RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS样品在极端情况下依然具有良好的耐湿性能。与复合保护层相比,RbLi-(Li3SiO4)2与水反应形成的强碱更容易破坏单涂层。而双层保护方法处理后,RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS样品显示了对水蚀的显著改善,这是因为用ALD制备的Al2O3涂层是致密的,它增加了水渗透的内在保护。同时,Al2O3涂层为进一步的ODTMS涂层提供了均匀的—OH基团表面,从而形成了连续的疏水有机层。图18(e)显示了在不同驱动电流下,由蓝色InGaN芯片(λ=455 nm)、窄带绿色荧光材料RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS和商用红色荧光材料KSF∶Mn4+制成的pc-wLED器件的发射光谱。插图显示了20 mA驱动电流下所制造的pc-wLED器件的照片,其CIE坐标为(0.323 4,0.375 9),CCT为5 841 K,流明效率为70.22 lm/W,在CIE 1931色度坐标图中,pc-wLED的计算色域约为108%NTSC。图18(f)展示了pc-wLED器件暴露于环境大气下发光效率随时间的变化图,30 d后,发光效率仅下降到初始发光效率的93%,这表明pc-wLED器件在周围大气中具有良好的稳定性[47]。

图18 (a)RbLi(Li3SiO4)2∶Eu2+(左)和RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS(右)粉末倒入水中后在日光灯和365 nm紫外灯下的照片;(b)RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS表面上的水滴图像;(c)水接触角的图像;(d)RbLi(Li3SiO4)2∶Eu2+、RbLi(Li3SiO4)2∶Eu2+@Al2O3、RLSO∶Eu2+@ODTMS和RbLi(Li3SiO4)2∶Eu2+ @Al2O3@ODTMS荧光材料随侵入水中时间变化的归一化PL强度;(e)在不同驱动电流下,由蓝色InGaN芯片(λ=455 nm)、窄带绿色荧光材料RbLi(Li3SiO4)2∶Eu2+@Al2O3@ODTMS和商用红色荧光材料KSF∶Mn4+组装的白色LED器件的发射光谱;(f)pc-wLED器件在环境大气中暴露时随时间变化的归一化发光效率[47]。
6 总结与展望
本文以UCr4C4的结构为主,分类介绍了UCr4C4-型氮化物、氮氧化物及氧化物窄带荧光材料的结构、发光性能及其应用。UCr4C4化合物的结构是通过四面体的边角共享相互连接,并形成致密度κ=1的刚性网络结构,其阳离子M/Me容纳在高度对称的网络通道内。高致密性的刚性网络和高度对称的阳离子位点使荧光材料产生具有卓越性能的窄带发射。UCr4C4基红绿蓝窄带发射荧光材料改善了pc-wLEDs的色域,拓宽了pc-wLEDs的应用前景。但是,UCr4C4基窄带荧光材料目前仍然存在一些问题和挑战:
(1)UCr4C4基窄带荧光材料在高湿度环境下不稳定,这极大地影响了荧光材料的应用。目前无机保护层、有机聚合物等是荧光材料优异的防潮涂料,但通常会降低荧光材料的发光效率;另一方面,我们设想通过反向阳离子交换策略构造复合结构,在保持样品发光强度不下降的前提下提高发光材料的化学稳定性,进一步改善荧光材料的应用性能。
(2)在实际应用中荧光材料的热稳定是非常重要的,而氮化物窄带荧光材料的热稳定性普遍较低。目前,虽然通过能量传递的方式对其进行了改善,但仍有改善的空间,如通过阴离子修饰调节基质的结构刚度或通过阳离子取代调节基质的缺陷来提高荧光材料的热稳定性能,但是找到一种有效的方法还有待进一步研究。

