嗜冷黄杆菌及细菌性冷水病的研究进展
柴静茹,王荻,卢彤岩,曹永生,刘红柏,李绍戊*
(1.中国水产科学研究院黑龙江水产研究所,黑龙江 哈尔滨 150070; 2. 黑龙江省水生动物病害与免疫重点实验室, 黑龙江 哈尔滨 150070; 3.上海海洋大学 水产科学国家级实验教学示范中心,上海 201306)
嗜冷黄杆菌Flavobacteriumpsychrophilum是一种革兰氏阴性菌,该菌主要感染鲑科鱼类并引起细菌性冷水病(Bacterial cold water disease, BCWD)或虹鳟鱼苗综合征(Rainbow trout fry syndrome, RTFS)。自1948年从北美银鲑Oncorhynchuskisutch体内分离到嗜冷黄杆菌以来,研究者已在欧洲、南美、亚洲、澳大利亚等世界各地的集约化鲑鳟鱼主养区分离到该菌,可见其流行和传播范围之广[1]。嗜冷黄杆菌分致病性和非致病性菌株,主要感染鲑科鱼类,也可感染非鲑科鱼类[2]。病可导致鲑科幼鱼高死亡率,并对全球鲑鳟鱼养殖业造成严重经济损失。由于对嗜冷黄杆菌的流行规律和致病机制尚不清晰,严重制约了对BCWD防控技术的研发。目前,国外学者对嗜冷黄杆菌的研究已经取得一些进展,本研究中回顾和总结了对该菌的研究现状,以期为国内BCWD的防控提供科学参考。
1 嗜冷黄杆菌分类地位
1946年,Davis[3]首次观察到从虹鳟尾柄部深度溃疡处刮下的大量不运动的细菌棒,命名为嗜冷嗜纤维菌Cytophagapsychrophila[4-5]。此后几十年间,嗜冷黄杆菌的分类地位几经变化,1969年,Lewin[6]建议将其命名为橙屈桡杆菌Flexibacteraurantiacus;1989年,Bernardet等[7]认为,该物种应该重新分类并更名为嗜冷屈桡杆菌Flexibacterpsychrophilus;1996年,Bernardet 等[8]根据DNA-rRNA 原位杂交试验数据、脂肪酸甲基酯(fatty acid methyl ester,FAME)分析结果,将该菌归至黄杆菌属,正式命名为“嗜冷黄杆菌”。
2 嗜冷黄杆菌生物学性状
2.1 形态特征
嗜冷黄杆菌是一种革兰氏阴性、弱折射性、柔韧且具有圆形末端的细长杆状细菌[9-10],其会发生滑动运动,但受营养物浓度的强烈影响[9,11]。此外,不同来源的分离株在运动程度、培养时间、大小等特性上均有较大差异[12-13]。该菌在Cytophaga琼脂上孵育2~3 d后呈浅黄色,直径为2~3 mm,菌落形成一个特征性的煎蛋外观,中心略微凸起,有轻微的蔓延,边缘不规则[2]。显微镜观察可见,该菌直径0.7~1.5 μm,长度1.5~100 μm[9,11,14]。
2.2 培养特性
嗜冷黄杆菌在4~23 ℃下培养可以增殖,最佳培养温度为15~18 ℃[10-11]。该菌耐受的高温范围为40~50 ℃,部分菌株在30 ℃下可存活超过60 min[15]。嗜冷黄杆菌可在浓度为0.5%~0.8%的NaCl中生长,细菌耐受盐度为60~120,可存活15 min[9,15-16]。嗜冷黄杆菌通常在脑心浸液琼脂培养基、胰蛋白酶大豆琼脂培养基、三糖铁琼脂培养基和血琼脂培养基等高营养浓度培养基中不生长或生长不良。嗜冷黄杆菌最初的选择培养基为Cytophaga,配方是0.05%胰蛋白胨、0.05%酵母提取物、0.02%乙酸钠、0.02%牛肉提取物(pH 7.0~7.2)[17]。使用最广泛的培养基是TYES,配方是0.4%胰蛋白胨、0.04%酵母提取物、0.05%硫酸镁、0.05%氯化钙(pH 7.2)[18]。在培养基中添加胎牛血清或糖类,如半乳糖、葡萄糖、鼠李糖和脱脂乳,均能促进嗜冷黄杆菌的生长[19-20]。此外,在培养基中加入5 μg/mL妥布霉素可有效抑制环境病原菌的生长[21]。
目前,主要使用的培养基有胰蛋白酵母提取物培养基(Tryptone yeast extract salts,TYES)[15]、胰蛋白酵母提取物葡萄糖培养基(FLP)[22]和胰蛋白酵母提取物麦芽糖培养基(MAT)[23]。
2.3 生化特性
大多数嗜冷黄杆菌分离株可产生氧化酶和过氧化氢酶,水解明胶和酪蛋白,产生黄色色素(在10% KOH中从黄色变为橙色),降解酪氨酸,并裂解杀死大肠杆菌细胞[2]。所有嗜冷黄杆菌菌株均不能水解淀粉或利用多种碳水化合物,如七叶苷、果胶、几丁质、羧甲基纤维素等。此外,该菌不产生硫化氢、吲哚,不能分解纤维素,不能水解黄嘌呤[9,11]。
2.4 抗原特性
目前,科研人员利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、蛋白质免疫印迹(Western blot)、高效液相色谱法(HPLC)、交叉免疫电泳(CIE )、双向凝胶电泳(2D-PAGE)、液相色谱质谱联用法(LC-MS)、质谱法(MS)、MALDI-TOF质谱法(MALDI-TOF-MS)等技术在嗜冷黄杆菌中鉴定到多种抗原,包括脂多糖LPS、糖蛋白P60、热休克蛋白HSP60/HSP70等(表1),有效提高了嗜冷黄杆菌的诊断和检测效果,保护性抗原的筛选也为疫苗研制提供了重要依据。

表1 嗜冷黄杆菌中已鉴定的多种抗原Tab.1 Identified antigens in Flavobacterium psychrophilum
2.5 血清学特性
血清型鉴定具有高效省时、特异性强、灵敏度高等优点,主要用于确定病原菌的血清型。嗜冷黄杆菌的抗原多样性,使得研究者们提出不同的血清学研究方案。日本学者通过微量滴定凝集试验、载玻片凝集试验和酶联免疫吸附试验,分别在1994年提出O1和O2血清型,1999年增加O3血清型,2003年增加O4血清型[30]。Lorenzen等[31]1997年通过载玻片凝集试验得到FpT、Th(Th-1和Th-2亚型)和Fd共3种血清型。Mata等[32]2002年使用酶联免疫吸附试验双抗夹心法确定了1~7共7种不同血清型。Rochat等[33]2017年报道了使用mPCR确定0~3共4种不同血清型。他们分别从不同的宿主鱼种分离嗜冷黄杆菌观察到血清型和宿主鱼种间存在紧密联系(表2)。嗜冷黄杆菌血清型的多样性有利于未来疫苗开发时选择合适疫苗菌株,同时也有利于国家或地区选择性繁育鲑鳟鱼品系以提高抗病性,有利于渔场或科研工作者进行流行病学监测及对细菌性冷水病的控制。
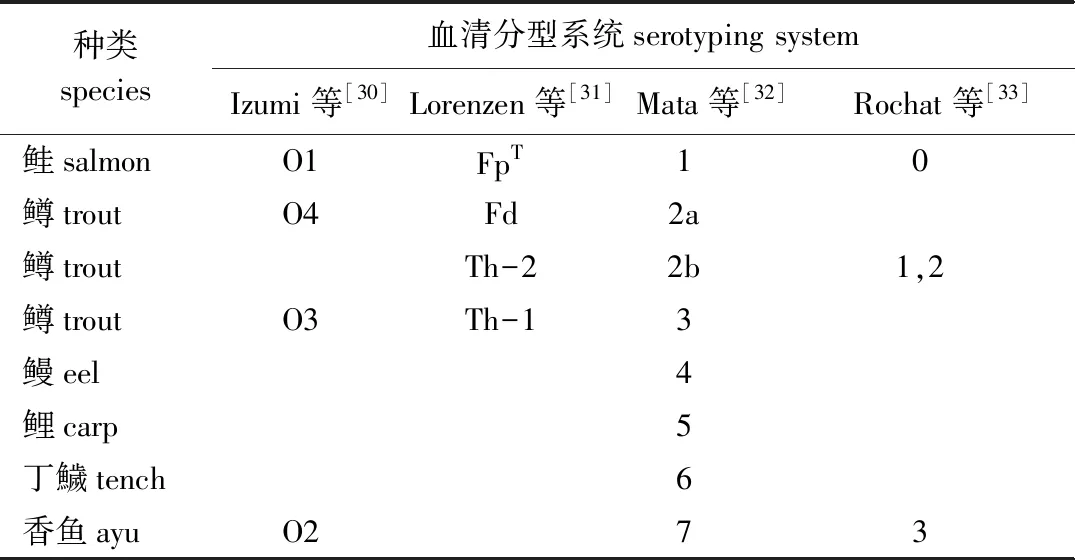
表2 嗜冷黄杆菌血清分型系统及与宿主鱼种的关系Tab.2 Serotyping systems of Flavobacterium psychrophilum and their association with host fish species
3 嗜冷黄杆菌致病性因子
3.1 黏附特性
黏附能力对于病原体成功定殖宿主组织十分重要。黏附分为特异性黏附和非特异性黏附。特异性黏附是通过细菌表面黏附素与宿主细胞表面的特异性受体结合;非特异性黏附取决于细菌表面上的某些结构与支持基质之间的疏水作用或离子相互作用。嗜冷黄杆菌可表达粗糙型和光滑型两种不同的菌落表型,在体外光滑细胞比粗糙细胞更容易黏附于宿主表面[34]。嗜冷黄杆菌光滑细胞的黏附主要是由细胞间的相互作用介导。光滑细胞和粗糙细胞黏附能力的差异可能与嗜冷黄杆菌外膜上不同黏附素的表达或光滑细胞表面的疏水性有关[35]。黏附机制在细菌中具有多样性,在致病性方面具有重要的意义。有报道称,嗜冷黄杆菌对鱼体表面、鳃和卵有较强的黏附性[36]。目前,在嗜冷黄杆菌中尚未观察到与细菌黏附和定植有关的菌毛和鞭毛[31]。
3.2 外毒素
嗜冷黄杆菌的外毒素包括溶血素和胞外蛋白酶。细菌溶血素是一种细胞溶解性毒素,是重要的致病因子。在另一种鱼类病原体鳗弧菌中,毒素VAH5能够裂解虹鳟的红细胞,VAH5的突变体毒力减弱[37],在嗜冷黄杆菌中,由基因FP0063编码的蛋白与VAH5有53%的相似度,该蛋白可能具有类似的致病作用,并与分泌的蛋白酶协同破坏组织[38]。虹鳟鱼苗感染嗜冷黄杆菌后贫血明显,推测其可能是由细菌溶解红细胞和红细胞自凝集导致[39]。部分溶解小牛红细胞和虹鳟红细胞的嗜冷黄杆菌,在添加小牛或鱼血细胞的培养基上生长更好[31]。
胞外蛋白酶是嗜冷黄杆菌重要的毒力因子,可导致组织大量快速损伤。Otis[40]发现,从嗜冷黄杆菌液体培养基中粗提的胞外制剂对虹鳟具有致病性,且其病变发展方式与嗜冷黄杆菌感染相似。弹性蛋白酶是一种能够破坏细胞外基质蛋白组织的细胞外酶,通常被认为是病原体的重要毒力因子。嗜冷黄杆菌中降解弹性蛋白的菌株比不降解弹性蛋白的菌株毒力更强,说明弹性蛋白酶可促进对宿主的侵袭[41]。嗜冷黄杆菌还能凭借胞外蛋白酶裂解其他微生物,如嗜冷黄杆菌NCIMB 1947T能裂解大肠杆菌、嗜水气单胞菌、鲁氏耶尔森氏菌和假单胞菌[31],这也为胞外蛋白酶属于外毒素提供了证据。
3.3 脂多糖
脂多糖(LPS)是革兰氏阴性菌中最具抗炎性的化合物之一,通常由3个区域组成:脂质A的疏水区、非重复的“核心”寡糖和远端多糖即O抗原[42]。嗜冷黄杆菌的LPS由低分子量低聚糖和高分子量O抗原聚合组成,进一步分析嗜冷黄杆菌CSF259-93的O型多糖结构,发现它是一种由三糖重复单元组成的直链聚合物[43]。目前尚不清楚LPS如何协同其他毒力因子发挥作用。
3.4 分泌系统
细菌分泌系统负责将毒素转运至细菌表面,对于细菌毒力具有重要作用。嗜冷黄杆菌基因组中已鉴定出ABC型转运系统、Sec依赖性转运系统和Sec独立(TAT)转运系统[38]。该菌无革兰氏阴性菌中常见的Ⅲ型和Ⅳ型分泌系统,但编码PorT和PorR蛋白[38]。在牙周致病菌牙龈卟啉单胞菌中,PorT蛋白将毒力因子如蛋白酶和黏附素从外周胞质转运至细胞表面,这对毒力产生至关重要[44]。PorR蛋白参与细胞表面多糖的生物合成,可能是毒力因子的靶蛋白[45]。因此,PorT和PorR蛋白产生的作用可能同样适用于嗜冷黄杆菌。
4 细菌性冷水病流行病学特征
4.1 地理分布及宿主范围
嗜冷黄杆菌地理分布广泛,水生动物宿主种类繁多。最初嗜冷黄杆菌的地理分布被认为仅限于北美[46],如今嗜冷黄杆菌感染呈世界性分布,在全球多个国家和地区均分离到该菌,包括丹麦、法国、德国、挪威、西班牙、瑞典、英国、澳大利亚、加拿大、智利、日本、韩国和土耳其等[2]。嗜冷黄杆菌可感染所有鲑科鱼类,如虹鳟、银鲑、大西洋鲑Salmosalar、王鲑Oncorhynchustshawytscha、山鳟Oncorhynchusclarkii、北极红点鲑Salvelinusalpinus、溪鳟Salvelinusfontinalis等,其中,虹鳟和银鲑对嗜冷黄杆菌尤其易感。此外,嗜冷黄杆菌也可感染非鲑科鱼类并形成疾病,如鲤Cyprinuscarpio、鲫Carassiuscarassius、丁鱥Tincatinca、香鱼Plecoglossusaltivelis、鳗Anguillaanguilla和虾虎鱼Chaenogobiusurotaenia等均可成为嗜冷黄杆菌的感染宿主[2]。研究表明,做标记的感染(供体)虹鳟和未感染(受体)虹鳟共处一缸,第7天受体虹鳟死亡,证实嗜冷黄杆菌在虹鳟中能水平传播[47]。在成熟雌性虹鳟排卵前5~9 d腹腔注射嗜冷黄杆菌,发现卵巢液中嗜冷黄杆菌感染严重,证明嗜冷黄杆菌能垂直传播[48]。嗜冷黄杆菌的水平和垂直传播能力加剧了细菌性冷水病的流行发生。
4.2 临床症状与组织病理学
患有BCWD的病鱼早期表现为精神萎靡、食欲不振,鳍尖开始腐烂,可见嗜冷黄杆菌在鳍上附着形成白色区域,严重时可使鳍条分离[2]。其他病征还包括眼球突出、鳃苍白、腹胀和腹水等。在BCWD的晚期病例中,患病鱼尾柄部病灶处肌肉糜烂坏死,严重时尾椎骨外露,在背鳍、鼻颚处及背鳍和头后部间的肌肉组织上可观察到明显病变。组织病理学观察显示,宿主组织广泛出现病变,包括脾、肝和肾的局灶性坏死;空泡变性增多;肾嗜酸性粒细胞增多,含铁血黄素增多;皮肤真皮和皮下外侧肌肉组织出现细胞固缩、坏死和淋巴细胞浸润等。患有慢性BCWD的病鱼表现出螺旋式或不稳定的游泳行为,尾部变黑和脊柱畸形。组织学检查显示,在脊柱和颅骨交界处发生骨膜炎、骨炎、脑膜炎和椎骨骨膜增生[49-50]。
虹鳟鱼苗综合征是由嗜冷黄杆菌引起的另一种疾病表现[51],影响虹鳟的早期生活阶段或囊苗到早期投喂发育阶段。这种急性病可能导致鱼苗50%或更高的死亡率,菌血症与组织病理变化出现同步,包括贫血、白肾和白肝。虹鳟鱼苗综合征的其他特征性病征有昏睡、双侧眼球突出、深色皮肤色素沉着和鳃苍白。
4.3 嗜冷黄杆菌的检测方法
通常用琼脂平板培养法从环境样品中分离嗜冷黄杆菌,此外,还有其他能提高速度、灵敏度和精确度的检测和鉴定方法,如凝集试验、免疫荧光抗体技术(FAT)、酶联免疫吸附试验(ELISA)、环介导的等温扩增(LAMP)、聚合酶链反应(PCR)和巢式PCR[52]等,各种方法的优缺点见表3。
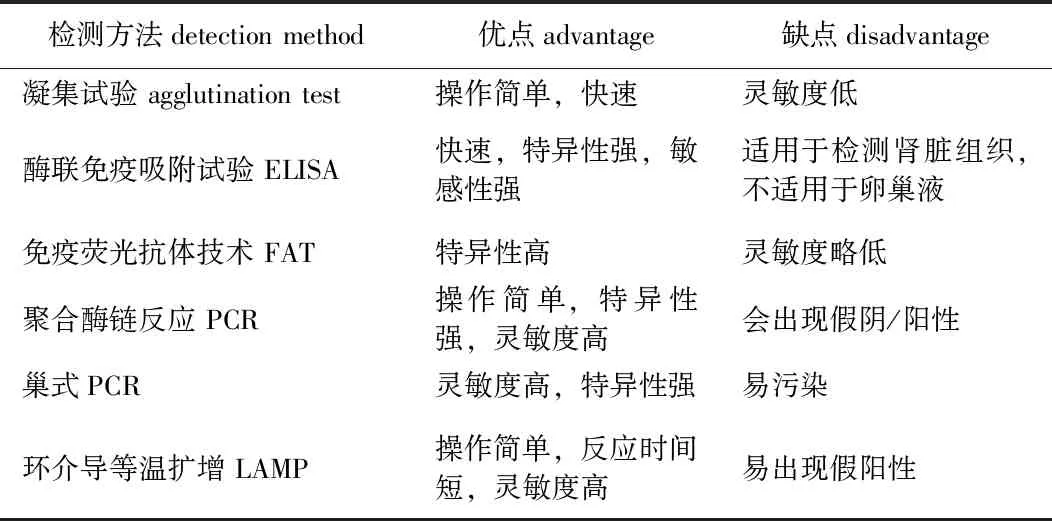
表3 嗜冷黄杆菌的检测方法及优缺点Tab.3 Advantages and disadvantages of the detection methods for Flavobacterium psychrophilum
5 细菌性冷水病的预防与控制
5.1 预防
疫苗是预防BCWD的重要和有效手段。迄今为止,已报道的BCWD疫苗包括亚单位疫苗、灭活疫苗、减毒疫苗,但大多疫苗均处于实验室验证水平,并未投入商业化市场。在过去几十年中,人们多次尝试开发用于预防BCWD的商业疫苗。有研究发现,利用特异性抗原制备的亚单位疫苗对鱼类进行免疫接种,如给虹鳟腹腔注射高浓度OmpH样蛋白,无论是否存在弗氏完全佐剂,均可诱导鱼类产生显著的保护性免疫,存在和不存在弗氏完全佐剂的相对保护率分别为88.5%和54.1%。这种保护是对嗜冷黄杆菌OmpH样蛋白产生较高滴度抗体的结果,该蛋白也具有抗菌活性[28]。细菌全细胞灭活疫苗由于其安全性和有效性,是最常用的诱导免疫的方法,在不引起细胞裂解的情况下获得灭活细胞有不同的方法,如使用福尔马林或热失活。Fredriksen等[53]用福尔马林灭活嗜冷黄杆菌后制成油包水型疫苗,使用高毒力嗜冷黄杆菌菌株灭活全菌疫苗肌肉注射,再用嗜冷黄杆菌感染鱼,结果证明具有良好的保护作用。减毒疫苗是通过人工诱变获得的弱毒株。lvarez 等[54]获得了减毒的嗜冷黄杆菌突变体,其中ExbD2蛋白的基因编码被破坏,该蛋白为TonB复合物的一部分,参与铁摄取,给虹鳟肌肉注射该突变体,然后用毒性嗜冷黄杆菌进行攻毒试验,结果表明,虹鳟鱼苗具有显著的免疫保护性。LaFrentz等[55]发现了一种高度减毒的利福平抗性嗜冷黄杆菌菌株259-93B.17,经过该菌株浸泡免疫的鱼在免疫后10周产生了免疫保护性。此外,Fd和Th血清型间的交叉保护已被证实,表明这两种血清型可能共享一些主要抗原。
亚单位疫苗具有抗原组分单一、纯度高、免疫反应强的优点,但其成本较高。灭活疫苗安全有效,但产生免疫保护所需时间长。减毒疫苗可长期刺激免疫系统,但有毒力复壮的风险,且对贮存、运输要求条件较高,如需要冷链等。
5.2 控制
面对鱼类传染病,最好的管理策略就是将病原体引入或传播的风险降至最低,这样才能明显降低疾病暴发。保持优良水质,减少水体中有机物质和亚硝酸盐,降低饲养密度和消毒杀菌等措施,可以较好地预防疾病发生[56]。
使用抗生素是治疗BCWD的首选方法,然而嗜冷黄杆菌对抗生素的耐药性是一个严重的问题。如嗜冷黄杆菌智利分离株对阿莫西林、氟苯尼考敏感,而对恶喹酸、氟甲喹、恩诺沙星和土霉素等耐药[57];美国密歇根州五大湖分离株中24%的菌株对土霉素耐药,所有分离株对氟苯尼考、恶喹酸、氟甲喹、恩诺沙星、红霉素等敏感[58];英国分离株对氟苯尼考、恶喹酸、土霉素、红霉素敏感,而对氟甲喹、恩诺沙星耐药[59]。目前美国FDA批准在水产养殖中使用的抗生素有土霉素和氟苯尼考,而英国兽医药品管理局批准氟苯尼考、土霉素和阿莫西林用于水产养殖[58-59]。由于国内无嗜冷黄杆菌分离鉴定的相关报道,其分离株的耐药谱尚不清楚,对临床抗菌药物的选择缺乏数据支撑,因此,在药物使用上存在一定盲目性。
6 存在问题及展望
嗜冷黄杆菌是一种重要的鱼类细菌性病原,由该菌感染引起的BCWD严重制约着水产养殖业的健康发展。虽然国外学者已进行了诸多工作并取得了丰富的科学数据,但由于嗜冷黄杆菌不同分离株在基因型、血清型、致病性、耐药性和宿主特异性上差异极大,且国内未有相关系统报道,导致对中国嗜冷黄杆菌的流行情况、病原特性、致病机制和防控方法尚不清晰,无法制定有效的防控措施。鉴于此,国内需加强以下几方面的研究:
(1)系统开展国内流行株的生物学特性、致病性、流行特性、耐药性、宿主特异性等相关研究,建立病原菌库及分子数据库,补充基础数据。
(2)重视和加强疫病检验检疫,建立检验标准,最大程度地减少或避免病原的水平及垂直传播。
(3)为了更好防控该病,亟待开展嗜冷黄杆菌与宿主互作机制研究,并加快疫苗研发进程,结合抗病选育等手段,实现BCWD的综合防控,保障水产养殖业的绿色健康可持续发展。

