大黄素对建鲤生长性能、抗氧化指标及肝脏CYP450酶的影响
曹丽萍, 杜金梁, 贾睿,丁炜东,Jeney Galina,徐跑,殷国俊*
(1.农业农村部淡水渔业和种质资源利用重点实验室,江苏 无锡 214081; 2.中国水产科学研究院淡水渔业研究中心 农业农村部鱼类免疫药理学国际联合实验室,江苏 无锡 214081; 3.Research Institute for Fisheries,Aquaculture and Irrigation,Ann light 8,Szarvas H-4440,Hungary)
近年来,水产养殖业迅速发展,然而高养殖密度,高蛋白、高脂肪饲料的频繁使用,抗病药物的滥用等使得养殖环境日益恶化,鱼类病害较为严重[1]。肝脏作为鱼体最大的代谢器官,在鱼类消化、排泄、解毒及免疫等多种生命活动中发挥重要作用,但其易受到各种毒物、病原累及[2-3],导致肝组织受损,进而引起代谢紊乱诱发细菌和病毒感染,甚至导致鱼类死亡,给养殖业造成重大损失。大量研究发现,许多中草药及其提取物都具有显著的保肝作用[4],其作用机理显示主要与中药的清除氧自由基、抗氧化、抑制细胞色素P450酶系CYP450[5-6]及抑制NF-κB活性有关[7]。CYP450酶分布于多种组织和器官中,其中肝脏中含量最为丰富,可参与体内外多种化合物代谢,在肝损伤发生过程中起到了十分重要的作用。研究证明,在经典的CCl4诱导肝损伤模型中,CCl4通过CYP450作用代谢为三氯甲烷自由基(CCl3·)进而引起膜脂质过氧化,这是造成肝损伤的一个重要原因[8]。
大黄素(emodin, EMD),作为虎杖、大黄等传统中药的有效单体成分,在临床和生产上被广泛应用。大黄素具有显著的抗炎、抗肿瘤、抗肝纤维化作用[9]。大黄素的肝保护作用主要与抑制肝脏炎症、抑制肝星形细胞的增殖活化及调节促纤维化因子表达等方面有关[10]。目前,大黄素对鱼类肝损伤的保护作用及机理研究尚未见报道,为了阐明大黄素在鱼类上的保肝作用,本研究中以CCl4诱导建鲤CyprinuscarpioJian肝损伤,并建立在体肝损伤模型,探讨大黄素的肝保护作用及对肝细胞色素酶的影响,以期为保肝药物开发提供科学依据。
1 材料与方法
1.1 材料
试验用建鲤由中国水产科学研究院淡水渔业研究中心渔场提供,健康无伤,规格齐整,饲养于循环水系统中(每个缸体积为240 L),饲养条件温度为(27±2)℃,pH为6.8~7.6,DO>5 mg/L,总氨氮<0.05 mg/L,H2S<0.01 mg/L。每天投喂量为鱼体质量的2%,驯养1周。
药品与试剂:CCl4(分析纯)购于国药集团化学试剂有限公司,配制成30%的CCl4-橄榄油溶液(CCl4∶橄榄油=3∶7);大黄素标准品购自美国SIGMA公司(St.Louis,Missourk, USA);DPPH(1,1-二苯基-2-三硝基苯肼)购于上海严谨科技有限公司;考马斯亮蓝试剂、谷丙转氨酶(GPT)、谷草转氨酶(GOT)、乳酸脱氢酶(LDH)、白蛋白(Alb)、总蛋白(TP)、超氧化物歧化酶 (SOD)、谷胱甘肽过氧化物酶(GSH-Px)、还原型谷胱甘肽(GSH)、总抗氧化能力(T-AOC)和丙二醛(MDA)含量测定试剂盒购自南京建成生物工程研究所。
1.2 方法
1.2.1 试验饲料的制备 基础饲料包括面粉17.4%、鱼粉6.0%、菜籽粕27.0%、米糠粕10.0%、棉籽粕10.0%、豆粕24.0%、磷脂1.0%、豆油1.0%、磷酸二氢钙1.5%、氯化胆碱0.1%、维生素预混料1.0%、矿物质预混料1.0%。在基础饲料中分别添加0.1%、0.3%、0.5%的大黄素,同时减少等量面粉,配制成3种试验饲料,试验饲料营养水平见表1。

表1 饲料组成及营养水平Tab.1 Ingredients and nutrient levels of experimental diets w/%
1.2.2 试验设计及饲养管理 将初始体质量为150 g左右的健康建鲤随机分为5组,每组20尾,分别为空白对照组、模型对照组(CCl4)、低剂量药物组(1 g/kg EMD)、中剂量药物组(3 g/kg EMD)和高剂量药物组(5 g/kg EMD),每组设2个平行,每个平行10尾,放在10个缸中饲养。其中,空白和模型组均投喂基础饲料,低、中、高剂量药物组分别投喂含1、3、5 g/kg大黄素的试验饲料。每天投喂2次,记录投喂饵料量,每次投喂量为鱼体质量的2%,共养殖60 d。养殖试验结束后,给空白组鱼腹腔注射等量橄榄油, CCl4组和中药组腹腔注射30%的CCl4, 注射剂量为0.05 mL/10 g鱼体,禁食72 h,以诱导肝损伤。整个养殖及试验过程中建鲤死亡率为0。
用MS-222麻醉鱼后,对各组鱼称重、采集血液与肝组织,每组20个样品均进行测定。
1.2.3 大黄素抗氧化活性分析 采用DPPH法测定药物的抗氧化能力[11]。将DPPH用无水乙醇充分溶解后,配制成浓度为2×10-4mol/L的溶液。将大黄素配制成0、1、2、3、4、5、6 μg/mL水溶液。取2 mL DPPH乙醇溶液,加入2 mL不同浓度的大黄素溶液,混匀后避光静置30 min,在517 nm下测定每个大黄素溶液的吸光值。DPPH的抑制率与清除自由基的能力成正比,其计算公式为
抑制率=(A1-A2)/A×100%。
(1)
其中:A为2 mL DPHH溶液与2 mL无水乙醇混合后在517 nm处的吸光度;A1为2 mL DPHH溶液与2 mL大黄素溶液混合后在517 nm处的吸光度;A2为2 mL 大黄素溶液与2 mL无水乙醇混合后在517 nm处的吸光度。
1.2.4 生长指标的测定与计算 饲养试验结束后,计算出每组鱼的相对增重率(RWR,%)、特定生长率(SGR,%/d)、饵料系数(FCR)和肝指数(LI,%),计算公式为
RWR=(Wt-W0)/W0×100%,
(2)
SGR=(lnWt-lnW0)/t×100%,
(3)
FCR=F/(Wt-W0),
(4)
LI=WL/Wt×100%。
(5)
其中:Wt、W0分别为试验终末和初始鱼的体质量(g);t为饲喂时间(d);F为投喂饲料量(g);WL为肝脏质量(g)。
1.2.5 血清和肝组织生化指标的测定 用CCl4注射建鲤72 h后,采用一次性注射器,从试验鱼尾静脉采血,血样于4 ℃下静置2 h后以3000 r/min离心15 min,分离血清,于-20 ℃下保存备用。按照试剂盒操作说明分别测定血清中相关生化指标。
对采血后的鱼进行解剖,在肝脏右中叶相同部位取肝脏组织,用预冷的生理盐水漂洗血液,剪去肝脏表面附着的结缔组织,再用滤纸吸去表面水分后称重并剪碎,移入匀浆管中,加入9 倍体积的生理盐水 (体积分数为0.86%) 进行匀浆。该匀浆以2000 r/min 离心15 min,收集上清备用。按照试剂盒操作说明分别测定肝匀浆中各项生化指标。
1.2.6 肝微粒体中CYP450酶含量的测定 采用差速离心法获取建鲤肝微粒体[12]。建鲤采净血液后迅速取出肝脏,用滤纸吸净表面水分后称重并剪碎,用KCl-磷酸缓冲液(0.1 mol/L,pH 7.4)漂洗3次,洗净血水。每克肝脏加入3 mL 的KCl-磷酸缓冲液,在冰上制备匀浆。肝匀浆于4 ℃下以10 000 r/min离心20 min,弃沉淀。上清液再于4 ℃下以25 000 r/min离心30 min,弃上清,沉淀部分即为肝微粒体。向肝微粒体中加入含30%甘油的KCl-Tris-HCl 缓冲液(0.1 mol/L,pH 7.4),吹打悬浮后分装于超低温冰箱(-80 ℃)中保存。肝微粒蛋白浓度采用考马斯亮蓝法测定[13]。
取0.5 mL肝微粒体悬液(0.5 g/L)与适量连二亚硫酸钠混合,平均分成两份,加入比色杯中并用一氧化碳充气约30 s。在450 nm和490 nm处测定样品吸光度,计算CYP450含量[14]:
CYP450含量(nmol/mg)=(A450 nm-A490 nm)×1000 /[91×蛋白浓度(g/L)]。
(6)
1.2.7 肝组织中CYP1A、CYP3AmRNA的表达检测 将建鲤处死后,迅速获取适量肝组织置于液氮中储存。按照RNAiso Reagent试剂盒操作抽提总RNA。用紫外分光光度计测定RNA的浓度及纯度, 当A260 nm/A280 nm值达到1.8~2.0 时可以进行反转录,以Oligo (dT)18为引物进行RT反应合成cDNA。实时荧光定量PCR反应按照TaKaRa 公司生产的ExScriptTMRT-PCR Kit (Perfect Real Time: SYBR Green I) 进行。基因特异引物及内参β-actin引物分别按照建鲤CYP1A、CYP3A和β-actin基因序列采用Primer 5.0软件设计。用2ΔΔCT法对目的基因表达进行相对定量分析[15]。引物如下:
CYP1A-F: 5′TGACAAGGACAACATCCGAGAC 3′,
CYP1A-R: 5′ATAGACGACAGCCCAAGACAGAG 3′;
CYP3A-F: 5′CACCGCTTTATTTCCTTTCATC 3′,
CYP3A-R: 5′CTCGCTTCTTCTTGTGGCCT 3′;
β-actin-F: 5′GTCAAGTCCGTTGAGATGCACC 3′,
β-actin-R: 5′GGATGATGACCTGAGCATTGAAGC 3′。
1.3 数据处理
试验数据以平均值±标准差(mean±S.D.)表示,采用SPSS 15软件进行单因素方差分析(One way-ANOVA),用Duncan法进行组间多重比较,显著性水平设为0.05。
2 结果与分析
2.1 大黄素清除自由基的能力
从图1可见:大黄素浓度较低时,清除DPHH能力近似线性关系,大黄素浓度为3 μg/mL时,其清除能力达到65%;随着大黄素浓度的增加,大黄素清除DPPH自由基的能力渐趋平缓,大黄素浓度为6 μg/mL时,其清除自由基能力达到81%。
2.2 建鲤生长指标的变化
试验组饲喂不同浓度的大黄素饲料60 d,在注射CCl4造模前,对建鲤生长指标进行了测定。从表2可见:与空白对照组相比,饲喂含3、5 g/kg大黄素饲料能显著提高建鲤的终体质量、相对增重率和特定生长率(P<0.05),显著降低饵料系数(P<0.05),且这种影响随着大黄素含量的升高,效果愈加明显;模型组与空白组均饲喂基础饲料,两组建鲤生长指标无显著性差异(P>0.05)。

表2 大黄素对建鲤生长指标的影响Tab.2 Effects of EMD on growth index of common carp
2.3 建鲤血清中生化指标的变化
从表3可见: CCl4作用建鲤72 h 后,与空白对照组相比,模型组血清中的GOT、GPT 和LDH 活性均显著升高(P<0.05),Alb和TP含量显著下降(P<0.05); 而3、5 g/kg大黄素能显著抑制CCl4诱导GOT水平升高,5 g/kg大黄素能显著抑制CCl4诱导GPT 和LDH水平的升高(P<0.05),同时也能显著恢复血清中Alb和TP含量(除1 g/kg大黄素组外)(P<0.05),且随着用药剂量的提高,其作用愈加明显。
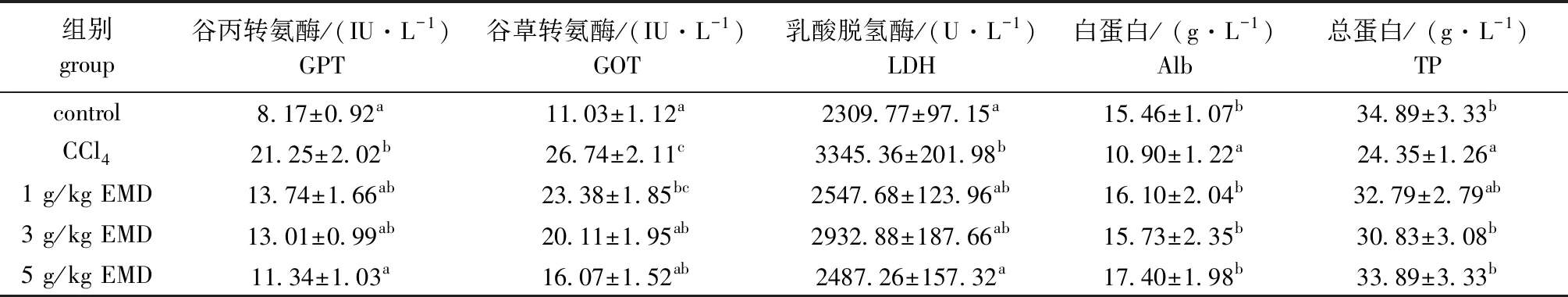
表3 大黄素对建鲤血清生化指标的影响Tab.3 Effects of EMD on biochemical indices in serum of common carp
2.4 肝组织中抗氧化指标、肝微粒体中CYP450酶及肝指数的变化
从表4可见:CCl4作用建鲤72 h后,与空白对照组相比,模型组肝组织中T-AOC和SOD活性均显著下降(P<0.05),GSH-Px和GSH消耗明显,MDA大量生成(P<0.05);3、5 g/kg大黄素能显著防止肝组织中T-AOC、SOD、GSH-Px及GSH水平下降并显著抑制MDA生成(P<0.05),且随着大黄素剂量升高,其作用愈加显著。
从表4还可见:CCl4作用建鲤72 h后,与空白对照组相比,模型组肝微粒体中CYP450酶含量显著增加(P<0.05),表明CCl4对CYP450酶有诱导作用,而3、5 g/kg大黄素饲料组建鲤肝微粒体中CYP450酶含量显著降低(P<0.05),这表明大黄素能抑制CCl4对CYP450酶的诱导,且中、高剂量大黄素抑制效果优于低剂量,即大黄素对CYP450酶的抑制作用有剂量依赖性;同时,CCl4诱导建鲤肝损伤后,引起肝组织肿大,CCl4组建鲤肝指数较空白对照组显著增大(P<0.05),而3、5 g/kg大黄素能显著抑制CCl4导致的建鲤肝组织肿大,肝指数明显降低,且随着大黄素剂量的升高,恢复效果愈加显著(P<0.05)。

表4 大黄素对建鲤肝组织中抗氧化指标和肝微粒体中CYP450酶含量及肝指数的影响Tab.4 Effects of EMD on antioxidant ability in the liver, and CYP450 enzyme content in liver microsomes and hepato-somatic index of common carp
2.5 肝组织中CYP3A、CYP1A基因表达量的变化
从图2可见:CCl4腹腔注射建鲤72 h后,模型组肝组织中CYP3A和CYP1A的mRNA表达量较空白对照组显著升高(P<0.05);与模型组相比,大黄素能显著抑制CCl4诱导的CYP3A(除1 g/kg大黄素组外)和CYP1A表达量的上调(P<0.05),且随着大黄素剂量的升高,抑制作用愈加显著。
3 讨论
3.1 大黄素对建鲤生长的影响
随着水产养殖业的发展,绿色养殖、健康养殖在生产过程中越来越重要。中草药作为天然药物,具有资源丰富、污染少及毒副作用小的优点,其作为饲料添加剂被广泛应用于动物的养殖[16]。杨维维等[17]在探讨大黄素对克氏螯虾生长的影响时发现,饲料中添加50~75 mg/kg的大黄素,可显著提高克氏螯虾的成活率,降低饵料系数。明建华等[18]发现,饲料中添加大黄素可显著提高团头鲂的增重率和特定生长率,降低死亡率及饵料系数。本研究中也得到了一致的结果,饲料中添加大黄素后,建鲤的终体质量、相对增重率和特定生长率得到了显著提高,而饵料系数显著下降,这表明饲料中添加大黄素可帮助建鲤消化吸收、促进其进食,从而加速鱼体的生长,提高饵料的利用效率。
3.2 大黄素对建鲤肝功能指标的影响
作为经典的诱导动物肝损伤模型的毒物CCl4,其肝损伤机制主要与自身和其自由基代谢产物有关。CCl4经肝微粒体CYP450酶活化分解产生三氯甲烷自由基( CCl3·),引起肝细胞膜和细胞器膜脂质过氧化,从而改变了膜的流动性和通透性,最终导致肝细胞受损,此过程目前被认为是主要的肝损伤机制[19]。本研究中将30%的CCl4-橄榄油溶液腹腔注射建鲤72 h后,血清中GOT、GPT和LDH活性上升,证明CCl4改变了肝细胞膜的通透性,导致了胞浆内可溶性酶的溶出;同时肝细胞受损后,其合成白蛋白的能力降低,导致白蛋白和总蛋白含量下降。而5 g/kg的大黄素可显著抑制CCl4诱导的酶含量上升,表明大黄素可以抵抗磷脂氧化,稳定细胞膜。展玉涛等[20]利用CCl4制备大鼠肝纤维化模型研究了大黄素对肝功能的影响,结果也发现,大黄素能明显抑制CCl4诱导的血清GOT水平的提高,恢复白蛋白和总蛋白含量。
大量研究表明,大黄素具有理想的抗氧化作用。Yen等[21]研究蒽醌和蒽酮的抗氧化活性时发现,大黄素和芦荟大黄素具有较强的还原活性和清除羟基自由基的作用,在0.25 mg/mL浓度下的清除率分别达到26.2%和41.8%,表明其抗氧化机制可能依赖于清除羟自由基。罗霄山[22]发现,原代培养大鼠肝细胞在芦荟大黄素预培后,CCl4导致的肝组织中GSH损耗及MDA生成得到了明显的抑制。杨维维等[17]的研究也表明,饲料中添加大黄素能显著提高克氏螯虾的肝脏抗氧化能力,肝组织中GSH、SOD含量均显著上升。本研究中利用DPHH法测定大黄素清除自由基能力,发现大黄素为6 μg/mL时,清除自由基能力达到了81%;建鲤饲喂大黄素2个月后,能显著抵抗CCl4导致的肝大,肝指数显著降低,生长性能得到显著提高,能明显抑制CCl4导致的肝组织匀浆中的SOD、GSH-Px及GSH含量的损耗,且显著抑制脂质过氧化代谢产物MDA的大量生成,T-AOC水平得到显著提高,这些结果与其他学者的研究结论一致。大黄素对CCl4诱导的建鲤肝损伤的保护作用应与其抗氧化能力有关。
3.3 大黄素对建鲤肝微粒体中CYP450酶的影响
CYP450酶系作为机体的生物转化系统,可以广泛的代谢体内外源性物质[23]。CCl4在体内进行代谢活化的过程中,CYP450酶系发挥了关键作用,Shibata等[24]研究表明,肝组织中CYP2E1基因与CCl4诱导的肝损伤关系密切,Zhou等[25]研究认为,CYP1A1、CYP1A2及CYP3A4等代谢在CCl4的生物转化过程中同样具有重要作用。鱼类CYP1A基因在1988年被克隆后,发现其能被外源性化合物诱导且表现出剂量依赖效应[26],苯并芘、多环芳烃、二噁英等农药都是CYP1A的诱导剂[27],这种诱导作用使得CYP1A成为检测水体污染的指标之一。CYP3A在肝脏和小肠中含量丰富,分别约占CYP总量的30%和70%,是参与临床常用药物氧化代谢的主要酶系,是CYP家族中最重要的亚族成员[28]。研究CYP1A和CYP3A在CCl4代谢过程中的变化对剖析CCl4的损伤机理、防护及药物的选择都有指导意义[29]。 郑天慧等[30]在比较3种化学品导致的急性肝损伤大鼠模型中CYP450酶的变化时发现,CCl4能抑制大鼠CYP1A2和CYP3A4活性。而刘移民等[31]研究发现,CCl4对人体淋巴细胞瘤细胞株中CYP2E1和CYP3A4基因有明显的诱导作用,且表现出剂量效应关系。沈俊辉等[32]研究发现,CCl4对大鼠肝组织中CYP3A表达显著上调。由此可见,目前CYP450酶各亚族在CCl4诱导的肝损伤过程中含量变化表现并不统一,但与CCl4作用时间和剂量有关联[33]。本研究中CCl4作用建鲤72 h后,模型组肝微粒体中CYP450酶含量显著增加,肝组织中CYP1A、CYP3AmRNA表达量也显著上调。这表明CCl4可以通过诱导CYP450酶活性及CYP1A和CYP3A的表达,进一步促进CCl4人代谢,使得毒性产物累积,导致建鲤肝组织的损伤。本研究中采用大黄素饲喂建鲤60 d后,大黄素能显著降低肝组织CYP450酶含量,且表现出剂量效应。这表明大黄素对肝组织的保护作用与抑制CCl4对CYP450酶的诱导有关。
综上所述,大黄素对CCl4诱导的建鲤肝损伤具有保护作用且存在剂量效应。可能与其强大的抗氧化能力及抑制CCl4对CYP450酶的诱导有关。

