siRNA下调AEG-1对大肠癌细胞体内成瘤影响的研究
黄素军 宋华锋 杨绮红 黎铭恩 罗国彪
【关键词】星形胶质细胞升高基因-1;小干扰核糖核酸;结直肠癌;体内成瘤
结直肠癌是威胁全球人类健康的最常见的恶性肿瘤之一。据统计,2017年全球结直肠癌新发病例约为183万例,中国大陆地区新发病例约为43万例,我国发病数在28年间增长了203.5%,已跃居我国恶性肿瘤的第4位[1]。
星形胶质细胞升高基因-1(AEG-1)是2005年Kang等[2]采用快速消减杂交的方法首次克隆出来的癌基因,位于人染色体8q22,该区域是多种恶性肿瘤高度相关地带。AEG-1在人体多种恶性肿瘤中的表达升高,在肿瘤发生中发挥着关键的致癌作用。AEG-1在结直肠癌中的蛋白表达水平明显升高,而且在正常黏膜、低级别腺瘤、高级别腺瘤和大肠癌中的表达依次升高[3-4]。
我们既往的研究显示AEG-1在结直肠癌细胞株HCT116中高表达,且在体外研究发现下调AEG-1表达会抑制结肠癌细胞增殖、克隆形成和侵袭能力,促进凋亡,增加对5-氟尿嘧啶(5-FU)的敏感性,但体内实验是否会有肯定的结果尚待进一步研究[5-6]。为此,我们通过慢病毒介导的小干扰RNA(siRNA)技术干扰AEG-1表达构建结直肠癌稳定细胞株后进行裸鼠成瘤实验。
材料与方法
一、材料及主要试剂
采用AEG-1siRNA病毒载体,含绿色荧光蛋白(GFP)基因(psPAX,pMD2.G慢病毒包装系统,Invitrogen公司);結肠癌HCT116细胞株(购自中国模式培养物集库存,中国北京);免疫缺陷小鼠(购自中山大学实验动物中心)。Trizol试剂(Invitrogen公司);RevertAidFirstStrandcDNASynthesisKit(#K1621,#1622,Fermentas公司)、SYBRPremixExTaqII(TliRNaseHPlus)(DRR820)购自TaKaRa公司;RIPA细胞裂解液和蛋白酶抑制剂(PMSF,广州博彩生物公司);NovexECL发光试剂盒(WP20005,Invitrogen公司);兔抗人AEG-1抗体;兔抗人GAPDH抗体(Invitrogen公司)。
二、方法
1. 慢病毒介导干扰AEG-1-siRNA稳定细胞株构建
采用化学合成方法合成以AEG-1为靶点的RNA干扰序列(AEG-1-RNAi1,s:GCAGCAAGGCAGTCTTTAAGT,as:ACTTAAAGACTGCCTTGCTGC),挑选了带GFP报告基因的慢病毒载体(RNAil组)和空载体(空载组),采用psPAX,pMD2.G慢病毒包装系统,转染成功后收取上清(病毒液),病毒感染结肠癌细胞株HCT116(HCT116对照组),转染48h后,采用0.5μg/ml嘌呤霉素的10%胎牛血清DMEM培养基筛选出阳性细胞。
2. 实时荧光定量PCR(qRT-PCR)检测AEG-1mRNA的表达
采用Trizol试剂提取细胞的总RNA,以OligodT为引物逆转录成cDNA,逆转录条件为:65℃5min,42℃60min,70℃5min。在ABIPRISM7500qRT-PCR仪上按照两步法进行扩增,使用β-actin作为内参,计算△CT值(△CT=CT目的-CT内参)和2﹣△CT。
3. 蛋白质印迹法检测AEG-1蛋白表达
采用RIPA裂解细胞,收集上清,定量,取50μg总蛋白进行SDS-PAGE电泳,采用PVDF膜转膜,5%脱脂奶粉室温下封闭1h后,分别加入兔抗人AEG-1抗体(Invitrogen)1∶1000和兔抗人GAPDH抗体1∶1000,4℃过夜,TBST洗涤,加入相对应的二抗,室温孵育1h,TBST洗涤,ECL显色试剂盒显影,以GAPDH为内参。
4. 裸鼠体内成瘤试验
将14只裸鼠随机分成2组即HCT116-control组和HCT116-RNAi1组,分别采用转染前后细胞株接种,将浓度为1×106个/ml的细胞悬液注射到裸鼠背部,每只0.2ml,同样条件下饲养,每周测量接种部位瘤体的最长直径a(mm)和最短直径b(mm),瘤体体积=a×b2/2(mm3)。4周后处死小鼠取出瘤体测量质量。
三、统计学处理
采用SPSS13.0进行统计分析。正态分布数据以表示,2组间比较采用t检验或者t'检验,重复测量资料采用重复测量资料方差分析,交互效应有意义时采用t检验分析单独效应,α=0.05,两两比较采用Bonferroni法校正检验水准。
结果
一、成功构建AEG-1-RNAi结直肠癌稳定细胞株
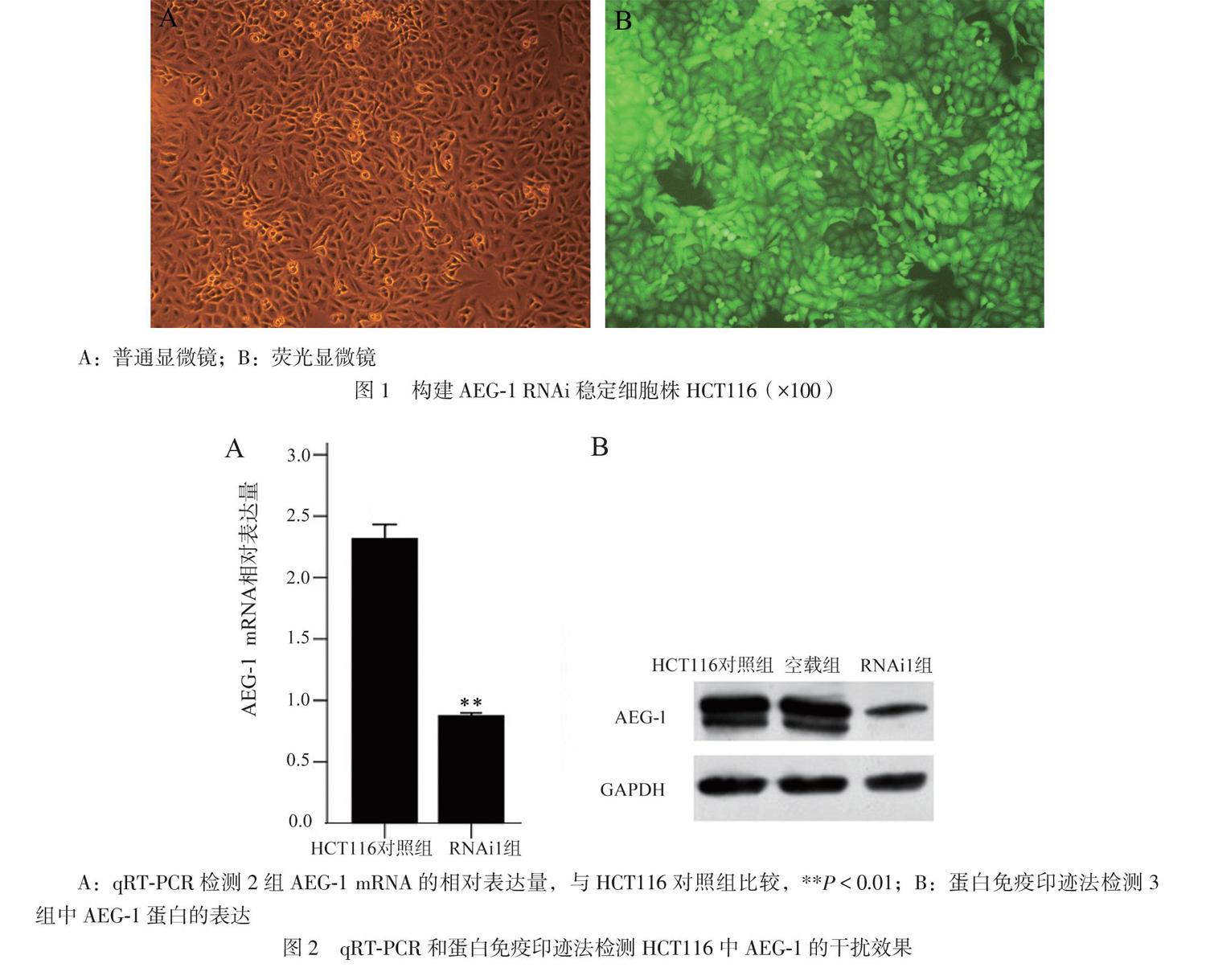
成功构建携带siRNA和GFP基因慢病毒载体,用其转染结肠癌细胞株HCT116,48h后于倒置荧光显微镜下观察可见绿色荧光(如图1),结果可见HCT116细胞被携带siRNA和GFP的慢病毒高效率转染,转染率大于95%。
二、qRT-PCR和蛋白免疫印迹法检测AEG-1的干扰效果
采用RNAi1干扰后AEG-1的mRNA(t=12.382,P=0.006)和蛋白(P<0.001)表达水平明显降低,siRNA能显著下调AEG-1的表达,表明成功建立低表达AEG-1的结肠癌细胞模型HCT116,见图2。
三、AEG-1对体内结肠癌细胞肿瘤发生的影响
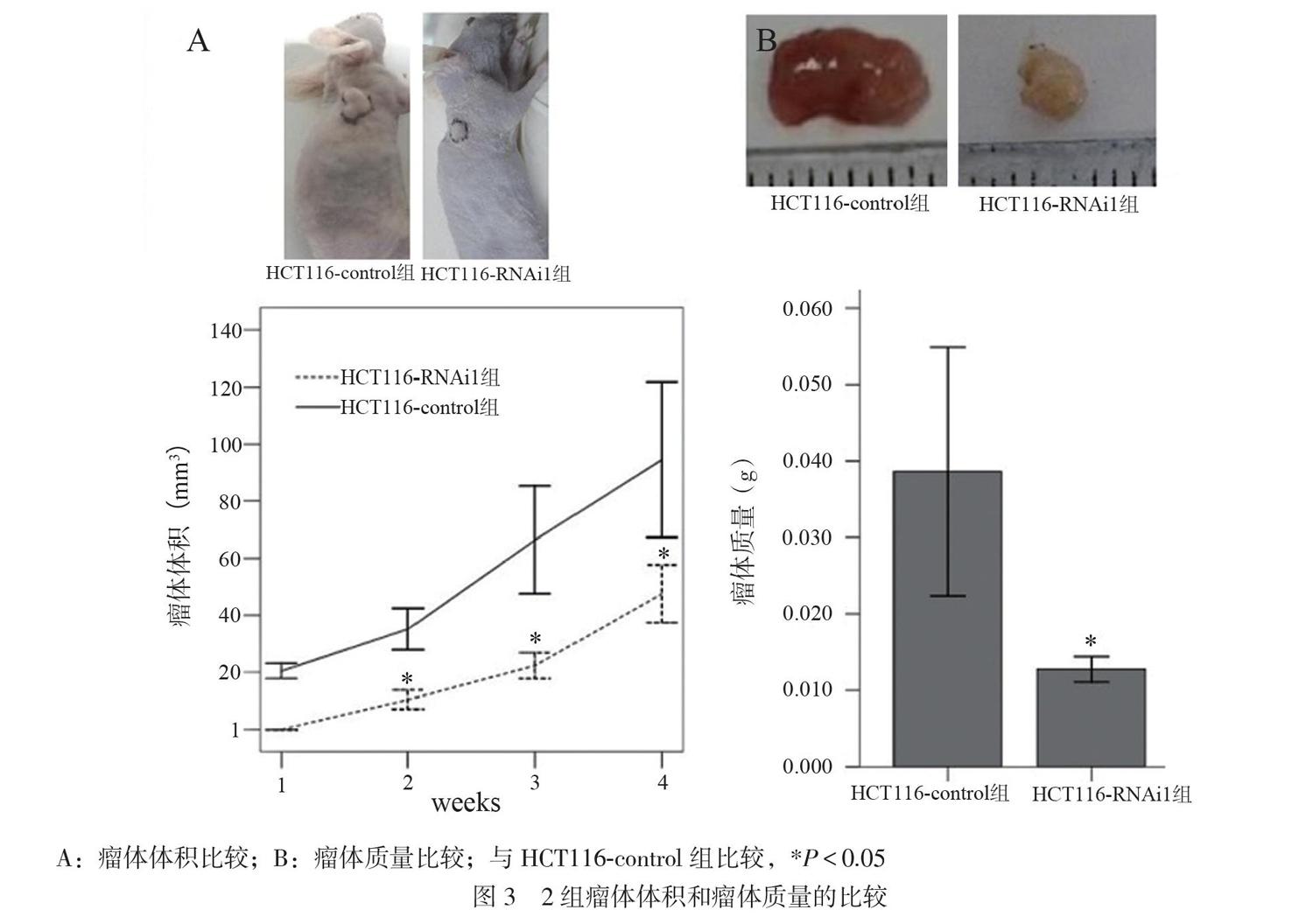
第1周HCT116对照组处理的裸鼠已有明显的肿瘤形成(20.41±2.63)mm3,而注射AEG-1-RNAi处理的小鼠第1周肿瘤没有生长,随后2、3、4周瘤体体积分别为(10.43±3.30)、(22.31±4.55)、(47.54±10.13)mm3,对照组为(35.14±7.29)、(66.39±18.86)、(94.53±27.31)mm3(图3A),重复测量资料方差分析显示2组瘤体体积随时间变化的趋势不同,差异有统计学意义(F=3.714,P=0.025),因此分析单独效应。2组第2(t=-6.906,P=0.001)、3(t=-5.080,P=0.001)、4(t=-3.608,P=0.007)周瘤体体积比较差异均有统计学意义。4周后处死裸鼠,取出瘤体测量质量,处理组为(0.013±0.002)g,低于对照组的(0.039±0.016)g(t=-3.535,P=0.023,图3B)。
讨论
AEG-1是一个多功能的癌基因,它可以调节致癌转化,提高恶性肿瘤的侵袭性,促进肿瘤增殖、扩散、转移,诱导新生血管形成以及介导化学治疗药物耐药等[7]。在卵巢癌中,敲除AEG-1可以抑制癌细胞的迁移和侵袭[8]。AEG-1还与肿瘤的临床分期、组织分化、淋巴结转移和预后不良密切相关。AEG-1的高表达与总体生存率低相关,高表达的总生存时间明显短于低表达,其可能是肿瘤的早期预警和患者生存的独立预后指标[3,9-10]。在不同级别星形细胞瘤中,AEG-1阳性率随肿瘤恶性程度的增加而增高,表达强度与肿瘤的级别呈正相关,与生存率呈负相关[11]。
大肠癌的演变是一个涉及多基因变化的复杂的过程,由正常肠上皮转化为肠上皮化生、腺瘤、腺瘤伴不典型增生、上皮内瘤变、癌,整个过程可能与多个癌基因、抑癌基因以及多条肿瘤信号通路的变化有关。近年来发现AEG-1不仅是各器官和组织致癌过程中的关键因素,而且是复杂的肿瘤信号通路网中的关键交汇点,其可以作用于多条信号通路,包括激活核因子-κB、Ha-Ras和磷脂酰肌醇3激酶/蛋白激酶B(Akt)通路、ERK/MAPK和Wnt/β-catenin通路,还有Aurora-Akinas信号通路等[12-13]。在非小细胞肺癌中,AEG-1通过提高抗凋亡蛋白Bcl-2水平和激活PI3K/Akt途径抑制细胞凋亡[9]。在结直肠癌中,AEG-1通过影响β-catenin增强结直肠癌细胞的转移和侵袭能力[13]。
我们前期研究以AEG-1基因为靶点,采用siRNA可以有效抑制AEG-1的表达,通过MTT、平板克隆、transwell和流式细胞仪等方法发现在体外下调AEG-1表达会抑制结肠癌细胞的增殖、克隆形成和侵袭能力,导致细胞周期G0/G1期停滞,促进凋亡和增加5-FU细胞毒性,以及影响血管生成相关因子缺氧诱导因子-1α(HIF-1α)的产生[5-6,14]。然而,干扰AEG-1的表达在体内试验会有怎样的结果及其相关的信号通路,我们仍然不清楚。因此我们深入研究,进一步进行裸鼠体内成瘤实验。实验结果显示,沉默AEG-1可抑制结肠癌细胞在裸鼠体内成瘤的能力,抑制肿瘤的生长,可见AEG-1在结直肠癌的癌变过程中起着重要的作用,有望成为肿瘤基因治疗的新靶点和预后评估指标。
恶性肿瘤具有无限生长潜力,与它可以诱导血管生成是密切相关的,而AEG-1可以诱导新生血管生成及促进血管生成相关因子的产生。有学者报道AEG-1肝细胞的条件培养基可以诱导显著的血管生成;在宫颈癌中沉默AEG-1可以显著下调血管生成相关因子HIF-1α、Tie2、血管内皮生长因子(VEGF)和TEM1/CD248的表达,而且人臍静脉内皮细胞在SiHa细胞或转染AEG-1的正常宫颈上皮细胞的条件培养基下培养,其血管生成能力增强[15-16]。另也有报道AEG-1与微小RNA(miRNA)关系密切,AEG-1通过介导miRNA-154表达抑制胃癌细胞的增殖,miRNA-564直接作用于AEG-1抑制甲状腺乳头状癌的侵袭性,miRNA-504通过作用于AEG-1抑制视网膜母细胞瘤细胞的增殖和侵袭能力[17-19]。我们前期研究发现通过上调或下调AEG-1表达会改变miRNA的表达谱,推测AEG-1可能是通过改变某些miRNA的表达,从而影响血管生成相关因子的产生[5,14]。前期研究显示上调AEG-1的表达会抑制miRNA-34a和促进HIF-1α的表达[14]。miRNA-34a是一个抑癌基因,高表达的miRNA-34a可抑制沉默信息调节因子1、损害内皮组细胞以及阻断VEGF的产物,从而抑制血管新生;而HIF-1α能使细胞更容易适应低氧的环境,是细胞对缺氧反应的最重要调节者,可以促进癌细胞表达VEGF,促进血管生成。有研究发现敲除miRNA-34a可通过激活Notch/HIF-1α信号通路,从而显著提高肝切除后10d大鼠肝功能和肝细胞再生能力[20]。也有报道指出miRNA-34a通过负性调节SIRT1/HIF-1α信号来影响2型糖尿病相关耳蜗毛细胞的凋亡[21]。这与我们在结直肠癌中发现下调AEG-1的表达会促进miRNA-34a及抑制HIF-1α表达是一致的。因此我们推测在结直肠癌中,AEG-1可能通过抑制miRNA-34a促进HIF-1α的表达,从而促进VEGF的表达,发挥促进肿瘤血管新生的作用。
综上所述,沉默AEG-1可以抑制结直肠癌细胞的体内成瘤能力,其机制可能与通过调节miRNA从而影响血管生成相关因子的产生有关,这将为进一步研究结直肠癌中AEG-1基因治疗奠定基础。

