阻塞性睡眠呼吸暂停患者血清神经肽S水平与微觉醒的相关性研究
卢静成 杨立新 周宁
阻塞性睡眠呼吸暂停(obstructive sleep apnea,OSA),主要是指OSA患者夜间睡眠时反复出现上呼吸道塌陷阻塞引起的间断性低通气及呼吸暂停,还伴有打鼾且鼾声不规律、日间嗜睡、夜间反复发生微觉醒、低氧血症、高碳酸血症等症状。研究OSA相关微觉醒的目的就是为了以后能利用微觉醒好的一方面和改善不利的一方面,对于OSA相关微觉醒的产生具体与哪些相关[1]。国内外研究发现[2-7],微觉醒可能与神经肽S、呼吸暂停或低通气、炎症反应、5-羟色胺(5-hydroxytryptamine,5-HT)等有关。神经肽S (neuropeptide S, NPS)是一种的具有睡眠-觉醒调节功能的神经肽, Xu等[8]关于NPS的研究推测NPS可能是通过丘脑中线核中的NPS受体转导的促觉醒作用,并且通过多个促觉醒通路表现作用,例如丘脑中线核、连接核、菱形核等。此外还有学者进一步研究发现[9]神经肽S可以缩短非快眼动睡眠、增加微觉醒次数、减少快眼动睡眠转入非快眼动睡眠的次数、增加非快眼动睡眠的慢波活动度。所以微觉醒与神经肽S息息相关,但是目前尚无OSA相关微觉醒与神经肽S的研究,因此我们选择利用血清生物学标记物来测量外周血清神经肽S水平,探讨OSA相关微觉醒可能的发生机制及NPS在其中发挥的作用。
资料与方法
一、研究对象
1 对象:根据本次试验的纳入标准和排除标准,随机选择2018.12.25-2019.5.30因夜间睡眠打鼾、憋气或白天嗜睡问题来我院就诊并行PSG检测,并依据成人阻塞性睡眠呼吸暂停基层诊疗指南(2018年)诊断为OSA,且签署经我院伦理委员会批准的实验知情同意书的成年OSA患者,其中62例中男性40例(64.51%),女性22例(35.48%);平均年龄(44.5±9.71)岁;BMI(26.25±4.78)kg/m2。OSA患者根据PSG检测出的AHI结果 分为轻、中、重度组,轻度组(5次/h≤ AHI<15次/h )、中度组(15次/h≤AHI<30次/h )及重度组(AHI≥30次/h )。其中轻度组18例(29.03%),中度组20例(32.26%),重度组24例(38.71%)。详细询问患者现病史、既往史等资料,然后对所有受试者进行Epworth嗜睡量表(Epworth Sleepiness Scale,ESS)测试,并评估日间嗜睡程度。
2 纳入标准:(1)自愿参与本次研究,并同意签署知情同意书。(2)年龄需满18周岁;(3)因夜间睡眠打鼾、憋气或日间嗜睡症状,并且之前未行体位、无创气道正压通气、口腔矫治器或外科等治疗的首诊患者;(4)近6个月未服用安眠或者促觉醒类神经药物;(5)无其它可以引起中枢性、混合型的睡眠呼吸障碍疾病,例如慢性心力衰竭,Chiafi畸形、脑血管意外、脑干新生物及多系统萎缩症等;
3 排除标准
(1)未签署知情同意书;(2)未成年或者年龄较大不能自行在本院行PSG监测一晚的患者;(3)有视力及言语障碍不能配合评估Epworth嗜睡量表的患者;(4)近6个月内曾服用抗生素,近一周曾饮酒的患者;(5)患有严重脏器疾病,例如肿瘤、脑梗死、肾衰竭等;(6)体内有植入物可影响PSG监测的患者。
二、研究方法
1 Epworth嗜睡量表评分:参照Johns 1991年发表在Sleep杂志上的评估办法[10],根据受试者在8种不同情境下的自身情况进行评分,最后各分数累加即是ESS评分。
2 PSG检测:所有受试者需要接受整夜≥7h的睡眠检测,本次研究采用的PSG是北京联合万泰型号为SW-2000的多导睡眠监测仪器。
3 血清NPS的测定:所有受试者在接受完PSG 监测的次日晨起后,随即空腹采肘静脉血4 mL,用无热原无内毒素的普通试管收集血液,在23℃±2℃的温度下放置半小时,然后离心(1000×g)15 min,随即收集上清液体(如果保存过程中出现沉淀需再次离心)后放置于-80℃恒温冰箱中冷冻保存,注意避免反复冻融。待所有样本采集完成后,所有样本采用酶联免疫吸附法(enzyme linked immunosorbent assay, ELISA )统一检测。主要设备和试剂包括;试剂盒为美国TSZ公司生产的人神经肽S(NPS)ELISA试剂盒(编号:HG37881)。
三、统计学方法
数据统计学分析采用SPSS24.0软件进行。 Kolomogorov-Smirnov 检验分析数据的分布,正态分布数据使用单因素方差分析 (多组间)、T 检验(2 组间)进行比较,而非正态分布数据使用 Kruskal-Wallis (多组间)、 Mann-Whitney 检验(2 组间)。相关性采用Pearson相关性分析。正态分布数据使用平均值±标准差表示,非正态分布数据采用中位数(四分位差)表示,P<0.05 为差异有统计学意义。
结 果
一、 各组受试者一般资料、血清NPS水平及ESS评分的比较
(见表1)对照组和OSA各组在血清NPS水平、ESS评分、BMI均有显著差异(P<0.01)。且随着OSA患者病情的加重,血清NPS水平、ESS评分、BMI均增高,差异具有统计学意义(P<0.05)。
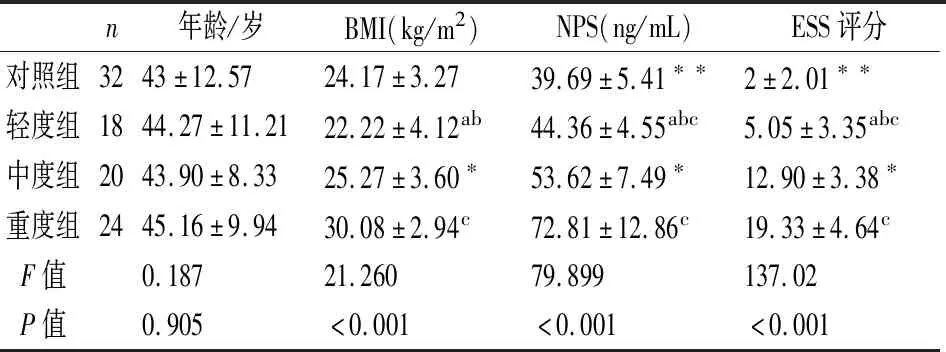
表1 各组受试者一般资料、血清NPS水平及ESS评分的比较
二、 各组PSG相关数据的比较:
表2可以看出各组受试者在AHI、MAI、N1期、N2期、N3期、REM期比例之间的差异均有统计学意义(P<0.05)。中度组的AHI、MAI、N1期、N2期比例均高于轻度组,且差异具有统计学意义(P<0.05)重度组除REM期比例外,AHI、MAI、N1期、N2期比例均高于轻度组及中度组,且差异具有统计学意义(P<0.05)。OSA各组与对照组比较,AHI、MAI、N1期、N3期、REM期比例之间的差异均有统计学意义(P<0.05)。
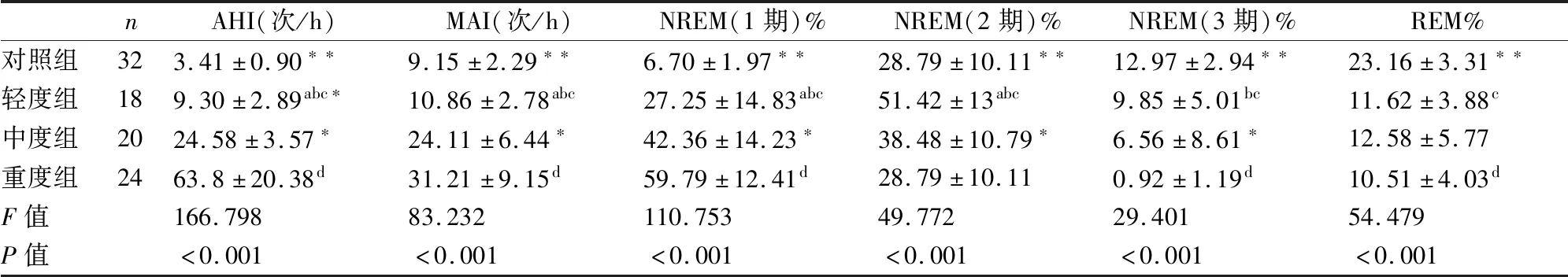
表2 各组PSG相关数据的比较
三、各受试组血清NPS水平与MAI及其他数据的相关性分析:
表3可看出我们发现总OSA组血清NPS水平与MAI(r=0.827)、ESS评分(r=0.692)、BMI(r=0.505)、AHI(r=0.789)、N1期比例(r=0.707)均呈正相关(均P<0.05),与N2期(r=-0.679)、N3期比例(r=-0.483)呈负相关(均P<0.05)。

表3 各受试组血清NPS水平与MAI及其他数据的相关性分析
四、各受试组MAI与其他数据的相关性分析:
由表4可知OSA患者微觉醒与血清ESS评分(r=0.766)、BMI(r=0.549)、AHI(r=0.782)、N1期比例(r=0.797)均呈正相关(均P<0.05),与N2期(r=-0.743)、N3期比例(r=-0.617)呈负相关(均P<0.05)。
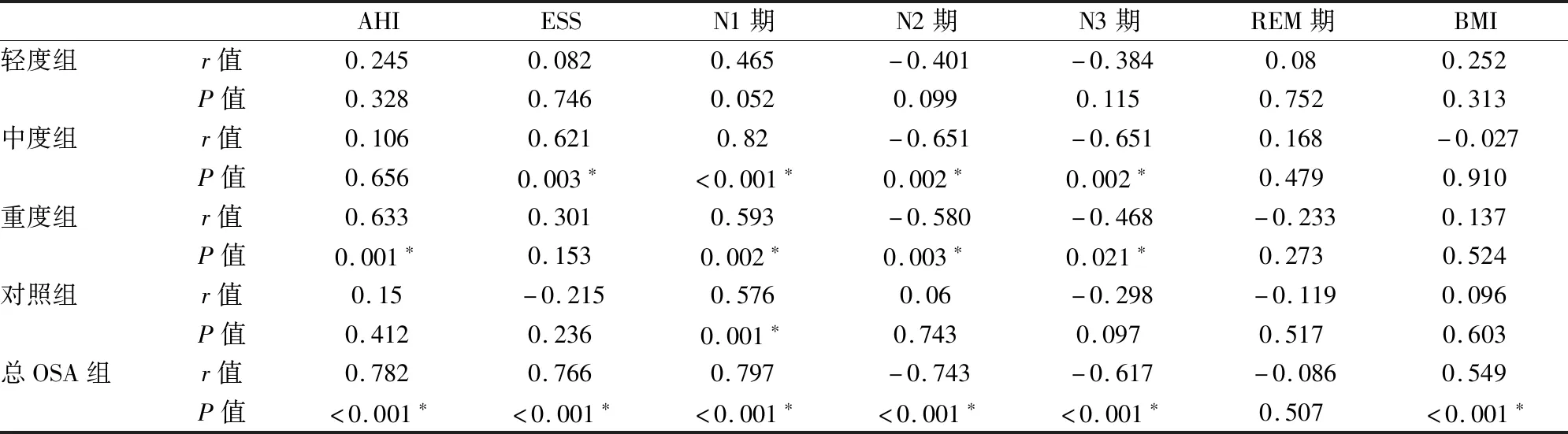
表4 各受试组MAI与其他数据的相关性分析
讨 论
目前发现OSA与多种疾病的密切相关,例如高血压、2型糖尿病、冠心病、脑梗死、认知功能障碍等多系统侵害,甚至还与孕产妇出现妊娠期高血压、妊娠期糖尿病、早产等不良母婴结局有关[11-15]。所以研究OSA相关机制,可以更好的治疗和预防OSA及相关疾病。
本次研究发现随着OSA病情的加重,ESS评分会升高,也就说明患者日间嗜睡症状会加重。我们通过PSG发现,OSA患者的睡眠结构紊乱,主要表现在微觉醒次数增多,N1期睡眠比例升高,N2期、N3期及REM期睡眠比例下降。微觉醒的产生对于OSA患者来说,既是睡眠时发生呼吸紊乱时的一种保护机制,也是造成睡眠结构紊乱的原因之一,而OSA微觉醒的具体产生机制尚不明确。目前主要分为化学和机械刺激两个方向,当前大多数学者认为是呼吸暂停或低通气所导致的间断性低氧或高碳酸血症引起的微觉醒。其可能是通过刺激颈动脉体和主动脉弓中的外周氧化学传感器,或者通过激活中枢神经内的CO2化学传感器。但目前关于神经呼吸驱动的研究尚无定论,且无可重复性的结论。以往研究发现,舌咽神经的颈动脉窦支化学感受器可以将动脉血液分压变化的信号传递给孤束核,最终激活延髓的腹侧面神经元,而高碳酸血症可一并刺激位于颈动脉体的外周化学感受器和延髓腹外侧浅表附近的中枢化学感受器。关于睡眠-觉醒的研究目前发现,许多神经递质在睡眠-觉醒中起着重要作用,例如谷氨酸、去甲肾上腺素、组胺、乙酰胆碱等。目前发现NPS是一种具有睡眠-觉醒调结功能的神经肽,最早Xu等[16]通过给大鼠侧脑室注射NPS,大鼠的总觉醒时间明显升高,N1期、N2期及REM期睡眠时间明显缩短,并且大鼠在被注射NPS后1 h内即可觉醒。而NPS神经元主要分布于蓝斑、旁臂核,在下丘脑和杏仁核也有零星表达,人脑桥中绝大多数(84%)NPS受体(NPSR)神经元分布在旁臂核(parabrachialnucleus,PB)[17]。而PB是OSA相关微觉醒的关键脑区, 其中被高碳酸血症激活PB神经元后产生的功能,可能是引起睡眠期间呼吸受损时发生的微觉醒, 当PB神经元参与高碳酸血症时,它们有助于激活延髓腹外侧神经元、膈和舌下神经运动神经元[18]。有研究[19]通过建立从脑桥的旁臂核神经元中敲除谷氨酸转运蛋白 2(vesicular glutamate transporter 2,Vglut2)基因的小鼠模型,结果发现从旁臂外侧核神经元剔除Vglut2基因后的小鼠,会导致因高碳酸血症刺激引起的微觉醒潜伏期延长,部分小鼠不会微觉醒。而PB内侧核Vglut2基因缺失的模型中,高碳酸血症并没有对小鼠发生微觉醒产生很大影响,但会使小鼠NREM 期睡眠比例增加。该试验结果显示PB外侧核中的谷氨酸能神经元对于高碳酸血症所诱发的微觉醒来说是非常重要的,而PB内侧核谷氨酸能神经元的作用则是促进自发性微觉醒。此外,Kaur等[20]进一步证实了外侧PB神经元的部分化学基因和光遗传学活性可导致觉醒,抑制外侧PB神经元的光遗传学即可阻断高碳酸血症导致的微觉醒。我们的结果表明,对照组和OSA各组在血清NPS水平之间有显著差异(P<0.01)。并且随着病情的加重,OSA患者血清NPS水平也升高。我们进一步研究NPS与微觉醒的关系发现,OSA患者血清NPS水平与微觉醒呈正相关性(r=0.827,P<0.01),但我们发现轻度组OSA患者血清NPS水平与微觉醒无相关性,而中重度组OSA患者血清NPS水平与微觉醒均呈正相关性(r=0.659,r=0.683,均P<0.01)。轻度组OSA患者发生微觉醒的主要机制可能不是主要通过NPS通路,有研究发现[21]小鼠在敲除NPSR基因后睡眠时间并没有明显延长。由此推测NPS可能不是睡眠-觉醒调节过程的唯一神经递质,NPS可能只有在OSA患者出现低氧血症或高碳酸血症并达到一定程度时才会介导睡眠-觉醒调节过程,还有一种可能是通过唤醒或联合多条其它睡眠-觉醒调节通路。本次研究还发现血清NPS水平还与AHI、N1期睡眠比例呈正相关(r=0.789,r=0.707,均P<0.01),N2期、N3期睡眠比例呈负相关(r=-0.679,r=-0.4837,均P<0.01),并且发现OSA患者随着病情的加重,微觉醒次数增多,浅睡眠N1期明显增多,深睡眠N3期明显减少。这与Ahnaou等[9]结果基本一致,NPS可以促觉醒、减少N3期睡眠时间以及减少正常睡眠周期向深睡眠的转换次数。该研究还发现NPS虽然减少了N3期睡眠时间,但可以通过增加N3期睡眠的慢波活动度,从而改善睡眠质量,以弥补睡眠时间的减少。所以我们大胆推测NPS的作用可能是在达到一定的微觉醒阈值或者高碳酸血症后才会产生促觉醒作用,从而避免因呼吸暂停或者低通气造成的不良后果,例如睡眠结构紊乱。但同时也能发挥积极的作用,例如改善睡眠质量。但是究竟NPS是通过何种神经通路产生促觉醒作用的,目前研究尚无定论。除可能是通过刺激PB外侧核中的谷氨酸能神经元外,赵正卿等[22]认为可能是通过单胺能系统。关于NPS的促觉醒机制,也有研究推测其效用可能是通过位于丘脑的中线核群表达的NPS受体所介导的。我们推测可能是PB中的谷氨酸能神经元释放谷氨酸能型号,然后作用于前脑基底、下丘脑外侧、丘脑中线部位及大脑皮层丘脑的NPS受体,从而诱发微觉醒。关于其它呼吸相关觉醒神经通路的研究发现延髓 5-HT 神经元有助于正常的觉醒和睡眠中遇到的缺氧的反应。这也说明NPS相关觉醒通路可能只是OSA呼吸相关觉醒神经通路其中的一条。
从临床价值来看,研究OSA患者NPS与微觉醒的关系是有意义的,可以为我们提供减少睡眠结构片段化、改善OSA患者夜间睡眠时出现缺氧或者高碳酸血症的反应从而造成各种不良后果提供新的治疗方向。目前国内外研究发现[23-24],部分患者在接受CPAP治疗后睡眠结构改善并不明显,夜间微觉醒次数仍高,患者白天仍有嗜睡症状。所以,OSA相关微觉醒机制的研究可以为我们的治疗提供新思路,同时指导我们在不同的治疗手段中做出最佳选择,从而让OSA患者获得最佳的治疗效果。目前已有关于神经肽S受体拮抗剂(RTI-118)的研究报道[25],他们发现神经肽S受体拮抗剂可以成为治疗可卡因滥用的候选治疗方案。所以在未来的研究中,可以根据NPS的生物学特点,研制出改善OSA患者夜间频发微觉醒的药物。
综上所述,虽然发现OSA患者血清NPS水平与微觉醒之间具有相关性,但由于受本实验样本量较少,受试者来源单一,且未实时监测血清神经肽S水平,从不能判断在OSA患者夜间发生微觉醒时体内NPS的释放是在其发生前还是发生后,仅凭血清神经肽S水平尚不能判断患者微觉醒的状态,需进一步研究论证。我们在未来的研究中,会扩大样本量及样本来源,并且设计出一种可以实时监测神经肽S的方法,从而进一步的探讨OSA相关微觉醒与NPS之间的因果关系。

