循环肿瘤细胞对NSCLC浸润深度的评估
何雨笑 鲁继斌
肺癌是威胁人类健康的常见肿瘤之一。2015年中国国家癌症中心发布的数据显示,中国2006-2011年肺癌患病率为1302/10万,男性84.6/10万,居恶性肿瘤第二位;女性45.6/10万,居恶性肿瘤第四位[1]。2017年美国癌症协会发布肺癌死亡率在恶性肿瘤中居首位[2]。循环肿瘤细胞检测作为一种肿瘤的“液体活检”现已应用于肺癌的早期诊断、预后评估以及化疗疗效评估等方面[3]。目前,早期肺癌主要依靠手术治疗,通过肺癌的位置及浸润深度来选择手术方式。对于非小细胞肺癌(NSCLC),原位癌和浸润癌的手术方式明显不同,现有的手术方式主要包括亚肺叶切除和肺解剖切除。亚肺叶切除包括肺楔形切除和肺段切除,肺楔形切除是切除包括肿瘤在内的部分肺脏,而肺段切除是切除肿瘤所在肺段;肺解剖切除即切除是切除整个肺叶甚至全肺。由于不同的术式手术时长不同,切除的肺脏大小不同,导致患者术后恢复情况、术后肺活量、术后生存质量以及术后生存时间也不尽相同。精准且合适的手术方式可以提高患者的诊疗质量以及生存质量[4-7]。本研究通过对64例NSCLC术后患者的病理及CTCs结果进行统计学分析,旨在研究术前循环肿瘤细胞数量(circulating tumor cell,CTCs)与肺癌浸润深度之间的关系,从而在术前对患者肺癌的浸润深度进行评估,选择更加精准的手术方式。
资料与方法
一、一般资料
1 纳入标准 (1)选取2018年7月-2019年6月于中国医科大学附属盛京医院胸外科行肺癌手术且术前行CTCs检测的患者(2) 所有患者均知情并且签署知情同意书,并同意参与到此次实验研究过程中;(3) 患者无重要器官损伤疾病; (4) 患者无其他合并并发症。(5)患者未合并其他肿瘤
2 排除标准 (1) 排除有放化疗史患者; (2) 排除合并细菌感染患者;(3)患有其他肿瘤或肿瘤史的患者。共选取现有术后NSCLC患者64例。男34例,女30例,年龄49~78岁,平均年龄(60.8±7.2)岁。原位癌患者32例,男18例,女14例,年龄49~72岁,平均年龄(57.7±7.0)岁;非原位癌患者32例,男16例女16例,年龄52~78岁,平均年龄(63.8±6.2)岁。
3 仪器与试剂 ACD采血管(美国 BD公司),低速大容量离心机(上海安亭科学仪器厂),磁力架(Pr omega),荧光显微镜(Ni kon),杂交仪(DAKO)。采用免疫磁珠阴性富集法的循环肿瘤细胞检测系统,检测试剂采用其配套试剂(江苏莱尔生物医药科技有限公司)。
二、方法
1 血样采集 统一采用ACD抗凝或EDTA抗凝(含抗凝剂)的5 mL真空采血管,采血后立即颠倒混匀8次,取样量为4 mL。
2 循环肿瘤细胞的富集 轻柔颠倒混匀,取3.2 mL全血(含EDTA抗凝剂)(4Ml含ACD抗凝剂)至50 mL离心管中。补充CS1至45 mL。离心(650 g,室温,5 min),吸弃上清至约12 mL,轻摇离心管混匀沉淀细胞。将上述液体混匀后,加CS2至45 mL。将离心管置于垂直混匀仪混匀,室温8~10 min(20 转/ min)。按上述方法离心完全吸弃上清,补加200 μL CS1离心两次后补加CS1 5 mL。洗涤磁微粒后将洗好后的磁微粒保存在试管架上。按每份150μL的比例将磁微粒缓慢加入上述样本中,同时摇动离心管以充分混匀。调节水平摇床至100~120rpm,将离心管以35°~40°角倾斜固定于摇床上,室温摇动20~25 min。于新50 mL离心管中加入3 mL CS3,将上述样本轻轻叠加到CS3顶层。然后用1 mL CS1清洗离心管壁,并将清洗液转移至CS3顶层,配平后离心(300 g,室温,5 min)。离心后,吸取结合了磁珠的白细胞沉淀以外的部分,转移至15 mL离心管内,补加CS1至14 mL,轻柔颠倒混匀后离心(950 g,室温,5 min),吸弃至300 uL,沿管壁加入1 mL CS1,轻柔吹打重悬沉淀细胞。将标本转移至2 mL离心管,靠于磁力架2~3 min,将液体转移至1.5 mL离心管,架于15 mL离心管上端,离心(2070 g,室温,3 min),吸弃上清至约100μL,加入100μL CF1固定液,充分轻柔吹打混匀10次以上,涂片至20×20 mm2的标本框中。将标本自然干燥,建议使用无风烘箱(26~33℃)。
3 imFISH 将干燥后的标本进行固定、老化、脱水处理,然后将探针加入标本区,封片杂交。杂交后在标本区加入CD45荧光抗体,避光孵育并加DAPI溶液,荧光显微镜下读片。
三、判定标准
1 CTCs阳性的判定[8]使用CEP8探针于荧光显微镜下读片。阳性标准: CTCs细胞为圆形、长椭圆形,长径大于 10μm,细胞核所对应的探针信号点大于等于 3个,并且未表达出白细胞表面抗原(红圈标记记)为一个阳性细胞。以 CTCs检测数值大于等于 2个即为阳性(见图1、2)。

图1 蓝色为细胞核,橙红色为探针信号位点,此图无白细胞标记 图2 红色为白细胞标记
2 患者术后免疫组化病理结果 本研究免疫组化均由中国医科大学附属盛京医院病理科检测并发布结果。
四、统计学处理
用SPSS软件对数据进行统计学分析。资料行t检验和χ2检验,相关性分析进行logistic回归分析,以P<0.05 为差异有统计学意义。 对数据进行ROC数据分析,并计算其CTCs数值的临界值,以P<0.05为差异有统计学意义。
结 果
一、原位癌组和浸润癌组间各项指标比较
原位癌组与浸润癌组比较,性别差异无统计学意义(P>0.05);与原位癌组相比,浸润癌组年龄较大,差异有统计学意义(P>0.05);与原位癌组相比,浸润癌组CTCs检测数值较大,差异有统计学意义(P<0.05)(见表1)。

表1 原位癌组和浸润癌组间各项指标比较
二、logistic回归分析
为剔除混杂因素影响,将上述单因素分析差异有统计学意义的变量纳入logistic回归方程进行分析。结果显示,CTCs为鉴别原位癌与浸润癌的独立因素(见表2)。
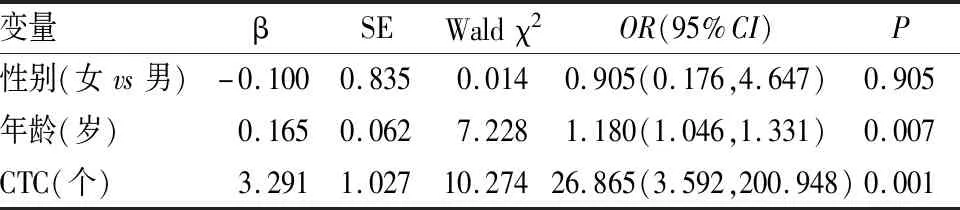
表2 logistic回归分析
三、CTCs计数与肺癌浸润深度间的关系
通过使用受试者工作曲线(ROC)分析CTCs与肺癌是否为浸润癌的相关性可以得出:当Se=100%时, Cutoff值:1.5, Se:1.000, Sp:0.219;当Sp=100%时, Cutoff值:3.5, Se:0.313, Sp:1.000;当 Se+Sp最大时, Cutoff值:2.5, Se:0.625, Sp:0.937,由此可分析,CTCs数值为2.5个时为原位癌与浸润癌的最佳 Cutoff值,即当CTCs≤2.5时,其肿瘤为原位癌的可能性大;当CTCs>2.5个时,其肿瘤为浸润癌的可能性大(见图3)。
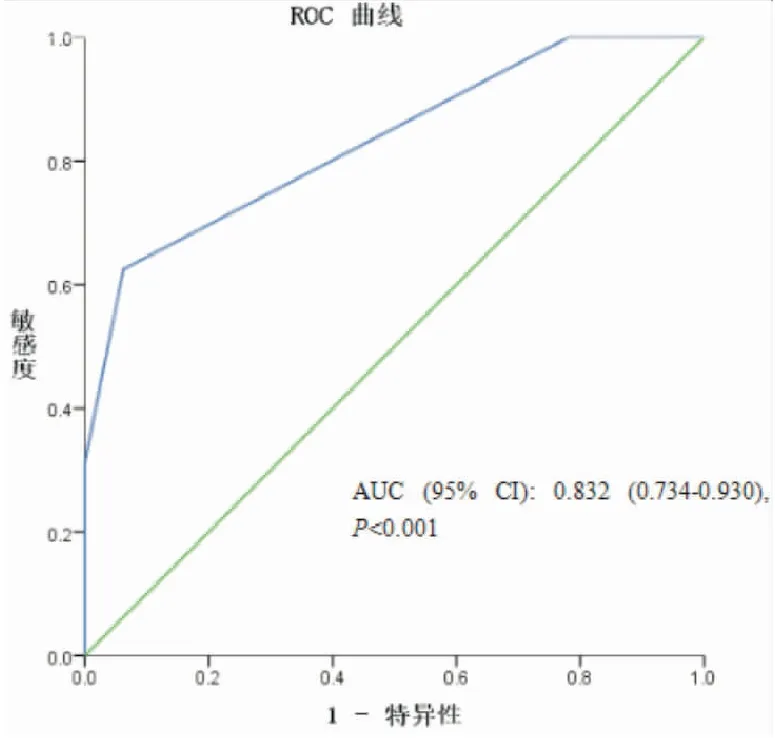
图3 CTCs计数与肺癌浸润相关性曲线图
讨 论
肺癌是世界上引起人类死亡的主要原因之一[9]。美国肺癌致死人数比乳腺癌、胰腺癌以及前列腺癌加起来的人数还要多[10]。早期肺癌的治疗手段仍是手术治疗,而手术方式的选择大多基于肺癌的浸润深度,原位癌与浸润性肺癌的手术方式截然不同[11]。不同手术方式对患者术后的呼吸功能以及生存质量有严重影响[12]。循环肿瘤细胞(circulating tumor cells,CTCs),是Ashworth于1869年在血液中发现的一种与原发肿瘤细胞类似的细胞,并提出这个概念[13]。目前 CTCs 定义为由实体瘤或转移灶释放进入外周血循环的肿瘤细胞。随着肿瘤细胞的浸润和转移,部分肿瘤细胞出现上皮- 间质转化(epithelial mesenchymal transition,EMT),使肿瘤细胞通过结缔组织间隙或因毛细血管破裂从而进入血液循环系统,形成CTCs[5]。CTCs检测是一种新兴的微创液体活检技术(LB),该领域中的近期刊物及新型技术证明了LB在肿瘤检测中的重要性日益增加[14-18]。
已有大量研究证明,CTCs检测已可以对肿瘤进行早期诊断、化疗效果以及术后生存时长等方面的指导[19-27],在早期诊断方面,Alfonso Fiorelli等人通过对54例肺癌及17例肺部两性肿瘤的对比证明CTCs在肺癌的早期检测中可以区分肿瘤的良恶性,其中20例恶性肺癌患者为原位癌,这表明在原位癌阶段就可以通过CTCs检测进行早期诊断[19];Hofman等人通过对COPD 168例患者及77例健康患者进行CTCs检验,其中5例COPD患者CTCs检测为阳性,随访五年后5例患者均发现肺癌[21]。这表明CTCs不仅可以在肺部肿瘤的早期进行良恶性鉴别,而且可以检测出影像学尚未发现的肺癌。在基因检测方面,Yanagita等人对检测出的循环肿瘤细胞进行EGFR突变坚持,突变结果与患者的术后病理结果一致,这表明对于无法取得病理活检的患者,可以通过CTCs检测进行EGFR突变的检测,从而使患者得到及时的治疗[25]。在肺癌转移预测方面,Massagué等人CTCs可以通过外周血液的流动,定植于肿瘤外器官从而造成肿瘤转移,因此术后CTCs检测仍为阳性的患者有很高的转移风险[20]。在化疗效果评估方面,Jay F. Dorsey等人通过对30名非小细胞肺癌患者化疗前后循环肿瘤细胞数目的统计,发现在化疗后[26]循环肿瘤细胞的数量会减少并具有统计学意义。并表明可以通过化疗前后循环肿瘤细胞的数量来判定化疗的效果[26]。
本实验研究表明,随着CTCs检测值的增加,非小细胞肺癌更加倾向与浸润癌,这与Chen等人的研究是相符的,并且Chen等人还发现,Ⅰ/Ⅱ期患者的CTCs水平明显低于Ⅲ/Ⅳ期患者,并且与性别、吸烟史及病理学类型无相关性[28]。在NCCN2009.V5非小细胞肺癌指南中指出,行亚肺叶切除的患者需要满足一下条件之一:1)、组织类型为单纯的原位癌;2)、CT显示结节≥50%为毛玻璃样;3)、影像学随访证实肿瘤倍增时间≥400天。对于毛玻璃样组织超多50%的早期发现的肺癌患者来讲,手术方式的选择就十分重要并且也十分困难。本研究还表明,当CTCs检测值未超过2.5个时,其肿瘤为原位癌的可能行大。因此,对于上述通过影像学及随访时长较难选择手术方式的患者,术前行CTCs检测就十分必要。若术前CTCs检测值未超过2.5个时,便可选择亚肺叶切除。亚肺叶切除相较于解剖切除而言,其手术时长较短、术中出血量较少、手术风险较小、术后恢复周期较短,这大大提高了患者的治疗质量[29-30]。并且对于没有手术意愿的早期肺癌患者,也可以通过CTCs检测进行随访让患者明确自身肿瘤的具体情况。
通过研究结果我们知道,鉴别原位癌与浸润癌的临界值为2.5个这并不是一个整数,而且CTCs检测具有较高的真阳性率(87.5%),但是其也存在着一定的假阴性率,这都是由于CTCs的检测方法不尽完善[31],但现已有许多新型CTCs检测技术已被研发,但尚未应用于临床,例如:Nano Velcro[32],这种方法已可以能够更多的捕获和富集CTCs[33]。同理,GILUPI Cell Collector也可以更加精准及有效的捕获和富集CTCs[34]。由此可见,随着技术的发展CTCs的检测结果会更加精确,在肿瘤的诊疗也会更加精准。

