基于网络药理学的葛花治疗酒精性肝损伤的作用机制探讨
黄秋连,谢璐欣,葛 菲 ,杨碧穗,吴 波,朱玉野,吴志瑰,李袁杰,申本华,蒋 成,邓可众
(江西中医药大学 药学院,江西 南昌 330004)
【研究意义】酒精性肝损伤(alcoholic liver disease,ALD)是指长期过度饮酒而导致的肝脏疾病,严重会导致人体肝功能衰竭而死亡[1-4], 发病机制复杂, 主要与氧化应激反应、 炎症反应、 乙醇代谢反应、脂代谢等有关[5]。随着社会快速发展,ALD 是危害人民健康的常见疾病,据相关统计,每年全世界 40% 肝硬化死亡患者中是由 ALD 导致[6]。目前临床西医治疗手段主要以戒酒和营养支持为主,还未研制出特别理想的治疗药物,而现代临床研究表明中药治疗 ALD 具有高效、低毒等优势,因此挖掘传统中药预防和治疗 ALD 及其作用机制非常迫切[7-12]。 葛花 (Puerariae fos) , 豆科植物葛(Pueraria lobata(Willd.)Ohwi) 或粉葛(Pueraria thomsoniiBenth)的干燥花,始载于《名医别录》,具有解酒醒脾的作用,是最具代表性的解酒药物之一[13-14]。本研究基于网络药理学技术,系统分析葛花治疗 ALD 的成分和潜在作用机制,为今后开展葛花治疗 ALD 的研究提供进一步的理论基础和参考依据。
【前人研究进展】现代药理研究表明,葛花对于治疗酒精性肝损伤具有显著疗效,但是葛花发挥疗效的成分和作用机制目前尚未完全清楚[15]。雷红伟等[16]研究发现,葛花粗提物与葛花总异黄酮提取物对酒精性肝损伤均有良好的治疗作用。朱雷蕾等[17]研究表明,葛花水煎液对酒精性肝损伤有治疗作用。张国哲等[18]研究表明,葛花水提物解酒效果强于葛花总黄酮提取物。基于网络药理学技术进行中药分子作用机制研究已有大量文献报道,并且成为一个热门的研究策略,该技术通过多网络数据分析平台构建“药物-靶点-疾病-信号通路”相互作用网络分析的研究模式,可以更直观、更全面的具体阐述中药多成分、多靶点的分子作用机制[19]。
【本研究切入点】本研究运用现代网络药理学研究技术,通过网络数据分析平台,直观、全面的阐述葛花治疗酒精性肝损伤的分子作用机制。
【拟解决的关键问题】本研究通过多个数据挖掘、分析平台拟筛选出葛花治疗 ALD 的有效活性成分以及关键作用靶点,并通过对关键靶点的 GO 富集分析与 KEGG 通路注释分析,预测葛花治疗 ALD 的关键通路,为研究葛花治疗 ALD 提供理论和参考依据。
1 材料与方法
1.1 有效成分筛选及靶点预测
以“葛花”为关键词,以口服生物利用度(oral bioavailability,OB)≥30%与类药性(drug likeness, DL)≥0.18 为条件通过 TCMSP(中药系统药理学数据库和分析平台,http://tcmspw.com/tcmsp.php)中检索并筛选出候选化合物及其潜在作用靶点,空缺成分的潜在作用靶点利用 Swiss Target Predicition (http://new.swisstargetprediction.ch/)数据库进行补充;在 UniProt 数据库(https://www.uniprot.org/)中限定物种为“human”,进行靶点信息比对和基因名校正。
1.2 相关靶点筛选
以“Alcoholic Liver Disease”为检索词,运用 DisGeNET(http://www.disgenet.org/)、DrugBank (https://www.drugbank.ca/)、OMIM(https://omim.org/)数据库检索得到疾病的相关作用靶点。对 3 个数据库疾病靶点进行合并和去除重复值,通过 UniProt 数据库(https://www.uniprot.org/)校正其蛋白名称为官方名称,并限定物种来源为人。
1.3 成分-作用靶点网络构建
通过 Venny 2.1(https://bioinfogp.cnb.csic.es/tools/venny/)将筛选出的有效成分潜在作用靶点与疾病相关靶点取交集,以获得葛花治疗酒精性肝损伤的潜在作用靶点。再运用 Cytoscape3.7.2 构建“化合物- 作用靶点”网络图,以化合物与靶点之间的连接情况为条件,筛选出葛花作用于 ALD 的关键化合物。
1.4 共同靶点蛋白互作(PPI)的构建及关键靶点筛选
为研究葛花治疗 ALD 的靶蛋白之间的相互作用关系,将“药物-疾病”的交集靶点基因导入 String(http://string-db.org/)数据库,物种设置为 Homo sapiens,获取靶点的相互作用关系,并导入 Cytoscape3.7.2 软件中,以网络中节点的拓扑特征为条件,分析并筛选关键作用靶点。将关键作用靶点运用 DisGeNET 数据库获取类型信息,得到葛花防治 ALD 作用关键靶点的信息。
1.5 GO 分析和 KEGG 通路富集分析
将共有靶点导入 DAVID Bioinformatics Resources 6.7(https://david-d.ncifcrf.gov/summary.jsp)进行 GO 富集分析和 KEGG 富集分析。
2 结 果
2.1 葛花有效成分筛选及靶点获取
在 TCMSP 数据库中检索到葛花化合物 138 个,并根据 OB≥30%和 DL≥0.18 筛选出葛花有效成分 18 个,各个化合物及其 OB 和 DL 值见表 1。通过 TCMSP 数据库查找到 17 个有效成分的靶点,删除重复靶点后共 199 个预测靶点。 葛花苷 (Kakkalide) 在 TCMSP 未找到作用靶点, 通过 Swiss Target Prediction 数据库补充并筛选排名前 15 的靶点。两个数据库删除重复值后共得到葛花有效成分的预测靶点 208 个。
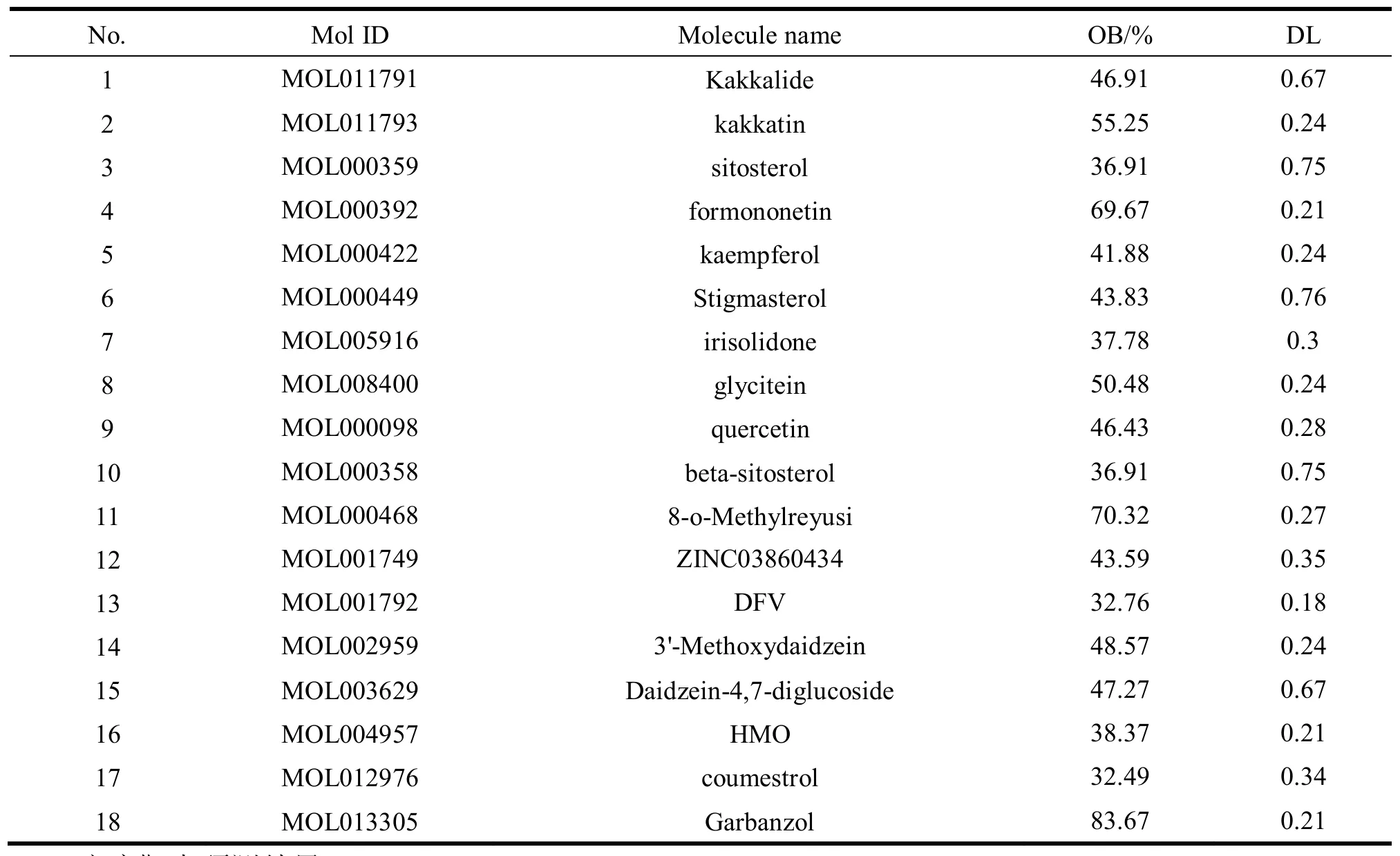
表 1 葛花有效成分
2.2 疾病靶点预测结果
经过检索 DisGeNET、OMIM、DrugBank 3 个数据库,分别筛选到 84、516 和 17 个靶点,去除重复靶点后获到疾病靶点 610 个。
2.3 葛花治疗酒精性肝损伤潜在作用靶点预测
将所得的有效成分相关靶点与疾病相关靶点运用 Venny2.1 (https://bioinfogp.cnb.csic.es/tools/venny/)取交集得到葛花治疗 ALD 的作用靶点 31 个(图 1),对应葛花化合物 13 个,此交集靶点即为葛花治疗 ALD 的潜在作用靶点,其中 5 个化合物不参与有效化合物-作用靶点网络构建。借助 Cytoscape3.7.2 绘制有效成分-作用靶点网络图(图 2),红色六边形表示有效化合物,黄色菱形表示葛花治疗 ALD 的共有靶点,其中 Degree 值越大,节点越大。
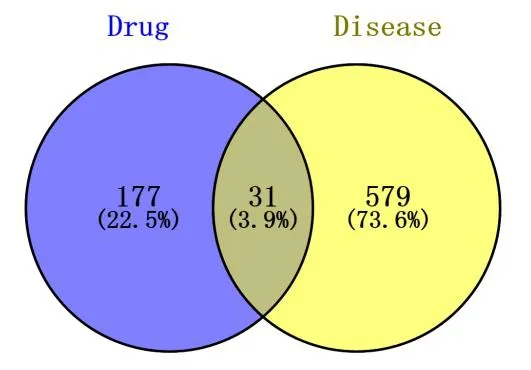
图 1 葛花与 ALD 的靶点韦恩图
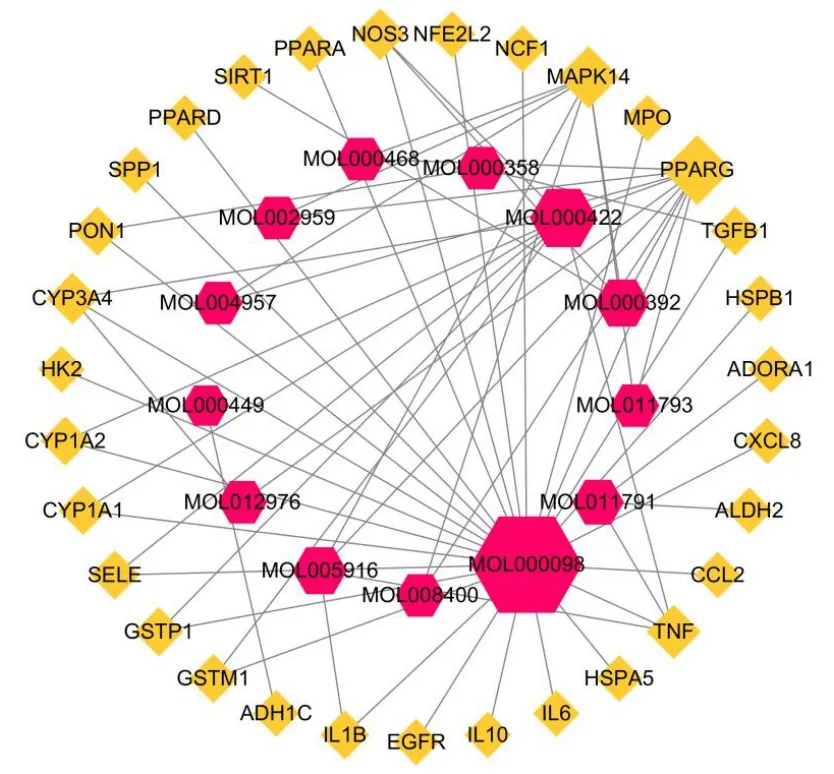
图 2 有效成分-作用靶点网络
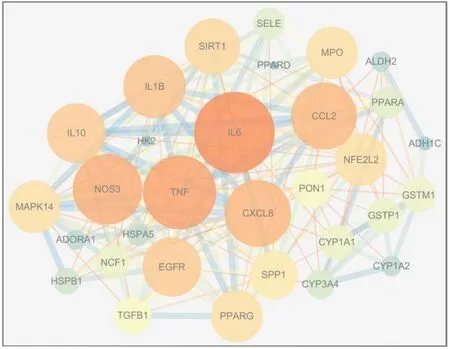
图 3 葛花治疗 ALD 潜在作用靶点相互作用网络
2.4 共同靶点蛋白相互作用网络的分析
将 31 个共有靶点采用 string 平台进行 PPI 网络分析,构建的 PPI网络包括 31 个节点,183 条相互作用连线;将数据导入 Cytoscape3.7.2 中,绘制共有靶点相互作用网络,如图 3,其中 Degree 值越大,表示节点越大、颜色越亮;Combined score 值越大,表示边越粗。并借助 Cytoscape3.7.2 软件对相互作用网络进行拓扑分析,将自由度、介数、中心度均大于中位数的靶点取交集,筛选出 12 个关键靶点,运用 DisGeNET 数据库, 得到蛋白归属信息, 这些靶点可能是葛花治疗 ALD 的关键靶点, 见表 2。 结果显示,关键靶点主要涉及信号分子 (signaling molecule)、 转录因子 (transcription factor)、 水解酶 (hydrolase)、氧化还原酶(oxidoreductase)、核酸结合(nucleic acid binding)、细胞骨架蛋白(cytoskeletal protein)。
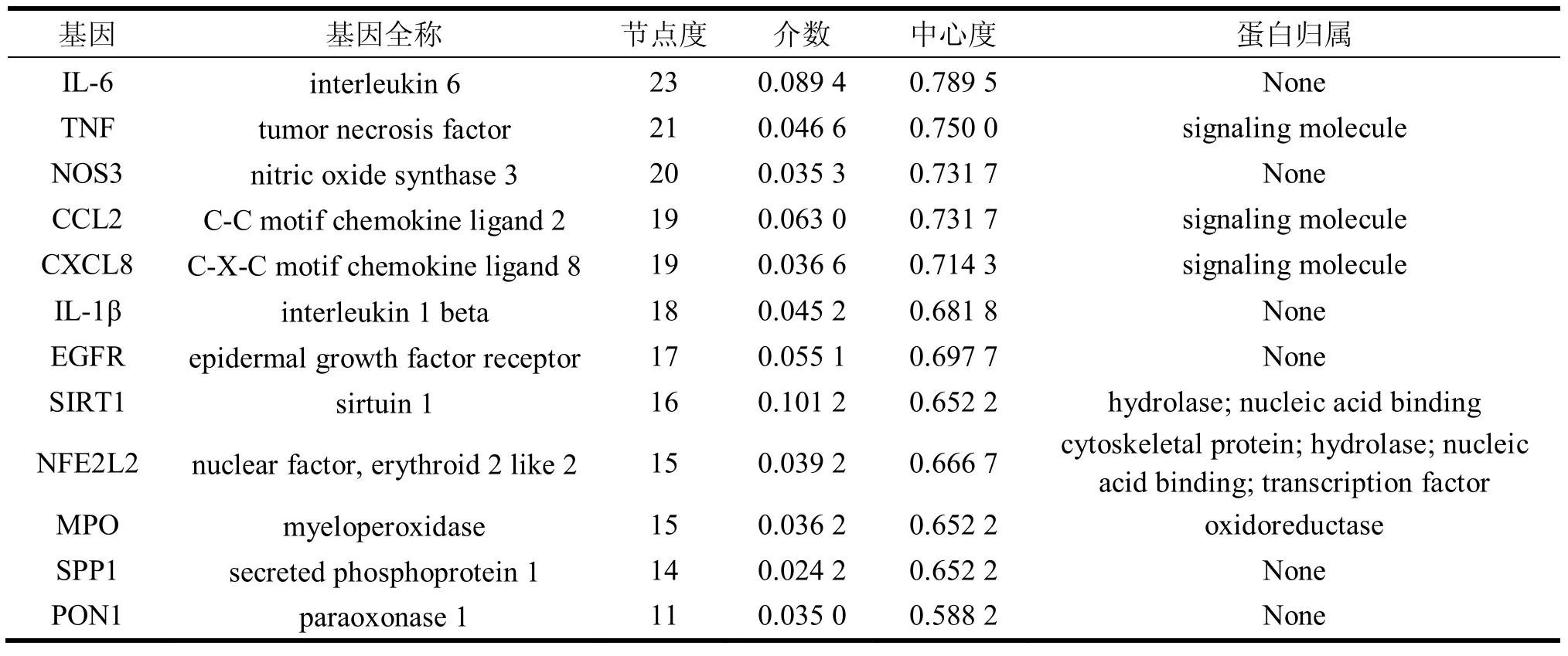
表 2 葛花治疗 ALD 关键靶点基本信息
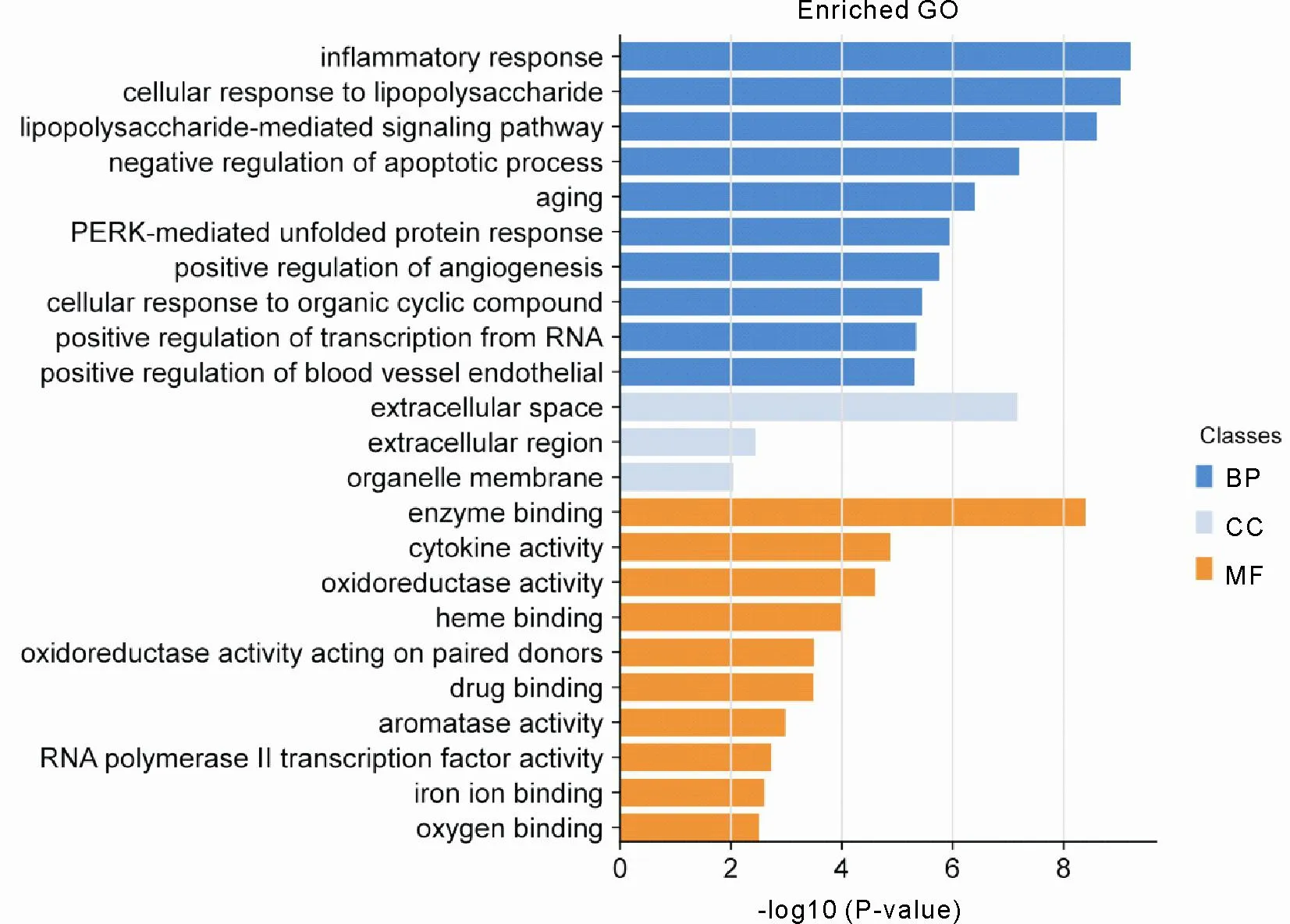
图 4 GO 富集分析
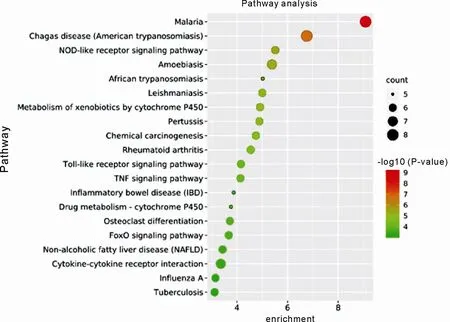
图 5 KEGG 通路分析
2.5 共有靶点的 GO 富集分析与 KEGG 通路注释分析
通过 DAVID 在线数据库对葛花治疗 ALD 的 31 个潜在作用靶点进行 GO 富集分析得到 222 个生物过程、15 个细胞组分以及 32 个分子功能富集结果,根据P<0.01 确定了 95 个生物过程相关条目,主要涉及炎症反应、细胞对脂多糖的反应、脂多糖诱导信号通路、RNA 聚合酶 II 启动子转录的正调控、凋亡过程负调控、血管生成的正调控、PERK 介导的未折叠蛋白反应、细胞对有机环化合物的反应、血管内皮细胞迁移的阳性调节、基因表达的正调控等;3 个细胞组分相关条目,主要涉及细胞外隙、胞外区和胞器膜;19 个分子功能相关条目,主要涉及细胞因子活性、氧化还原酶活性、药物结合、酶结合、血红素结合、芳香酶活性、转录因子活性、铁离子结合、氧结合等。各将排名前 10 的条目进行可视化条形图绘制,如图 4。KEGG 富集分析总获得信号通路 48 条,依据P<0.01 得到 29 条显著信号通路,主要富集于 NOD 样受体信号通路、细胞色素 P450 对外源性药物代谢的影响、Toll 样受体信号通路、TNF 信号通路、炎症性肠病、FoxO 信号通路、MAPK 信号通路、HIF-1 信号通路等。选取P值排名前 20 的信号通路绘制气泡图,如图 5。
3 讨 论
本研究运用网络药理学的方法构建葛花治疗 ALD 的“活性成分-靶点”网络以及 KEGG 富集分析,筛选得到葛花治疗 ALD 的潜在作用靶点 31 个对应其 13 个活性化合物,4 8 条信号通路, 因此葛花治疗 ALD 具有多成分、多靶点和多通路的特点。
筛选出的有效化合物为黄酮类、甾醇类和苯丙酸类等化合物,其中槲皮素(quercetin)、山奈酚(kaempferol)、葛花苷(Kakkalide)、刺芒柄花素(formononetin)等可能是葛花治疗 ALD 的关键化合物。现代药理研究发现槲皮素、山奈酚具有抗病毒、抗氧化、抗炎和增强免疫调节等功效[20-24],且有研究表明,槲皮素是通过抑制促炎因子分泌和提高机体抗氧化能力达到护肝的疗效[25-26],山奈酚可能通过减少自由基的生成而有治疗急性肝损伤的疗效[27], 刺芒柄花素、 葛花苷、 豆甾醇都能抑制炎症反应[28-30],说明这些化学成分在治疗 ALD 过程中具有重要作用。
31 个潜在靶点均存在蛋白互作作用,通过自由度、介数、中心度筛选出 12 个关键靶点,其中炎症因子包括白介素 1β(IL-1β)、白介素 6(IL-6)和肿瘤坏死因子(TNF),参与各种炎症反应的进行,刺激趋化因子如趋化因子 8(CXCL8)、趋化因子 2(CCL2)等的产生,NOS3 具有调节血管张力、减少钙超载和抑制炎性反应等作用,SIRT1、NFE2L1、MPO、PON1 都与抗氧化或氧化应激有关[31-35]。已有研究表明 IL-6、TNF、CXCL8、IL-1β、IL-10 等在治疗酒精性肝损伤中发挥重要作用[36-38]。
对 31 个潜在作用靶点进行 GO 富集分析发现, 葛花治疗 ALD 主要涉及的生物过程有炎症反应、 RNA 聚合酶 II 启动子转录的正调控、血管生成的正调控和凋亡过程负调控等;在分子功能中,主要影响细胞因子活性、氧化还原酶活性、转录因子活性、药物结合、酶结合等。在 KEGG 通路富集分析中发现,葛花治疗 ALD 通路主要涉及 NOD 样受体信号通路、细胞色素 P450 对外源性药物代谢的影响、Toll 样受体信号通路、TNF 信号通路、炎症性肠病、FoxO 信号通路、MAPK 信号通路、HIF-1 信号通路等。现代研究表明,HIF-1 信号通路、TNF 信号通路、Toll 样受体信号通路、MAPK 信号通路、NOD 样受体信号通路、FoxO 信号通路、细胞色素 P450 对外源性药物代谢的影响等与酒精性肝损伤有关[37-41],一定程度上表明网络药理学研究方法的可靠性。
4 结 语
本研究采用网络药理学的方法首次对葛花治疗酒精性肝损伤的作用机制进行了系统的研究。利用 OB 和 DL 值筛选出 18 个有效化合物,其中 13 个化合物与酒精性肝损伤疾病靶点有 31 个共有靶点;共有靶点进行生物信息富集分析,得到 222 个生物过程、15 个细胞组分、32 个分子功能以及 48 条信号通路。该研究充分体现了葛花治疗 ALD 多组分、多靶点和多通路特点,可为进一步研究葛花解酒作用及其作用机制提供参考。但本研究还存在一定的局限性,只能提供初步的探索,后期仍需要进一步的实验来验证本研究的初步探索。

