吸附法脱除高炉煤气中硫化氢的研究进展
刘 升,胡 鑫,罗海兵,刘昌持,潘响明
(中冶南方都市环保工程技术股份有限公司,湖北 武汉 430074)
钢铁行业作为基础性原材料工业,在国家的发展中占据极其重要的地位。我国作为发展中国家,钢铁行业的发展更为重要。但钢铁产量的增加带来了一系列环境污染问题,冶炼过程产生的高炉煤气就含有多种污染气体,H2S作为主要污染气体之一,其有毒且嗅觉阈值极低,低浓度的H2S会引起发热、头晕、头痛、呼吸困难等,高浓度的H2S则会引发窒息甚至死亡,严重威胁人类的生命安全。世界职业安全与保健管理总署(OSHA)定义H2S的浓度低于10mg/m3为低毒性,高于10mg/m3且低于30mg/m3为中等毒性,高于30mg/m3为高毒性[1]。2007年,我国发布的GBZ 2.1—2007[2]中要求工作场所H2S职业接触限制最高浓度为10mg/m3,在2012年发布实施的GB 17820—2012中对天然气中总硫和H2S浓度提出要求,要求一类气中总硫和H2S的浓度分别小于60 mg/m3和6 mg/m3,2019年,生态环境部、国家发展和改革委员会、工业和信息化部、财政部、交通运输部联合发布《关于推进实施钢铁行业超低排放的意见》(以下简称《意见》),推动现有钢铁企业超低排放改造,要求加强源头控制,对高炉煤气、焦炉煤气实施精脱硫。
同时,H2S具有较强的酸性和腐蚀性,会严重腐蚀工业设备及管道,对工业生产造成极大浪费。表1总结了不同浓度的H2S对ASMTA-106碳钢的腐蚀率。
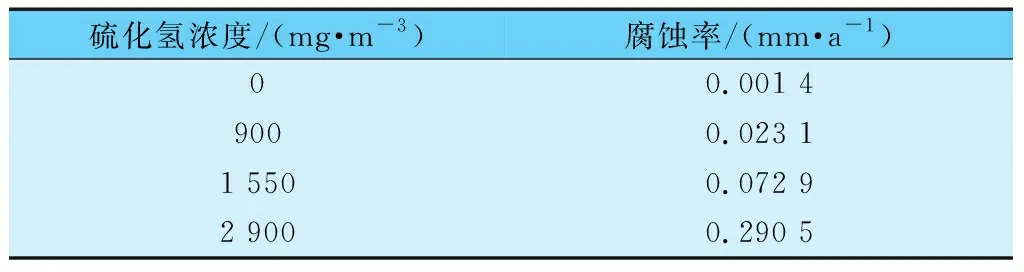
表1 不同浓度的H2S对ASMTA-106碳钢的腐蚀率[3]
此外,H2S燃烧后会生成SO2,是大气污染物之一、导致酸雨的主要前躯体,严重危害人类生存环境。
去除H2S的方法多种多样,根据目前工艺路线可分为干法脱硫和湿法脱硫两类,总体来说,干法脱硫工艺适用性强,无腐蚀,操作简单,但目前吸附材料吸附硫容较小,且不易再生,多用于气量较小、浓度较低的H2S脱除。而湿法脱硫工艺虽脱硫负荷强,脱除率较高,但因其工艺路线易造成设备腐蚀,且运行成本较高,也限制了其在市场的广泛推广。本文将按照湿法脱硫和干法脱硫对H2S的脱除工艺进行介绍。
1 湿法脱硫
湿法脱硫工艺一般采用如水溶液对H2S进行吸收,此时硫的价态不发生变化,如使用醇胺等碱液吸收脱硫,或使用多酸溶液或者螯合铁溶液对H2S进行氧化吸收,此时H2S被氧化成单质硫,进而回收利用。
1.1 醇胺溶液脱硫
1930年,Bottoms第一次采用烷醇胺溶液吸收酸性气体[4],几年后,二乙醇胺(DEA)也被用于脱除酸性气体。随着科研的进步,乙醇胺(MEA)、N-甲基二乙醇胺(MDEA)[5]和二异丙醇胺(DIPA)[6]等醇胺类碱溶液被广泛应用于脱除H2S,其化学反应方程式为:
H2S+R1R2NH→R1R2NH2++HS-
或H2S+R1R2R3N→R1R2R3NH++HS-[7]
其中,相对于其他溶液,MDEA溶液虽碱性较弱,但因其吸收硫容较高,且再生简单,腐蚀性较小,被市场广泛接受[8]。为了提高溶液吸收硫容和脱硫效率,可将MDEA、MEA和DEA等进行混合吸收。醇胺溶液相对于常规型碱性溶液(如NaOH溶液等),其可再生使用是被广泛推广的重要原因。醇胺以及其他碱性溶液适合在较高压力和较低温度下使用,再生则需在低压高温下进行。
1.2 湿法化学氧化脱硫
除使用传统的醇胺溶液脱除H2S外,湿法脱硫所使用的脱硫液还有很多种,但多为化学氧化脱硫,如使用氧化性较强的砷基、铁基、钒基、杂多化合物或酞菁化合物等氧化脱除H2S并回收制备硫磺的脱硫工艺[9]。其中,砷和钒因环保等问题被限制使用。铁基脱硫剂作为绿色环保型脱硫剂更适合现在社会发展的要求,但在脱除稳定性和再生性能上还需进一步优化。而杂多化合物因价格低廉、脱硫效率高且再生简单,逐渐成为具有发展潜力的脱硫剂。
1.3 离子溶液湿法脱硫
离子溶液是由有机阳离子和无机或有机阴离子组成的液体,通常是熔融态的盐或者氧化物[10],与传统水溶液及有机溶液相比,离子溶液因其具有极低的蒸汽压,超过400K的液相区以及密度高于水,同时可与多种极性的物质进行混合,溶解有机物和无机物,这些特质使离子溶液相较于传统的溶剂具有更广阔的应用前景。关于离子溶液脱除H2S的应用目前处于研究阶段,2007年Jou等[11]研究H2S在1-丁基-3-甲基咪唑六氟磷酸盐中的溶解度(见表2),研究表明,压力在9 000kPa时,H2S在离子溶液中的摩尔分数为0.7左右,同时溶解度随温度升高逐渐降低。Huang等[12]通过检测H2S在5种1-烷基-3-甲基咪唑羧酸盐离子溶液中的溶解度发现,H2S在这5种离子溶液中具更高的溶解力,且阳离子的碱度对H2S的溶解也有很大的影响,阳离子烷基链长的增加会促进H2S的溶解。
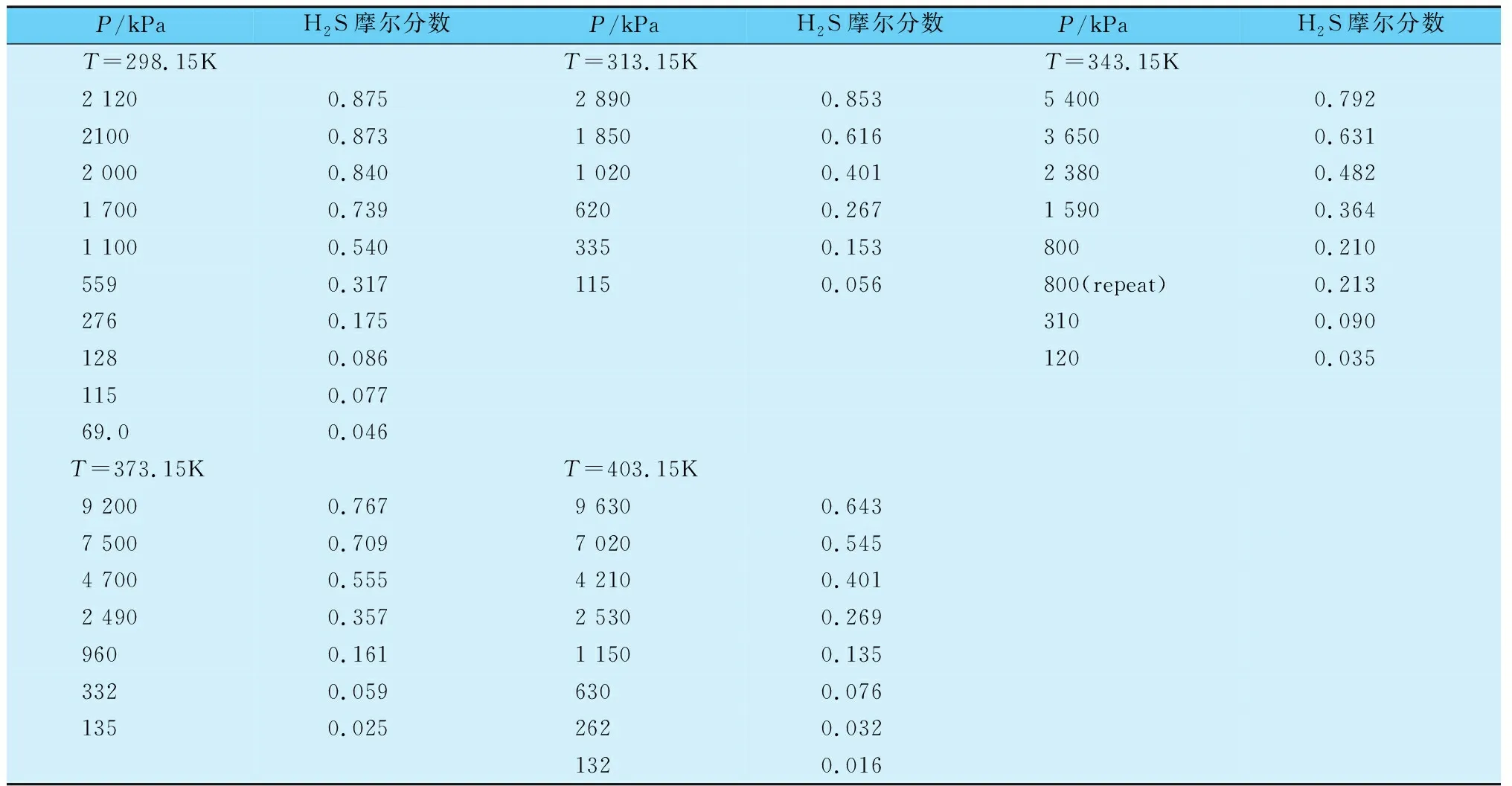
表2 H2S在1-丁基-3-甲基咪唑六氟磷酸盐中的溶解度[11]
2 干法脱硫
吸附材料多选用选择性好和吸附容量高的材料,该类材料对混合物中一种或多种物质表现出较好的吸附性能。与吸收类似,吸附也可分为物理吸附和化学吸附,除分子间相互作用外,分子大小和形状也可作为选择吸附的一种方法。目前,常用的吸附材料有碳基材料、分子筛材料、金属氧化物及其他黏土材料。
2.1 碳基材料吸附脱硫
由于碳基材料孔结构复杂、比表面积大、孔道丰富及官能团复杂多样,其吸附性能极佳。目前,碳基材料主要用于石油、化工、医药、电池以及食品等行业。常用的碳基材料主要以木材、煤、石油沥青、椰子壳等为前躯体,炭化后,经过物理或化学活化制备而成,其中,活化对碳基材料性能影响较大。常用的活化方法有物理活化和化学活化。物理活化分为两步:首先需要对原材料进行炭化,然后选用二氧化碳、水蒸气等气体对炭化材料进行活化处理。化学活化法是先将化学试剂与原料混合进行预处理,然后在惰性气体保护下进行高温焙烧,材料会发生碳化以及活化。常用的活化剂主要有氯化锌、氢氧化钾、磷酸等[13-16]。化学活化处理因其活化时间短、操作简单,且产物性能优异,受到广泛关注。
通常情况下,碳基材料微孔结构丰富,利用范德华力可将H2S分子从混合物中分离出来,吸附在材料的表面。另外,可通过对碳基材料表面进行化学改性,如通过氢氧化钠、尿素、高锰酸钾、氧化物或引入杂原子等对碳基材料进行浸渍改性,从而提高碳基材料的吸附性能[17]。一般来说,通过强碱溶液改性后的碳基材料,多用于H2S的催化氧化,将H2S转化为硫磺[18]。
2.2 分子筛吸附脱硫
目前沸石分子筛有两种,一种是源于自然界,另一种是通过人工合成。目前已发现的天然分子筛共有40多种,而通过人工合成的分子筛已经超过150种[19]。分子筛的基本元素硅、铝、氧,在以铝原子和硅原子为中心的四面体结构的基础上,组合成多面体结构,并按一定规律组合成单位晶胞骨架,然后通过晶胞骨架相互连接组合成多孔材料,其热稳定性相对于活性炭,具有很大优势,可耐高温至1 000 ℃。
沸石分子筛经过金属离子改性后,对H2S的吸附性能可得到显著提高。如Micoli等[20]通过铜离子溶液、锌离子溶液对13X进行改性后发现,铜离子溶液改性后,材料对H2S的脱除性能优于锌离子溶液改性后材料的脱除性能(见图1)。
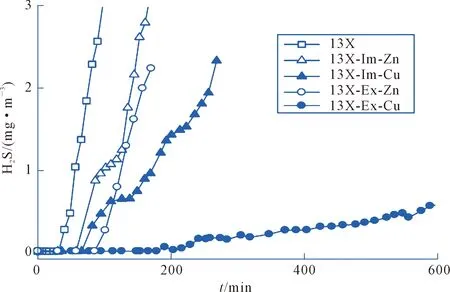
图1 13X分子筛(13X)、Zn离子浸渍13X分子筛(13X-Im-Zn)、Cu离子浸渍13X分子筛(13X-Im-Cu)、Zn离子交换13X分子筛(13X-Ex-Zn)、Cu离子交换13X分子筛(13X-Ex-Cu)对H2S吸附穿透曲线
2.3 金属氧化物吸附脱硫
金属氧化物和碳基材料多被用于H2S的催化氧化,碳基材料多用于低温下催化氧化,而金属氧化物多在高温下进行催化氧化[21]。H2S在催化作用下可直接被氧化成硫磺,一般运行温度可高于或低于硫磺的熔点。目前,常用的技术有Claus工艺[1]、超级Claus工艺及美孚直接氧化法。在催化氧化的过称中,金属氧化物在载体上对H2S进行选择性催化氧化,一般运行温度范围在60~300℃。
金属氧化物同样也可以作为吸附材料对H2S进行吸附,吸附后的H2S多形成液态或者固态的含硫金属化合物,其化学反映方程式如下:

其中,MS为金属硫化物,MO为金属氧化物。再生过程会不可避免形成硫酸盐,因此,其技术的广泛应用受到限制。
2.4 其他吸附材料脱硫
除上述吸附材料可用于脱除H2S外,其他材料如高岭土、蒙脱土等黏土矿物质也可用于脱除H2S[22]。同样,当前新兴的金属有机骨架化合物(MOFs)也被用于脱硫研究[23]。
3 结语
(1)高炉煤气中H2S脱除工艺的选择,不仅要考虑对单一H2S的脱除效果,还要考虑高炉煤气中的二氧化碳、一氧化碳、水蒸气等竞争吸附气体的影响,提高工艺路线的实用性,是今后研究需要关注的问题。
(2)MOFs、新型分子筛等新材料的研发对H2S脱除有重要意义。在提高材料的吸附性能外,应降低材料合成成本,从而提高产品的工业应用价值。
(3)在实际应用中,可将湿法脱硫工艺和干法脱硫工艺进行合理组合,从而提高脱除高炉煤气中H2S的效果。

