花生中FAR 1-5转录因子的克隆和功能分析
闫彩霞,李春娟,孙全喜,张 浩,2,王 娟,苑翠玲,单世华*,赵小波*
(1.山东省花生研究所,山东 青岛266100;2.山东农业大学农学院,山东 泰安271018)
花生(Arachis hypogaeaL.)种植范围广泛,是人类食用植物蛋白质和植物油的重要来源[1]。我国花生生产水平较高,以全球第二的花生种植面积提供了40%以上的产量[2]。但干旱严重影响了我国花生产业持续发展,每年因干旱引起的减产达30%~50%[3]。在干旱半干旱环境下进一步提高花生产量是科研人员面临的严峻现实问题。因此,培育抗旱花生品种,对于花生产业的发展至关重要。传统育种方法由于周期较长,效率相对较低。通过分子生物学技术培育抗旱花生新品种是重要及有效的方法。
FARl(far-red impaired response1)是最初被发现的远红光受体光敏色素phy A下游的信号蛋白。作为信号通路的正调控因子,最初通过图位克隆得到[4]。FARl家族能够稳定地存在于拟南芥基因组中,且无TIR序列(末端反向重复序列)[5]。该家族一个序列与转座酶Jittery[6]和MuRA[5]相似。
FARl能特异地识别启动子FBS顺式作用元件[7],从而调节各类基因表达。目前FARl转录因子相关研究多集中于植物光信号调节方面,涉及非生物胁迫下花生FARl转录因子的研究甚为缺乏。
本研究利用生物信息学方法,分析了花生Ah J11-FAR1-5转录因子的理化特性及系统进化关系,并利用基因过表达法对提高植株抗旱能力的功能进行检验,为花生抗旱育种提供新的基因资源。
1 材料与方法
1.1 RACE克隆与功能验证
所用品种J11,2015年种植于仲恺农业工程学院花山试验基地。取当年饱满一致的高活力花生种子进行转录组测序,FAR1-5转录因子上调表达[8-9],将其命名为Ah J11-FAR1-5。总RNA提取采用杨晨等[10]方法略有改进。
以前期研究为基础设计RACE引物(表1)。提取样品根部组织RNA,采用Clontech公司的SMART RACE试剂盒,并结合巢式PCR方法进行RACE克隆。反应条件依据试剂盒说明书进行。
将测序结果进行拼接后设计全长PCR扩增产物,用UNIQ-10 PCR Purification Kit试剂盒纯化,纯化产物与pGEM-T Easy载体连接后转化至感受态大肠杆菌中,采用菌液PCR扩增预检测是否有插入片段并测序[11],扩增引物为AhJ11-FAR1-5-S1:5'-CGCAGTGGTTTCCAATGGATTT-3'和AhJ11-FAR1-5-S2:5'-GCCACACCTGGGTTGGTGGACCCC-3',全长PCR扩增反应条件如下:①94℃5 min;②94℃1 min;57℃1 min;72℃4 min;共30 cycles;③72℃10 min。
得到全长序列后,参照王传堂的方法(国家发明专利:根癌农杆菌介导的花生高效转基因方法,授权公告号:CN102199621B)进行转基因花生植株构建。通过基因过表达的方式验证该转录因子功能。野生型植株和转基因植株均以15%PEG6000溶液模拟干旱处理5 d后,观察表型变化并检测POD、MAT、SOD和CAT含量[12]。
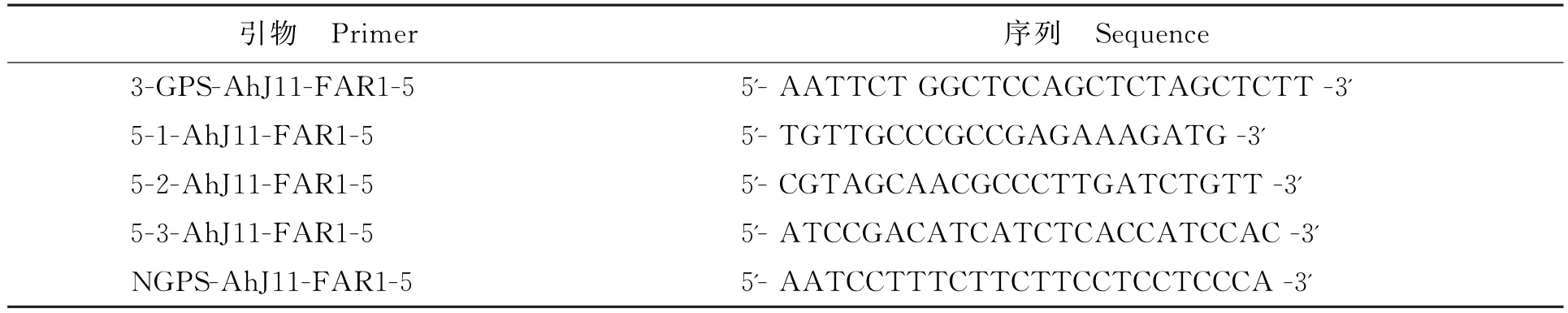
表1 RACE克隆所需引物Table 1 Primers for RACE in this study
图1 Ah J 11-FAR 1-5基因氨基酸序列二级结构Fig.1 Secondary structureof threeAh J 11-FAR 1-5 amino acids

图2 Ah J 11-FAR 1-5基因氨基酸序列的多肽跨膜结合区域Fig.2 Polypeptide transmembrane binding region of Ah J 11-FAR 1-5 amino acid
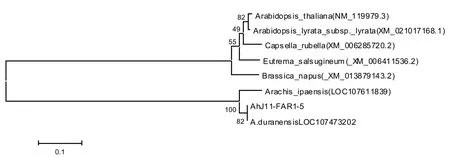
图3 Ah J 11-FAR 1-5基因的系统发育树Fig.3 Phylogeny estimated using Ah J 11-FAR 1-5 sequence
1.2 生物信息学分析
参考花生基因组序列(www.peanutbase.org)对花生Ah J11-FAR1-5转录因子进行生物信息学分析。利用NCBI上的ORF Finder分析获得序列的全长,DNAMAN软件对其氨基酸序列进行理化性质分析。由TMpred程序预测该转录因子编码蛋白质的跨膜结合区域。
通过NCBI检索部分物种相关序列,利用MEGA6.0软件采用NJ法进行FAR1-5转录因子系统进化分析,Bootstrap值设为1000。
2 结果与分析
2.1 克隆结果与生物信息学分析
克隆测序结果表明,Ah J11-FAR1-5开放阅读框为2727 bp,共编码908个氨基酸。其中精氨酸、缬氨酸、甘氨酸含量居前三位,分别为38个、29个和17个,占比分别为9.90%、9.60%和8.36%。其编码蛋白的分子量大小36.415 k D、等电点9.30,其二级结构见图1。预测编码蛋白质的跨膜结合区域,发现由内到外、由外到内的跨膜区域均为1个(图2)。
检索NCBI上部分物种已知相似基因的核苷酸序列,与花生AhJ11-FAR1-5转录因子序列利用MEGA6.0进行聚类分析(图3),Ah J11-FAR1-5转录因子与Arachis duranensis等花生属物种具有较近的亲缘关系,花生属FAR1-5类基因自成一个分支。栽培与野生花生基因组测序结果表明,栽培花生的祖先为野生花生A.duranensis与A.ipaensis,分别与栽培花生A亚基因组、B亚基因组相似度极高[13-14]。
2.2 基因功能验证
正常条件下,野生型与转基因花生表型无明显差异。干旱胁迫处理5 d后,野生型花生萎蔫状态更明显(图4)。正常条件下,野生型与转基因花生MDA水平无显著差异。干旱胁迫下,野生型花生MDA含量显著高于转基因植株。检测结果显示,转基因花生SOD、POD和CAT含量在干旱胁迫下显著高于野生型,转基因植株SOD、POD、CAT含量分别为野生型植株的116%、124%和140%(图5),表明花生Ah J11-FAR1-5基因可以调节植物体内抗氧化酶系统以应答干旱胁迫环境。

图4 干旱处理转基因与野生型花生Fig.4 Drought-treatment assay of wild type and transgenic peanut plants
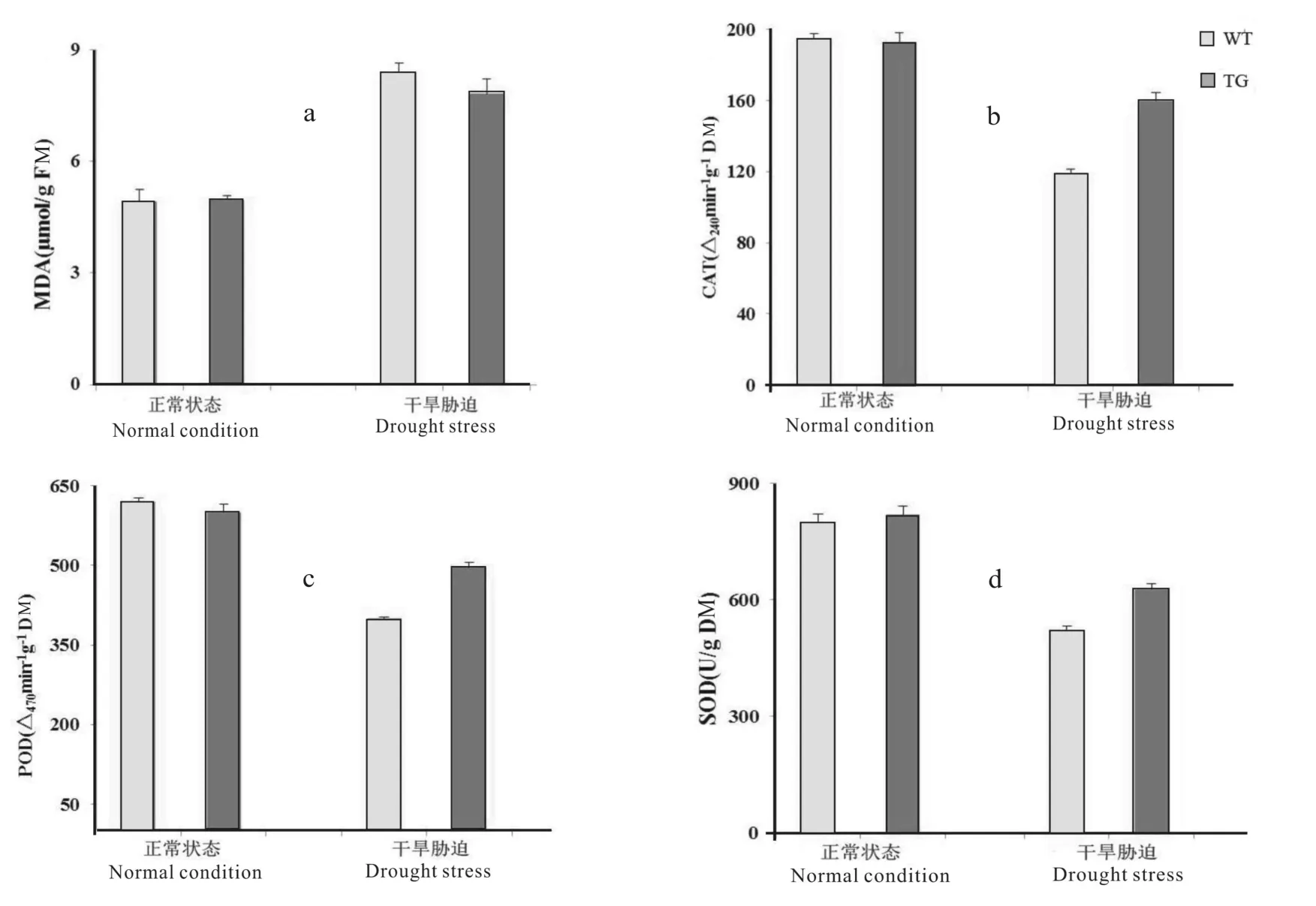
图5 不同状态野生型花生与转基因花生生理指标变化Fig.5 The total activities of the physiological changes in the wild type and transgenic plants under normal condition and drought stress treatment
3 讨 论
目前现有FAR1类转录因子的研究主要集中于植物光形态建成领域。FAR1是phy A信号通路重要的转录因子,通过识别激活含有FBS顺式作用元件的基因协助phy A进入细胞核[15]。
FAR1类转录因子在植物干旱胁迫响应中的研究较少,研究表明过表达FAR1类转录因子,拟南芥的抗旱能力可得到显著增强[16]。本研究中,转Ah J11-FAR1-5基因花生植株相对野生型植株,萎蔫程度更低,MDA含量下降,POD、SOD、CAT含量增加。其作用机制可能为该转录因子正调控ABA(脱落酸)信号响应,可直接激活调控ABI5(ABA insentive5)基因表达。干旱胁迫下,抗旱花生品种ABA含量显著升高,抗氧化酶活性明显升高,膜脂完整性好,渗透调节物质含量高,ABA含量的提高能够明显帮助花生应答干旱胁迫[17]。

