马度米星铵对鲫鱼肝脏细胞色素P450酶系的影响
杨丹,宋昕昊,季春雷,彭麟,高修歌,左儒楠,季辉,江善祥
(南京农业大学动物医学院,江苏 南京 210095)
马度米星铵是一种聚醚类离子载体抗生素,因其具备广谱抗球虫作用、效价高、低耐药性等特点被用于防治鸡球虫病[1-2]。马度米星铵在鸡体内代谢较快且不会被完全代谢,部分以原形药物形式通过鸡粪进入土壤中,进一步污染水体生态环境,对人类和水生生物构成潜在威胁[3]。有文献报道[4],在西班牙地表水中检测到马度米星铵的存在,平均质量浓度为13.2 ng·L-1。已有研究表明,2.5 mg·L-1的马度米星铵会损伤斑马鱼的鳃、肝脏和肠道等主要器官[5]。食用残留有马度米星铵的动物组织能引起人肌肉疼痛、心脏冠状动脉扩张、肝肾功能受损等症状,对人类健康造成严重影响[6]。
细胞色素P450(cytochrome P450,CYP450)酶系是一类亚铁血红素蛋白的超家族酶系,主要分布在肝脏,参与多种内源物质(保幼激素及其类似物、蜕皮甾酮、脂肪酸和信息素等)和外源物质(药物、环境毒物等)在生物体内的代谢,在解毒酶系中占有重要位置[7]。由于CYP450酶系同工酶对外源性物质的高敏感性,已将其作为早期评估和检测水生生态环境系统污染的重要指标[8]。在CYP450酶系中,CYP1~4亚家族在代谢外源性物质的过程中发挥重要作用,它的活性变化可能对动物食品的药物残留产生重要影响[9]。
鲫鱼是我国最常见的淡水鱼类之一[10]。鲫鱼在水生生态系统食物链中具有非常重要的位置,因为其对水体环境的高度敏感性,在毒理学和评价生态风险等方面发挥了重要作用[8,11]。本文以鲫鱼为试验动物,从基因、酶活性和体外肝微粒体孵育3个方向研究马度米星铵对鲫鱼肝脏CYP450酶系的影响,筛选出敏感的生化指标作为马度米星铵污染水体的生物标志物,为生态风险评估提供物质基础;同时初步探讨其毒性机制,为进一步研究马度米星铵在肝脏中的代谢提供依据。
1 材料与方法
1.1 试验药物及试验动物
马度米星铵:含量91.9%,生产批号1701004,浙江汇能生物股份有限公司。
试验鲫鱼平均体质量为(289±25)g,购于南京特给力种植专业合作社,置于聚乙烯塑料箱(60 cm×40 cm×30 cm)内。水源为充分曝气脱氯的自来水,试验期间不间断充氧,水中溶氧量大于6 mg·L-1,pH值约为7,水温(20±2)℃,保持12 h∶12 h的光暗周期。每天更换一半养殖用水并将药物补充至初始浓度。按鲫鱼体质量的1%定时投喂不含抗生素的全价鱼饲料并清理箱底粪便及剩余饲料。试验前驯养1周,自然死亡率低于1%。
1.2 主要试剂和仪器
乙醇、氯化钾和三氯甲烷均购于国药集团化学试剂有限公司;RNAiso Plus、TB GreenPremixExTaqⅡ和PrimeScript RT reagent Kit With gDNA Eraser均购于宝日医生物技术有限公司;检测红霉素-N-脱甲基酶(ERND)、7-乙氧基异吩唑酮-脱乙基酶(EROD)、氨基比林-N-脱甲基酶(APND)、NADPH-细胞色素C还原酶(NCCR)、苯胺-4-羟化酶(AH)的活性和CYP450含量的试剂盒均购于上海江莱生物科技有限公司;微量紫外分光光度计(NanoDrop 2000型)、高效液相色谱仪(UltiMate 3000),美国Thermo Fisher;荧光定量PCR仪(CFX96型)、微型电动匀浆器(1658050型),美国BIO-RAD;多功能酶标仪(Infinite 200 PRO),瑞士Tecan。
1.3 试验方法
1.3.1 试验分组处理采用半静态染毒法,试验时长28 d,设定低剂量组(0.112 mg·L-1)、中剂量组(0.224 mg·L-1)、高剂量组(0.448 mg·L-1)及助溶剂(乙醇)对照组。鲫鱼处死前禁食1 d,分别于染毒后7、14、21和28 d从各组随机取4条,头部穿刺致死,立即取出肝脏,用冰冷的0.15 mol·L-1KCl溶液反复漂洗除去红细胞,滤纸吸干多余水分,置于液氮冷冻后转入-80 ℃保存。
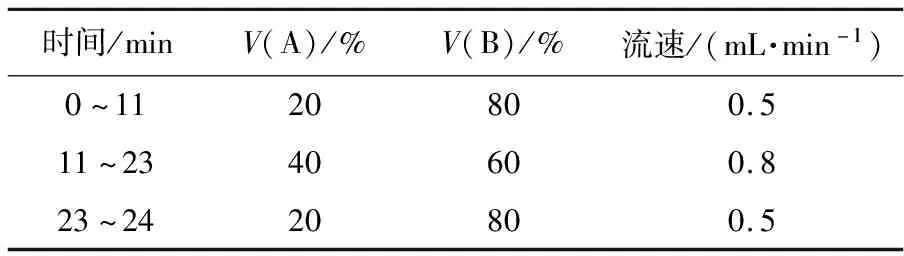
1.3.2 RT-qPCR检测CYP450酶系相关基因表达使用RNAiso Plus试剂提取肝脏总RNA并检测其完整性。采用微量分光光度计确定总RNA浓度和纯度(1.8 表1 荧光定量PCR的引物序列 1.3.3 鲫鱼肝CYP450酶系生化指标测定取肝组织,按1∶9的质量体积比添加预冷的匀浆液(0.25 mol·L-1蔗糖、0.01 mol·L-1Tris、1 mmol·L-1EDTA,pH7.4),用匀浆机冰水浴中匀浆,4 ℃、13 000g离心20 min,取上清液立即检测。ERND、EROD和APND等指标测定均按试剂盒说明书的步骤进行。 1.3.4 对乙酰氨基酚浓度的HPLC检测[13]1)色谱条件。色谱柱:Waters Sunfire C18柱(4.6 mm×150 mm,5 μm),流速0.5~0.8 mL·min-1,检测波长254 nm,柱温40 ℃,进样量100 μL,以甲醇(A)和水(B)为流动相,V(A)∶V(B)依次为20∶80、40∶60、20∶80,采用梯度洗脱程序。洗脱条件见表2。2)对乙酰氨基酚标准曲线。以对乙酰氨基酚和内标(安替比林)峰面积的比值为纵坐标(Y)对对乙酰氨基酚浓度(X)进行线性回归,得出对乙酰氨基酚标准曲线方程。 表2 对乙酰氨基酚的梯度洗脱条件 1.3.5 钙离子沉淀法制备肝微粒体[14]取空白鲫鱼肝组织,按1∶4的质量体积比添加预冷的匀浆液,用匀浆机冰水浴中匀浆,4 ℃、19 000g离心20 min,将1 mL上清液加入0.1 mL 88 mmol·L-1CaCl2溶液,冰浴放置10 min,期间轻轻混匀数次,再于4 ℃、27 000g离心 20 min,向沉淀中加入4倍于肝质量的匀浆液,于4 ℃、27 000g离心20 min,粉红色沉淀即为所需的肝微粒体。将沉淀重悬于含20%甘油的悬浮缓冲液(0.25 mol·L-1KCl、0.01 mol·L-1Tris、1 mmol·L-1EDTA,pH7.4)中,分装,置-80 ℃保存备用。采用Bradford法测定肝微粒体中的蛋白浓度[15]。 1.3.6 体外肝微粒体孵育条件及样品处理孵育体系包括:1 mg·mL-1肝微粒体、133 μmol·L-1非那西丁、1 mmol·L-1NADPH、50 mmol·L-1Tris-HCl(pH7.4),补足体系至600 μL。20 ℃预孵10 min,加入NADPH启动反应后再孵育20 min。反应体系中有机溶剂少于1%。待反应结束后加入150 μL冰冷的甲醇(含内标安替比林)终止反应并沉淀蛋白。涡旋振荡,13 000g离心10 min,吸100 μL上清液进行HPLC测定。 1.3.7 优化体外肝微粒体孵育条件根据肝微粒体孵育活性的影响因素,对肝微粒体蛋白质量浓度(0.2、0.5、0.8、1.0、1.5、2.0和2.5 mg·mL-1)、孵育时间(10、20、30、60、90和120 min)及孵育温度(0、4、10、20、37和45 ℃)分别进行优化。分别以肝微粒体蛋白质量浓度、孵育时间及孵育温度为横坐标(X),以对乙酰氨基酚生成率为纵坐标(Y),选择线性范围内比值最高点作为最佳孵育条件。 1.3.8 马度米星铵对鲫鱼肝微粒体中CYP1A活性的影响向孵育体系中分别加入马度米星铵使其终浓度为1.25、2.50、5.00、10.00、20.00、40.00、80.00 μmol·L-1,采用优化后指标进行试验,其他条件不变。按如下公式计算马度米星铵对CYP1A活性的抑制率,以马度米星铵浓度和抑制率为横、纵坐标,绘制“马度米星铵浓度-抑制率”曲线图。 染毒后7 d,0.448 mg·L-1马度米星铵组CYP1AmRNA表达量显著高于对照组(P<0.05);染毒后14和21 d,0.112 mg·L-1马度米星铵组CYP1AmRNA表达量显著高于对照组(图1-A)。染毒后7 d,0.224 mg·L-1马度米星铵组CYP3AmRNA表达量显著高于对照组(P<0.05);染毒后28 d,0.448 mg·L-1组CYP3AmRNA表达量显著低于对照组(P<0.05)(图1-B)。染毒后21 d,0.448 mg·L-1组CYP4TmRNA表达量显著高于对照组(P<0.05)(图1-C)。此结果提示,染毒后的前21 d,马度米星铵可诱导CYP1A、CYP3A和CYP4TmRNA的表达,但这种诱导作用并无浓度-效应和时间-效应关系。 马度米星铵对各组EROD活性影响的结果显示(图2-A):染毒后7 d,0.112 mg·L-1和0.224 mg·L-1马度米星铵组EROD活性低于对照组,0.448 mg·L-1马度米星铵组活性高于对照组,但均无显著差异(P>0.05);染毒后14、21和28 d,各染毒组活性均低于对照组,其中14和21 d,0.224和0.448 mg·L-1组EROD活性显著低于对照组(P<0.05),而其他染毒组与对照组相比无显著差异(P>0.05)。表明,马度米星铵可抑制EROD的活性,这种抑制作用在21 d后趋于平缓。 图2-B显示:试验期间,马度米星铵处理组ERND活性均低于对照组;除7 d 0.112 mg·L-1组、21 d 0.224和0.448 mg·L-1组的ERND活性与对照组相比无显著差异外(P>0.05),其他染毒组均显著低于对照组(P<0.05);ERND活性随染毒时间的延长呈下降趋势。表明,马度米星铵对ERND活性的抑制作用有一定的时间-效应关系。 图2-C显示:染毒后14 d,0.224和0.448 mg·L-1组APND活性显著低于对照组(P<0.05);后期APND活性逐渐上升并恢复至对照组水平。表明,马度米星铵对APND的活性先抑制后诱导。 图2-D显示:试验期间,马度米星铵处理组的AH活性呈先升高后下降的趋势;染毒后的前21 d,各剂量马度米星铵组AH活性逐渐上升并于21 d达到最高,其中0.112 mg·L-1组活性显著高于对照组(P<0.05),同时AH活性与药物浓度呈负相关;AH活性在28 d下降且均低于对照组,其中0.112 mg·L-1组活性显著低于对照组(P<0.05)。表明,马度米星铵对AH的活性先诱导后抑制,且AH活性和马度米星铵之间在前21 d存在浓度-效应和时间-效应关系。 图2-E显示:马度米星铵组NCCR活性呈先降低后升高的趋势;染毒后14 d,各剂量马度米星铵组的NCCR活性达到最低且均低于对照组,其中0.224和0.448 mg·L-1组活性均显著低于对照组(P<0.05);后期各剂量组NCCR活性逐渐上升并高于对照组,其中0.448 mg·L-1组活性在28 d显著高于对照组(P<0.05)。表明,马度米星铵对NCCR的活性先抑制后诱导。 图2-F显示:染毒后14 d,0.448 mg·L-1马度米星铵组CYP450含量显著低于对照组(P<0.05);在其他时间点,马度米星铵组的CYP450含量呈波动趋势,与对照组相比差异均不显著(P>0.05)。表明,高剂量的马度米星铵在一定时间内会干扰CYP450的合成。 在空白肝微粒体温孵液中加入不同浓度的对乙酰氨基酚标准溶液,使其终浓度分别为66.5、33.3、16.6、8.3、4.2、2.1、1.0和0.5 μmol·L-1,按照1.3.6节处理后进样测定,以对乙酰氨基酚和内标峰面积的比值对浓度绘图,得到回归方程为Y=43.588X-0.093 3(R2=0.999 9)。表明,对乙酰氨基酚在0.5~66.5 μmol·L-1范围内线性关系良好。 由图3-A可知:肝微粒体蛋白质量浓度为0.2~2.0 mg·mL-1时,对乙酰氨基酚生成率呈线性增长,回归方程为Y=9.488X+0.535 6(R2=0.996 2),线性范围内比值最高点为0.8 mg·mL-1;由图3-B可知:孵育时间为20~90 min时,对乙酰氨基酚生成率呈线性增长,回归方程为Y=0.108 3X+8.541 8(R2=0.945 4),线性范围内比值最高点为20 min;由图3-C可知:孵育温度为4~20 ℃时,对乙酰氨基酚的生成率呈线性增长,回归方程为Y=0.683 8X-3.097 6(R2=0.924 6),线性范围内比值最高点为20 ℃。因此,最佳孵育条件为:肝微粒体蛋白质量浓度0.8 mg·mL-1、孵育时间20 min、孵育温度20 ℃。 由图4可知:马度米星铵对CYP1A活性的抑制率小于25%。表明,马度米星铵对鲫鱼肝微粒体CYP1A活性无影响。 在外来化合物的作用下,CYP450酶的活性可以被诱导,也可以被抑制。诱导可能是由诱导剂引起相应基因的转录激活或增加。抑制作用可通过多种途径实现,如抑制蛋白的合成、降低CYP450含量、影响药物氧化过程中电子传递及辅酶的合成等。此外,与酶作用底物结构相似的化合物及抑制性抗体的竞争作用,或缺氧也可抑制CYP450酶的活性[16]。 CYP1A是鱼类中研究最多的一个亚族,在致癌效应的代谢和激活过程中起着重要作用。CYP1A可被百草枯、多氯联苯及多环芳烃(PAHs)等外源污染物诱导表达,可作为持久性有机污染物的检测指标[17-19]。在鱼体内,CYP3A是大部分亲脂性或弱中性有机化合物的主要代谢酶[20]。Zhang等[21]试验表明,CYP3A可作为监测PAHs和重金属污染的候选生物标志物。CYP4T亚家族只在鱼类和两栖类表达,该亚族在鱼体内代谢环境污染物的功能目前还不明确[22]。Liu等[23]研究表明,稀有鮈鲫暴露于全氟辛酸后,鳃中CYP4T11表达量的增加可能是由过氧化物酶增殖物激活受体(PPAR)介导的。本试验结果显示,马度米星铵可诱导CYP1A、CYP3A和CYP4TmRNA的表达,但受时间和剂量的限制,说明CYP1A、CYP3A和CYP4T不适合作为检测马度米星铵污染水体的指标。另外,马度米星铵对CYP4T的诱导作用是否由PPAR途径介导有待进一步研究。 EROD是CYP1A活性的标志酶。EROD是评估鱼类受PAHs影响的生物标志物[24]。Pannetier等[25]研究表明青鳉EROD活性的升高可作为苯并芘污染环境的生物指示物。He等[26]研究表明苯并三唑及其相关衍生物可抑制海洋扇贝的EROD活性。ERND是CYP3A活性的标志酶,对药物进行氧化还原或者水解。Wang等[27]研究表明壬基酚可抑制中华圆田螺ERND的活性。朱雨田[28]研究表明辛硫磷对鲫鱼的ERND活性有抑制作用,可用于监控有机磷农药的污染,这与本文结果相似。ERND对马度米星铵较为敏感且有一定的时间-效应关系,适合作为检测马度米星铵污染水体的生物标志物。EROD和ERND的活性在染毒14 d后均被抑制,推测EROD和ERND在马度米星铵代谢过程中的解毒作用机制可能相似。马度米星铵对ERND的抑制作用强于EROD,说明不同CYP450酶的底物与药物结合可能存在竞争机制,也可能是由于酶的结构存在差异性[29]。此外,马度米星铵诱导CYP3A的表达,却抑制其标志酶的活性,这种抑制作用可能不通过转录水平调控,为今后进一步研究马度米星铵的毒性机制提供了依据。 APND和AH分别是CYP2B和CYP2E1活性的标志酶。本试验结果表明,马度米星铵处理后的前 14 d APND的活性受抑制,之后活性升高并恢复至对照组水平。这可能是机体受到外来物刺激后所表现出的一种自我保护,以缓解抑制效应对生物体机能产生的影响[30]。CYP2E1占肝内CYP450总量的 6.6%,是鱼体内许多低分子有机化合物及药物的主要代谢酶,经CYP2E1代谢的小分子化合物极易通过各种途径污染水域[31]。研究表明,硬骨鱼类具有CYP2E1样的蛋白,能被乙醇诱导且呈剂量依赖效应[32],这与本试验结果一致。我们推测前期机体大量合成的AH会加速马度米星铵的代谢,但合成能力有限(ATP供应不足、氨基酸数量不够等)[33],导致酶活性先升高后降低。 NCCR并不直接参与鲫鱼对马度米星铵的代谢,主要是给CYP450酶系提供电子。本试验结果表明,马度米星铵对鲫鱼NCCR活性有先抑制后诱导的作用,可能是前期马度米星铵对鲫鱼的毒性作用导致NCCR活性下降,后期机体蓄积的马度米星铵中间代谢产物对NCCR活性有诱导作用。 CYP450含量作为常用的诊断指标之一,是对P450蛋白总水平的量度。Fu等[34]研究表明,鲤鱼CYP450含量可以被阿特拉津诱导,但毒死蜱对CYP450含量没有影响。王国永[35]研究表明马度米星铵对鸡肝脏CYP450含量无显著影响。这些与本试验结果不同,可能是由试验药物、试验物种、染毒方式及染毒时间不同引起的。 体外肝微粒体孵育法是在模拟生理环境条件下进行生物代谢研究,易于操作,速度快,重现性好,是研究酶活性最简单有效的方法。本试验以CYP1A的特异性底物非那西丁作为探针,通过测定其主要代谢产物对乙酰氨基酚的含量来评价马度米星铵对CYP1A活性的抑制程度。本试验结果表明,马度米星铵对鲫鱼肝微粒体CYP1A活性无影响,这与体内结果不同,可能是体内外活性有差异或存在其他作用途径影响EROD活性。 综上所述,马度米星铵对鲫鱼肝微粒体CYP1A活性无影响;马度米星铵对ERND活性的抑制作用可能与CYP3A的转录水平无关;ERND对马度米星铵较为敏感,适合作为马度米星铵污染水体的生物标志物,为水环境的生态风险评估提供科学依据。

1.4 数据处理与统计分析
2 结果与分析
2.1 马度米星铵对鲫鱼肝CYP450酶系相关基因表达的影响
2.2 马度米星铵对鲫鱼肝CYP450酶系生化指标的影响
2.3 对乙酰氨基酚的标准曲线的建立
2.4 体外肝微粒体孵育条件的优化
2.5 马度米星铵对鲫鱼肝微粒体中CYP1A活性的影响
3 讨论
3.1 马度米星铵对鲫鱼肝CYP450酶系相关基因表达量的影响
3.2 马度米星铵对鲫鱼肝CYP450酶系生化指标的影响
3.3 马度米星铵对鲫鱼肝微粒体CYP1A活性的影响

