2020年高考(全国Ⅰ卷)化学实验试题评析
罗志勇

一、原题再现
1. 题文。
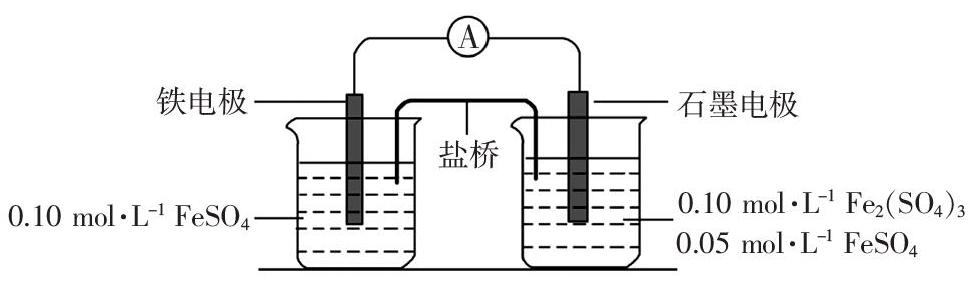
为验证不同化合价铁的氧化还原能力,利用下列电池装置进行实验。
回答下列问题:
(1)由FeSO4·7H2O固体配制0.10 mol·L-1 FeSO4溶液,需要的仪器有药匙、玻璃棒、_____(从下列图中选择,写出名称)。
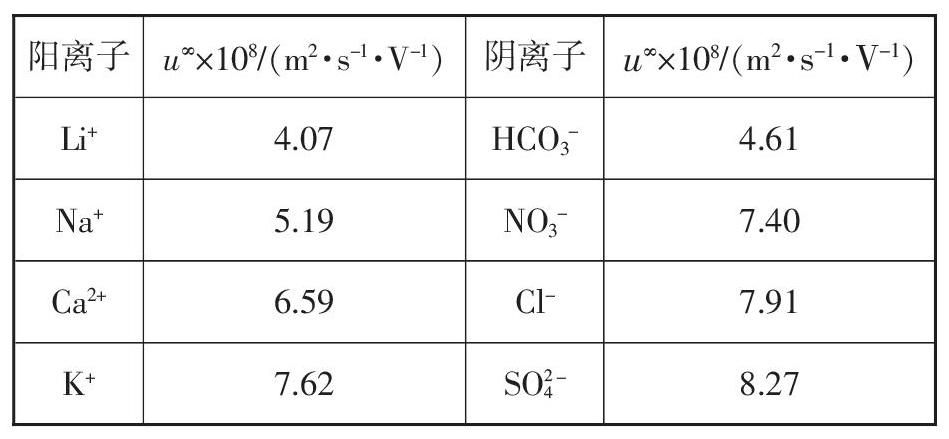
(2)电池装置中,盐桥连接两电极电解质溶液。盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率(u∞)应尽可能地相近。根据下表数据,盐桥中应选择_______作为电解质。
(3)电流表显示电子由铁电极流向石墨电极。可知,盐桥中的阳离子进入_______电极溶液中。
(4)电池反应一段时间后,测得铁电极溶液中c(Fe2+)增加了0.02 mol·L-1。石墨电极上未见Fe析出。可知,石墨电极溶液中c(Fe2+)=________。
(5)根据(3)、(4)实验结果,可知石墨电极的电极反应式为______,铁电极的电极反应式为__________。因此,验证了Fe2+ 氧化性小于________,还原性小于___________。
(6)实验前需要对铁电极表面活化。在FeSO4溶液中加入几滴Fe2(SO4)3溶液,将铁电极浸泡一段时间,铁电极表面被刻蚀活化。检验活化反应完成的方法是____________。
2. 答案与解析。
第(1)小题参考答案为烧杯、量筒、托盘天平。本小题考查配制一定物质的量浓度溶液。题目要求配制0.10mol·L-1 FeSO4溶液,由于溶液浓度的精度要求不高而且FeSO4属于易变质的溶质,所以在配制过程中无需使用精确度达0.01mL的容量瓶。配制过程为:用托盘天平称量出所需FeSO4·7H2O固体,用量筒量取所需体积的蒸馏水,将称量好的FeSO4·7H2O固体转移至烧杯中,将量筒中一部分蒸馏水转移至烧杯中,用玻璃棒搅拌至FeSO4·7H2O固体全部溶解,再将量筒中剩余的蒸馏水全部转移至烧杯,最后用玻璃棒搅拌均匀,FeSO4溶液即配制完成。从配制过程可以看出需要的仪器包括药匙、玻璃棒、托盘天平、量筒和烧杯。
第(2)小题参考答案为KCl。本小题考查盐桥的组成。盐桥是双液原电池中保证电路通路的装置,人教版高中化学选修4中注明“盐桥中通常装有含琼胶的KCl饱和溶液”。本题通过给予信息的形式解释了盐桥中为什么要填充KCl饱和溶液:盐桥中阴、阳离子不与溶液中的物质发生化学反应,并且电迁移率应尽可能地相近。盐桥中阴、阳离子电迁移率应尽可能地相近目的是为了保证盐桥中阴、阳离子从盐桥中进入溶液时的速率相同,降低电池内电阻。Li+、Na+、Ca2+ 和K+ 在溶液中相对稳定,作为盐桥内电解质的阳离子适用范围较广。HCO3-、NO3-、Cl-和SO24- 是常见的阴离子,其中 HCO3-对溶液酸碱度敏感,溶液pH发生变化时容易发生反应;SO24-与上述阳离子的电迁移率相差较大,不符合要求。综上KCl和KNO3均可作为盐桥内的电解质。由于NO3- 在酸性环境下具有一定的氧化性,在原电池工作的过程中可能会对溶液中各离子放电过程造成一定的影响,所以盐桥中通常使用KCl作为电解质。在有Ag+参与的原电池中才使用填充KNO3的盐桥。
第(3)小题参考答案为石墨。本小题考查原电池的工作原理。根据题中所给信息,石墨电极是电子流入的电极,即为原电池的正极,所以电解质溶液中的阳离子向石墨电极做定向移动。盐桥是通过其中的阴、阳离子向电解质溶液做定向移动,实现传导电流的作用。本題石墨电极是原电池的正极,所以盐桥中的阳离子向石墨电极做定向移动,进入石墨电极溶液中。
第(5)小题的参考答案为Fe3++e-=Fe2+,Fe-2e-= Fe2+,Fe3+,Fe。本小题考查化学实验基本思维方法。本小题要求根据第(3)、(4)小题中提供的实验结果,归纳总结实验结论,推导过程见图1。
实验的主要目的是验证不同化合价铁的氧化还原能力,氧化还原能力即得失电子的能力。在石墨电极溶液中Fe2+ 和Fe3+共存,原电池工作时Fe3+ 得电子变成Fe2+,说明Fe3+ 得电子能力比Fe2+ 强,即Fe3+氧化性比Fe2+强。在铁电极溶液中Fe和Fe2+ 共存,原电池工作时Fe失电子变成Fe2+,说明Fe失电子能力比Fe2+ 强,即Fe还原性比Fe2+ 强。
第(6)小题的参考答案为取少量溶液,滴入KSCN溶液,不出现血红色。本小题考查Fe3+ 的检验方法。根据题意可知“铁电极表面刻蚀活化”是利用少量Fe3+与铁电极表面的Fe反应,当活化反应完成时Fe3+ 被消耗完,所以可以通过检验溶液中是否存在Fe3+ 来判断活化反应是否完成。
3. 设问分析。
本题实验的原理是通过电流表测定反应2Fe3++Fe=3Fe2+ 的进行方向,通过反应进行方向判断不同化合价铁的氧化还原能力的强弱。题目设问围绕上述实验目的展开,主要分为基础性问题和分析性问题,基础性问题主要是化学实验基本技能,分析性问题主要是根据实验数据、现象得出结论。详细见表1。
从上表可以看出,本题主要考查理解与辨析、归纳与论证两种能力,属于较低的能力要求。本题设问中的基础性问题涉及粗略配制溶液、常见离子的检验、盐桥的组成等。这些设问从多个角度考查考生对化学实验基础的掌握程度。而分析性问题则考查了考生对本实验的认识程度和考生的证据推理能力,设问层层递进,逻辑严密。通过盐桥中阳离子的移动方向和c(Fe2+)的计算结果作为实验现象,引导考生分析出铁电极为原电池的负极、石墨电极为原电池的正极;再通过电极反应式的书写引导学生分析Fe、Fe2+ 和Fe3+ 的得失电子能力顺序,从而得出实验结论。
二、备考策略
1. 了解实验特点,明确实验目的。
探究性原理实验是通过控制外界条件,调控化学反应,从而说明反应的原理和反映规律的化学实验。探究性原理实验题具有以下几个特点。
(1)以反应原理或规律为主要探究内容。
2020全国I卷实验题的实验内容是比较不同价态铁的氧化还原能力,这是一个通过测定得失电子的先后顺序进而说明氧化还原性强弱的实验,属于反应规律的探究。类似的还有2015年北京卷实验题探究各物质浓度对“2Fe3++2I-=I2+ 2Fe2+ ”平衡的影响和2014年安徽卷实验题探究外界因素对电化学腐蚀的类型的影响等,属于反应原理的探究。
(2)以对比实验为实验方法。
对比实验是探究性原理实验常用的实验方法。通过设计对比实验,实现对外界条件的控制,达到调控化学反应的目的。探究性原理实验中的对比实验有两种思路,一是设计在相同条件下哪种反应物先反应,如2020年全国I卷实验题中提及的Fe和Fe2+、Fe2+ 和Fe3+ 那种粒子先放电的问题;二是设计相同的反应物在不同条件下发生哪种化学反应,如2014年安徽卷实验题中设计铁粉和碳粉在不同的醋酸浓度下发生哪种电化学腐蚀的问题。
(3)以实验现象为实验结果。
通过观察实验现象得出实验结果,归纳出实验结论。由于探究性原理实验需要设计对比实验,以实验现象差异为证据说明问题。2020年全国I卷实验题中就以电流表指示的电子流向作为证据,说明Fe、Fe2+ 和Fe3+ 的放电顺序。而2015年北京高考实验题则以溶液的颜色变化为证据,说明平衡移动的方向。
根据上述探究性原理实验的特点,我们可以知道探究性原理实验的主要目的是通过对比实验的现象差异说明化学反应发生的规律和原理,所以在设计实验过程中是以对比实验的现象差异明显为首要出发点。
2. 掌握基本模型,理顺实验思路。
探究性原理实验是围绕化学反应原理和反应规律展开的,掌握基本实验模型能理顺探究性原理实验的基本思路。在选修模块《化学反应原理》中探究性原理实验的基本模型,详见表2。
上表罗列出人教版《化学反应原理》中部分探究性原理实验的基本模型,这些实验均以对比实验为基本方法,实验现象为实验结果说明化学反应原理或反应规律。学生在一轮复习时可以针对以上各个实验进行分析、归纳和汇总,重点思考这些实验的设计思路、现象与结论之间的逻辑关系,这样可以高效形成探究性原理实验的基本思维方法。
3. 归纳反应规律,开拓实验思维。
探究性原理实验往往以课本基本实验为基础,针对课本实验做出适当延伸,学生在备考过程中应对课本实验进行归纳总结,形成探究性原理实验的基本思维模式。
例如“不同温度下KI、H2SO4和O2反应,比较温度对反应速率的影响”的实验现象为溶液变蓝的快慢,溶液变蓝是由①4I-+O2+4H+ =2I2+2H2O;②I2+淀粉→蓝色物质;两个化学反应同时控制,所以在设计实验时需要考虑溶液变蓝的时间必须由反应①决定才能说明温度对反应速率的影响。
又如“FeCl3、CuSO4对H2O2分解的催化作用对比”的实验现象是放出大量气泡。催化效率较高的催化剂会使H2O2较快分解,H2O2分解的过程中放出大量热,使溶液温度升高,反应进一步加快,这使得反应速率既受催化剂的影响,又受到温度的影响,所以在设计实验过程中需要加入控制溶液温度的措施。
探究性原理实验是探究性较强的实验类型,除了对学生的基本实验技能有较高的要求外,还要求学生能根据实验现象做出一定的分析推理,得到合理的实验结论。这类实验能很好地体现学生“证据推理与模型认知”“科學探究与创新意识”等核心素养。
责任编辑 李平安

