KRAS基因沉默介导MAPK1/MAPK3信号通路对乳头状甲状腺癌上皮间质转化的分子机制研究
张芬, 余建琴, 张怀念
甲状腺癌是内分泌系统的常见恶性肿瘤,其中乳头状甲状腺癌发病率最高[1]。上皮间质转化的出现导致肿瘤细胞丧失上皮细胞特性,促进细胞侵袭和转移[2-3]。逆转上皮间质转化对于抑制乳头状甲状腺癌细胞侵袭转移和改善患者预后具有现实意义。RAS基因已被证实为参与肿瘤发生发展的促癌基因之一[4],Kirsten大鼠肉瘤病毒癌基因同源物(KRAS)为其关键成员,与多类肿瘤的发病显著关联,如胃癌、结肠癌、非小细胞肺癌等[5-7]。与此同时,丝裂原活化蛋白激酶(MAPK)信号转导通路与细胞生长、分化、凋亡等进程关联密切[8]。然而,在分子靶向治疗快速发展的背景下,KRAS和MAPK1/MAPK3信号通路是否介导乳头状甲状腺癌的发病及其调控机制目前暂不清晰。本研究通过临床检测和细胞实验探究KRAS基因沉默介导MAPK1/MAPK3信号通路对乳头状甲状腺癌细胞上皮间质转化的调控机制,以期为乳头状甲状腺癌的诊治提供理论基础。
1 材料与方法
1.1 实验材料 人乳头状甲状腺癌细胞株TPC-1(中国中科院上海细胞库);免疫组化和Western blotting抗体(英国Abcam公司);SP染色试剂盒(中国福州迈新生物技术开发有限公司);DAB显色底物(中国苏州亚科化学试剂股份有限公司);10%胎牛血清(FBS)、DMEM培养基、培养箱(中国上海碧云天生物技术有限公司);Lipofectamin 2000试剂盒(美国英杰生命技术有限公司);Trizol试剂(美国生命技术公司);PrimeScript RT试剂盒(中国大连宝生物工程有限公司);荧光定量PCR仪(美国伯乐生命医学产品有限公司);BCA蛋白定量试剂盒(美国西格玛奥德里奇贸易有限公司);ECL反应液(美国密理博公司);Gel-Pro Analyzer 4.0(美国Media Cybernetics公司);倒置相差显微镜(日本奥林巴斯光学公司)。
1.2 研究对象 收集武汉大学中南医院2015年1月至2017年1月接受甲状腺切除手术的80例乳头状甲状腺癌的癌组织及距离肿瘤边缘>2 cm的癌旁组织。所有患者均经病理及影像学检查明确诊断,且所有患者术前均未行任何抗肿瘤治疗。80例患者中男32例,女48例。年龄29~79(49.3±8.3)岁。将采集的新鲜病理组织标本快速冷冻于液氮中,-80 ℃低温保存备用。本研究内容经过武汉大学中南医院伦理委员会审批,且所有患者均知情同意。
1.3 免疫组化检测KRAS蛋白阳性表达情况 将腺癌和癌旁组织连续切片(厚4 μm),然后贴于载玻片上于68 ℃烤箱烤20 min。二甲苯和乙醇梯度脱水后,滴入3%H2O2后放入37 ℃孵育箱。消除内源性过氧化物酶活性,PBS洗涤切片。甩干后抗原热修复2次,滴加10%山羊血清封闭15 min。加入一抗鼠抗人KRAS单克隆抗体,置于4 ℃冰箱过夜;并加入生物素进行标记的山羊抗鼠克隆IgG二抗,置于37 ℃恒温箱,30 min。使用SP染色试剂盒,按照说明书染色10~15 min。DAB显色3 min,流水冲洗3 min;苏木素复染3 min,蒸馏水冲洗5 min×3次,上述梯度乙醇脱水,二甲苯透明,中性树胶进行封片。
1.4 细胞培养 人乳头状甲状腺癌细胞株TPC-1复苏后用含10%FBS的DMEM培养基培养在5%CO2、37 ℃、饱和湿度的培养箱中。每24小时更换培养液,每72小时进行一次传代。去除培养液,PBS洗2次,0.25%胰酶消化3 min,加入含10%FBS的DMEM培养液终止消化,用移液枪轻轻吹打细胞成单细胞悬液。
1.5 细胞分组及转染 将TPC-1细胞系分为6组:空白组(未转染任何质粒,PBS处理)、NC组(转染阴性对质粒)、siRNA-KRAS组(转染siRNA-KRAS质粒)、SCH772984组(MAPK1/MAPK3信号通路抑制剂处理)、茴香霉素(Anisomycin)组(MAPK1/MAPK3信号通路激动剂处理)、siRNA-KRAS+Anisomycin组(转染siRNA-KRAS质粒+MAPK1/MAPK3信号通路激动剂处理)。将TPC-1细胞以3×105/孔的密度接种于6孔板中,用新鲜完全培养基培养至细胞融合度接近50%~80%时,使用Lipofectamin 2000试剂盒进行转染。置于37 ℃、5% CO2培养箱中培养,6 h后更换成完全培养基,继续培养48 h后,收集细胞。
1.6 qRT-PCR检测KRAS、C-jun氨基末端激酶(JNK)、细胞外信号调节蛋白激酶1(ERK1)、细胞外信号调节蛋白激酶2(ERK2)、E-钙黏蛋白(E-cadherin)、波形纤维蛋白(Vimentin)及E盒结合锌指蛋白1(ZEB1) mRNA水平 用Trizol试剂提取组织和细胞总RNA后,按照PrimeScript RT试剂盒说明书进行反转录合成cDNA,4 ℃保存。在实时荧光定量PCR仪进行扩增,用分析软件iQ5进行定量分析,PCR反应体系:上游下游引物(10 μmol/L)各0.6 μl、cDNA溶液1 μl、SYBR Green I Master 10 μl、dH2O 7.8 μl。反应条件:95 ℃,10 min,1个循环;PCR反应95 ℃,15 s;60 ℃,1 min,40个循环。KRAS、JNK、ERK1、ERK2、E-cadherin、Vimentin、ZEB1及U6引物由北京六合华大基因科技股份有限公司合成,以U6基因作为内参,引物序列见表1。本实验重复3次。此方法同样适用于细胞实验。

表1 各基因的PCR引物序列
1.7 Western blotting检测KRAS、JNK、磷酸化JNK (p-JNK)、ERK1、磷酸化ERK1(p-ERK1)、ERK2、磷酸化ERK2(p-ERK2)、E-cadherin、Vimentin及ZEB1蛋白表达水平 使用含PMSF的RIPA裂解液提取组织和细胞中总蛋白,冰上孵育30 min,12 000 r/min、4 ℃离心10 min,取上清至1.5 ml EP管中,按照BCA蛋白定量试剂盒说明书测定蛋白浓度。调整每个泳道上样量大约为20 μg。采用聚丙烯酰胺凝胶电泳:采用10%分离胶和5%积层胶,调整相应电泳电压分别为120 V和60 V,总计电泳时间约为2 h。后进行15 V半干转10 min,5%脱脂牛奶-TBST封闭1 h。弃去封闭液PBS洗涤5 min,以GAPDH多克隆抗体作为内参,稀释KRAS、JNK、p-JNK、ERK1、p-ERK1、ERK2、p-ERK2、E-cadherin、Vimentin和ZEB1,4 ℃孵育过夜;后滴加辣根过氧化物酶标记的山羊抗鼠克隆抗体IgG二抗,室温孵育1 h。将膜浸入ECL反应液中显色,暗盒曝光后显影;用图像分析软件Gel-Pro Analyzer 4.0对图像进行灰度分析。实验重复3次。
1.8 细胞形态学观察 获得各组稳定表达细胞株后,将细胞置于37 ℃,5%CO2培养箱内培养72 h后,于倒置相差显微镜下观察各组细胞株细胞表型的变化并摄像,以较不同转染组上皮间质转化时细胞形态的改变。

2 结果
2.1 癌组织与癌旁组织中相关基因和蛋白表达情况
与癌旁组织相比,乳头状甲状腺癌组织中的KRAS、JNK、ERK1、ERK2、Vimentin和ZEB1的mRNA水平也明显上调;且KRAS、JNK、p-JNK、ERK1、p-ERK1、ERK2、p-ERK2、Vimentin和ZEB1的蛋白表达水平明显上调;而E-cadherin的mRNA和蛋白表达水平明显下调(均P<0.05,图1,表2、3)。免疫组化显示,KRAS蛋白阳性细胞为棕黄色颗粒(图2),KRAS蛋白在乳头状甲状腺癌组织的阳性表达率为63.75%(51/80),明显高于癌旁组织中的36.25%(29/80),差异有统计学意义(χ2=4.068,P<0.05)。

图1 癌组织与癌旁组织中KRAS、E-cadherin、Vimentin、ZEB1、MAPK1/MAPK3信号通路相关基因的Western blotting电泳条带结果
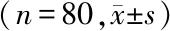
表2 癌组织与癌旁组织中KRAS、JNK、ERK1、ERK2、E-cadherin、Vimentin、ZEB1 mRNA表达水平比较
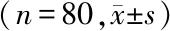
表3 癌组织与癌旁组织中KRAS、E-cadherin、Vimentin、ZEB1、MAPK1/MAPK3信号通路相关蛋白表达水平

图2 KRAS蛋白的免疫组化检测结果(SP法×400)
2.2 KRAS介导MAPK1/MAPK3信号通路相关基因的表达 空白组和NC组信号通路相关基因表达水平均无明显差异(P>0.05)。与空白组和NC组相比,siRNA-KRAS组的KRAS、JNK、ERK1、ERK2的mRNA水平下调,且KRAS、JNK、p-JNK、ERK1、p-ERK1、ERK2、p-ERK2蛋白表达下调(均P<0.05)。Anisomycin组的JNK、ERK1、ERK2的mRNA和蛋白表达水平上调,且p-JNK、p-ERK1和p-ERK2蛋白表达水平上调(P<0.05);KRAS基因表达水平无明显差异(P>0.05)。siRNA-KRAS+Anisomycin组的KRAS基因表达下调(P<0.05);而JNK、p-JNK、ERK1、p-ERK1、ERK2、p-ERK2检测水平无明显差异(P>0.05)。同时,SCH772984组JNK、ERK1、ERK2的mRNA和蛋白表达水平下调,且p-JNK、p-ERK1和p-ERK2蛋白表达水平下调(P<0.05);KRAS基因表达水平无明显差异(P>0.05),见图3,表4、5。
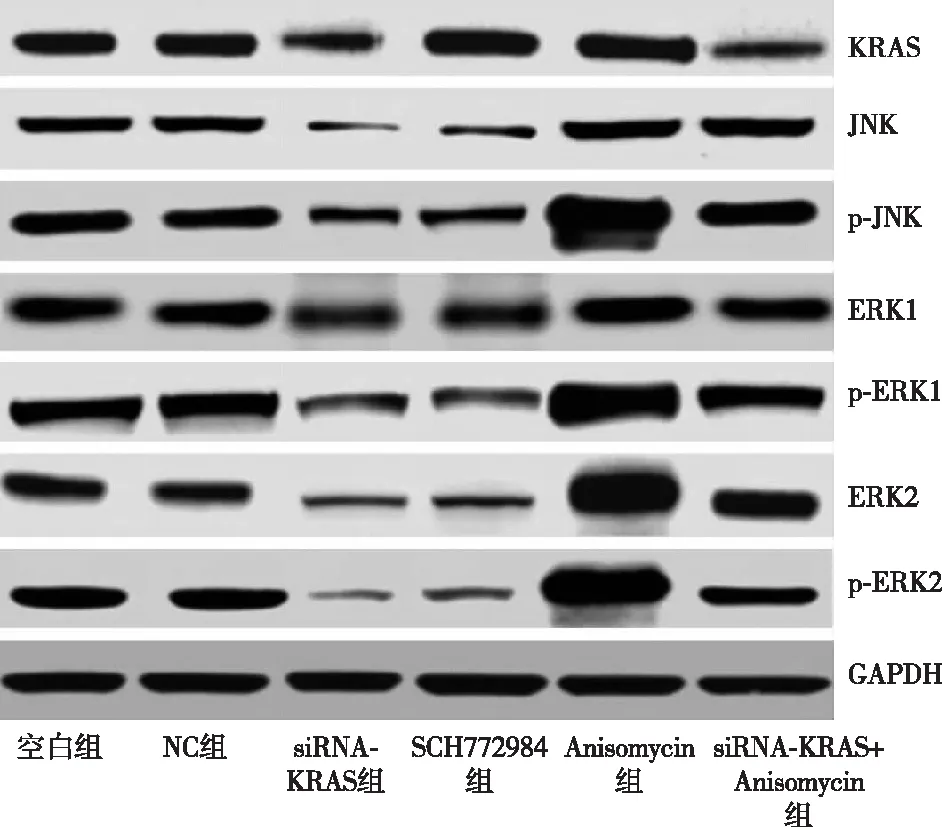
图3 转染后各组细胞中MAPK1/MAPK3信号通路相关蛋白的Western blotting电泳条带结果

表4 转染后各组细胞中MAPK1/MAPK3信号通路相关基因表达水平比较
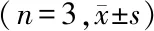
表5 转染后各组细胞中MAPK1/MAPK3信号通路相关蛋白表达水平比较
2.3 KRAS介导MAPK1/MAPK3信号通路影响乳头状甲状腺癌上皮间质转化相关基因表达 空白组与NC组的细胞上皮间质转化相关基因Vimentin、E-cadherin和ZEB1表达均无明显差异(P>0.05);与空白组和NC组相比,siRNA-KRAS组和SCH772984组的E-cadherin表达明显增多,Vimentin和ZEB1表达明显降低(均P<0.05);Anisomycin组的E-cadherin表达明显降低,Vimentin和ZEB1表达明显增多(均P<0.05),siRNA-KRAS+Anisomycin组Vimentin、E-cadherin和ZEB1表达无明显差异(P>0.05),见图4,表6、7。

图4 转染后各组细胞上皮间质转化相关蛋白的Western blotting电泳条带结果
表6 转染后各组细胞中上皮间质转化相关基因的相对表达水平比较

表7 转染后各组细胞中上皮间质转化相关蛋白的表达水平比较
2.4 KRAS介导MAPK1/MAPK3信号通路促进乳头状甲状腺癌上皮间质转化 空白组和NC组细胞上皮间质转化表型变化均无明显差异,细胞呈圆形或类圆形铺路石排列,细胞连接紧密;与空白组和NC组相比,siRNA-KRAS+Anisomycin组的细胞从圆形或类圆形铺路石状上皮细胞形态向梭形、纺锤形间质细胞形态转变不明显,且细胞间黏附改变和细胞集落形成亦不明显;siRNA-KRAS组和SCH772984组的细胞从梭形、纺锤形间质细胞样形态向圆形或类圆形铺路石状上皮细胞形态转变,且细胞间黏附增多,有团簇状聚集现象,细胞集落形成增多;而Anisomycin组大量细胞从圆形或类圆形铺路石状上皮细胞形态向梭形、纺锤形间质细胞形态转变,且细胞间黏附显著变少,细胞集落形成也显著减少,见图5。
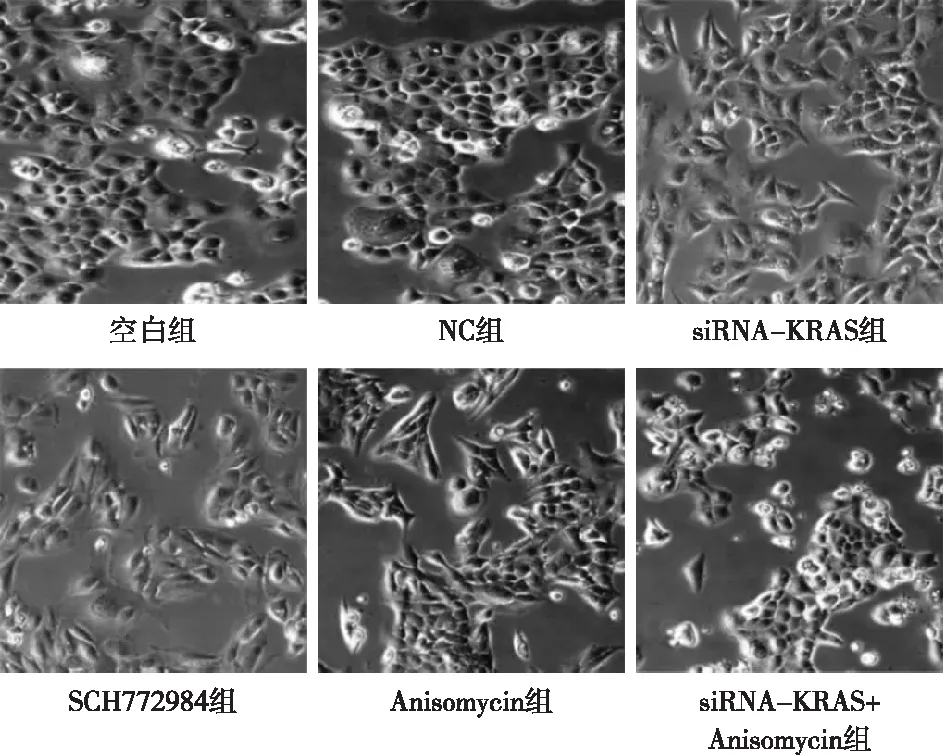
图5 转染后各组细胞上皮间质转化细胞形态比较(×200)
3 讨论
细胞对外界环境变化的反应离不开细胞内信号转导途径的介导[9]。MAPK存在于大多数细胞内,是研究最为深入的信号转导途径之一,其通过对基因的转录和调控影响细胞的生物学行为(增殖、分化、转移、凋亡等),进而广泛参与肿瘤进程[10]。同时,KRAS基因是RAS原癌基因家族成员,其突变过表达常见于恶性肿瘤[11]。鉴于此,本研究假设通过RNA干扰措施沉默原癌基因KRAS的表达,探讨是否可通过调控MAPK1/MAPK3信号通路,进而在乳头状甲状腺癌中发挥一定的抑癌作用。
本研究分为临床组织实验和细胞实验两部分。在临床组织实验中,应用qRT-PCR、Western blotting及免疫组化法分析癌组织与癌旁组织中相关基因表达情况,结果显示癌组织中的KRAS阳性表达率明显高于癌旁组织;且癌组织中的KRAS、JNK、ERK1、ERK2、Vimentin和ZEB1的mRNA和蛋白水平明显高于癌旁组织,而E-cadherin的mRNA和蛋白表达水平明显低于癌旁组织。提示KRAS在乳头状甲状腺癌中扮演原癌基因的作用,同时该类肿瘤患者中可能存在MAPK1/MAPK3信号通路以及上皮间质转化的异常激活。为探究KRAS基因沉默及MAPK1/MAPK3信号通路在乳头状甲状腺癌细胞上皮间质转化的调控机制,本细胞实验通过构建KRAS基因过表达和沉默表达,以此揭示KRAS基因作为乳头状甲状腺癌的作用靶点之一,是否可介导该肿瘤的发病。
本研究首先验证KRAS是否可介导MAPK1/MAPK3信号通路相关基因表达。研究发现沉默KRAS基因表达处理后,KRAS、JNK、ERK1、ERK2的mRNA水平下调,且KRAS、JNK、p-JNK、ERK1、p-ERK1、ERK2、p-ERK2蛋白表达下调。而沉默KRAS基因表达结合MAPK1/MAPK3信号通路激活剂(Anisomycin)处理,导致KRAS基因表达下调[12];而JNK、p-JNK、ERK1、p-ERK1、ERK2、p-ERK2检测水平无明显差异。说明沉默KRAS基因表达可抑制该信号通路的激活。与此同时,Anisomycin组和SCH772984组的KRAS基因表达水平无明显差异,前组表达上调,后组表达水平下调,提示该信号通路激活或抑制转染的有效。同时,鉴于JNK、ERK1、ERK2表达水平的变化,笔者认为MAPK1/MAPK3信号通路的激活或抑制亦有可能影响JNK和ERK信号通路,具体机制尚待进一步研究。
确认KRAS与MAPK1/MAPK3信号通路的关系后,本研究进一步检测KRAS介导MAPK1/MAPK3信号通路对乳头状甲状腺癌上皮间质转化的影响。qRT-PCR和Western blotting检测各组细胞中上皮间质转化标志物Vimentin、E-cadherin和ZEB1的表达。结果显示,与空白组和NC组相比,siRNA-KRAS+Anisomycin组的Vimentin、E-cadherin和ZEB1表达无明显差异;siRNA-KRAS组和SCH772984组的E-cadherin表达明显增多,Vimentin和ZEB1表达明显降低;而Anisomycin组的E-cadherin的表达明显降低,Vimentin和ZEB1表达明显增多。提示沉默KRAS基因表达和抑制MAPK1/MAPK3信号通路激活均可抑制上皮间质转化,表现在Vimentin、E-cadherin和ZEB1表达的异常变化[13-14]。同时,本实验进一步采用光学显微镜观察法,以期佐证沉默KRAS基因表达抑制MAPK1/MAPK3信号通路激活对上皮间质转化的抑制作用。结果显示,空白组和NC组细胞的上皮间质转化表型变化均无明显差异,细胞呈圆形或类圆形铺路石排列,细胞连接紧密;siRNA-KRAS+Anisomycin组细胞从圆形或类圆形铺路石状上皮细胞形态向梭形、纺锤形间质细胞形态转变不明显,且细胞间黏附改变和细胞集落形成亦不明显;siRNA-KRAS组和SCH772984组细胞从梭形、纺锤形间质细胞样形态向圆形或类圆形铺路石状上皮细胞形态转变,且细胞间黏附增多,有团簇状聚集现象,细胞集落形成增多;而Anisomycin组大量细胞从圆形或类圆形铺路石状上皮细胞形态向梭形、纺锤形间质细胞形态转变,且细胞间黏附显著变少,细胞集落形成也显著减少。
综上所述,KRAS基因在乳头状甲状腺癌中呈高表达,沉默KRAS基因表达可抑制MAPK1/MAPK3信号通路,从而抑制乳头状甲状腺癌的上皮间质转化。

