基于学科交叉的维生素C 含量测定实验教学改革
李 欣,赵玉红,张 钧,周 浩,李登文,赵立青,石建党,李小菊,张伟英,张翠竹
(南开大学 生命科学学院 生物国家级实验教学示范中心,天津 300071)
《国家中长期教育改革和发展规划纲要(2010—2020 年)》明确提出:优化学科专业、类型、层次结构,促进多学科交叉和融合[1-3]。学科交叉融合不仅可以拓展学生视野,带来思维的碰撞和启迪,激发学生的自主学习意识和创新实践能力,更有助于推动高等院校学科协同发展,完善具有跨学科视野和协同创新意识的复合型人才培养机制[2-4]。
基础生物化学实验课程是我校生命科学学院生物实验教学中心(以下简称“中心”)面向本校药学专业大二年级开设的基础性实验必修课。以往的实验教学内容来源于本院教师多年教学成果,涵盖了生物化学领域诸多重要基础理论与实验技术,知识体系成熟;但与选课学生专业关联度弱,导致学生学习积极性不高。为此,中心通过开展以跨学科交叉融合为特色的实验教学体系研究,探索并尝试了基于学科交叉的实验教学内容改革,旨在打破生命科学与药学专业课程之间的壁垒[4-5],让学生能够将生物学的理论和方法灵活运用于药学领域的相关研究中,维生素C 含量测定就是改革内容之一。
1 实验内容改革
维生素C(Vc)又名抗坏血酸,是维持机体正常活动的重要维生素之一,广泛参与机体氧化、还原等复杂代谢过程。Vc 是世界卫生组织及联合国工业发展组织共同确定的人类26 种基本药物之一,可用于防治坏血病,增加人体免疫力,辅助各种急、慢性传染性疾病,紫癜以及癌症等多种疾病的临床治疗[6-7]。但Vc 具有强还原性,在氧化剂、热、光、碱性物质以及铜、铁等金属离子的影响下很容易被氧化分解而失效[8-9]。原实验教学内容只是在单一条件下对样品中Vc含量进行测定,并未涉及影响Vc 稳定性诸多因素的考察。而对于药学专业而言,研究Vc 稳定性影响因素对于相关药剂配方、贮存条件和药物配伍都具有重要的实践指导意义。
要考察Vc 稳定性影响因素,首先要选择并建立起科学合理的检测方法。Vc 含量测定方法有很多,如碘量法、2,4-二硝基苯肼法、高效液相色谱法等,但碘量法和 2,4-二硝基苯肼法所用试剂具有一定毒性,而高效液相色谱法成本较高,均不适于受众面广的基础实验教学[10-11]。原教学内容中采用2,6-二氯靛酚滴定法对Vc 进行定量,但2,6-二氯靛酚试剂不稳定,且滴定终点依靠主观判断,对于低年级本科生而言,经常容易因实践经验不足而造成较大误差。因此,改进后的实验内容采用紫外分光光度法检测Vc 含量变化,该方法具有准确稳定、快速简便、试剂安全、成本低廉等诸多优点,且不易受其他还原性物质成分的干扰[12]。
2 主要仪器和试剂
仪器:Nanodrop2000C 超微量分光光度计;水浴锅;酸度计;电子天平等。
试剂:Vc 标准品(购自北京索莱宝科技有限公司,分析纯);碳酸氢钠、焦亚硫酸钠、乙二胺四乙酸二钠、硫酸铜(购自天津市化学试剂供销公司,分析纯);新煮沸后冷却的蒸馏水等。
3 实验方法与结果分析
3.1 溶液的配制
3.1.1 2×Vc 标准储备液(200 mg/L)的配制
准确称取0.020 g 的Vc 标准品置于小烧杯中,用蒸馏水充分溶解;转移到100 mL 容量瓶中,定容至刻度,摇匀后等分成2 份,用碳酸氢钠粉末调节pH,分别配制成pH 6.0 和pH 8.0 的2×Vc 标准储备液。
3.1.2 Vc 标准系列溶液的配制
用移液器准确移取50、100、200、400、500、600、750 μL 的上述pH 6.0 的2×Vc 标准储备液,分别置于1.5 mL 棕色离心管中,用蒸馏水补足体积至1 mL,充分混匀,即配制成终质量浓度为10、20、40、80、100、120、150 mg/L 的Vc 标准系列溶液。
3.1.3 影响因子溶液的配制
2×焦亚硫酸钠溶液:焦亚硫酸钠质量分数为0.4%的水溶液,碳酸氢钠粉末调节pH 至6.0。
100×硫酸铜溶液:硫酸铜质量分数为0.1%的水溶液,pH 6.0。
100×乙二胺四乙酸二钠溶液:乙二胺四乙酸二钠质量分数为2.5%水溶液,碳酸氢钠粉末调节pH 至6.0。
3.2 最大吸收波长的选择
分别将pH 6.0 和pH 8.0 的2×Vc 标准储备液用蒸馏水等体积稀释成100 mg/L 的1×工作液,以蒸馏水作为空白参比溶液,使用Nanodrop2000C 超微量分光光度计在190~840 nm 波长范围内分别对2 种不同pH 的1×Vc 工作液和10%碳酸氢钠溶液进行光谱扫描,结果见图1—3。可知2 种不同pH 值下,Vc 的最大吸收波长均为266 nm,碳酸氢钠在此波长处无吸收。同法检测影响因子溶液在266 nm 处的紫外吸收,结果见图4—6,可见影响因子溶液在此波长处同样无干扰。由此确定紫外分光光度法检测波长为266 nm。

图1 pH 6.0 的1×Vc 工作液光谱扫描结果

图2 pH 8.0 的1×Vc 工作液光谱扫描结果
3.3 标准曲线的绘制
用紫外分光光度法在波长266 nm 处,以蒸馏水为空白参比溶液,依次测定Vc 标准系列溶液的吸光度,结果见表1。以Vc 质量浓度为横坐标,吸光度值为纵坐标绘制标准曲线,见图 7。回归方程为:y=0.0072x+0.0097,R2=0.9997,表明 Vc 质量浓度在150 mg/L 以下与吸光度具有良好的线性关系。

图3 10%碳酸氢钠溶液光谱扫描结果

图4 1×焦亚硫酸钠溶液光谱扫描结果

图5 1×硫酸铜溶液光谱扫描结果

图6 1×乙二胺四乙酸二钠溶液光谱扫描结果

表1 Vc 标准系列溶液浓度对应的吸光度

图7 Vc 标准曲线图
3.4 Vc 稳定性影响因素考察
3.4.1 温度与作用时间对Vc 稳定性的影响
将pH 6.0 的2×Vc 标准储备液用蒸馏水等体积稀释成100 mg/L 的1×工作液,平均分装于3 个棕色试剂瓶中,分别置于室温、70 ℃和99 ℃水浴锅中,在0、15、30、60 min 时间点依次取样,用紫外分光光度法在266 nm 波长下测定吸光度,代入图7 中的线性回归方程,计算Vc 相对含量变化(见表2)。结果表明,随着温度的升高,Vc 含量呈现明显下降趋势,说明Vc对热不稳定,高温会促进Vc 的降解,且降解程度与作用时间呈正相关。
3.4.2 pH 对Vc 稳定性的影响
将pH 6.0 和pH 8.0 的2×Vc 标准储备液分别用蒸馏水等体积稀释成100 mg/L 的1×工作液,并装入棕色试剂瓶,同时置于70 ℃水浴锅中,在0、15、30、60 min 时间点依次取样,用紫外分光光度法在266 nm波长下测定吸光度,由线性回归方程计算Vc 相对含量变化(见表3)。结果表明,在相同温度和作用时间下,Vc 在偏酸性溶液环境中相对稳定,而在偏碱性条件下更易被破坏。
3.4.3 抗氧化剂对Vc 稳定性的影响
将pH 6.0 和pH 8.0 的2×Vc 标准储备液各自分别用蒸馏水和 2×焦亚硫酸钠溶液等体积稀释成100 mg/L 的1×工作液,并装入棕色试剂瓶,同时置于99 ℃水浴锅中,在0、15、30、60 min 时间点依次取样,用紫外分光光度法在266 nm 波长下测定吸光度,由线性回归方程计算Vc 相对含量变化(见表4)。结果表明,在相同温度、作用时间和pH 下,抗氧化剂的加入可以明显增加Vc 的稳定性。
3.4.4 金属离子及络合剂对Vc 稳定性的影响
将pH 6.0 的2×Vc 标准储备液用蒸馏水等体积稀释成100 mg/L 的1×工作液,并装入棕色试剂瓶,按表5 分别加入乙二胺四乙酸二钠溶液和硫酸铜溶液(硫酸铜溶液最后加),使其终浓度为1×,室温静置10 min,用紫外分光光度法在266 nm 波长下测定吸光度,由线性回归方程计算Vc 相对含量变化(见表5)。结果表明,加入铜离子后Vc 含量显著下降,而金属离子络合剂的加入可以有效保护Vc 免受铜离子破坏。

表2 温度与作用时间对Vc 稳定性的影响
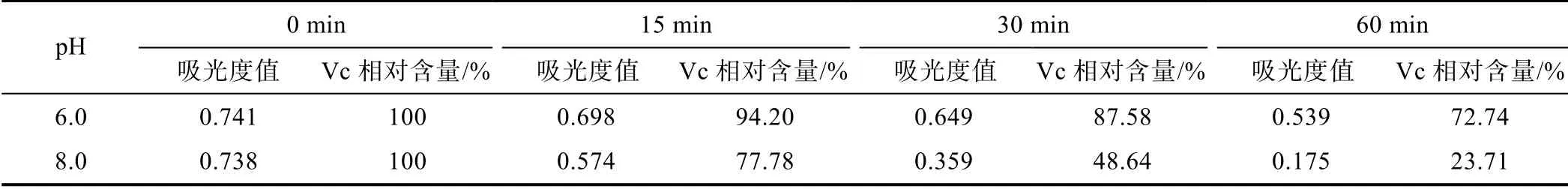
表3 pH 对Vc 稳定性的影响

表4 抗氧化剂对Vc 稳定性的影响

表5 金属离子(铜离子)及络合剂对Vc 稳定性的影响
4 实验讨论
4.1 实验体系中pH 的确定
已有文献报道,不同pH 值下Vc 的最大吸收波长会有所变化:当pH<6.0 时,最大吸收波长紫移;当pH>12.0 时,最大吸收波长红移;而pH 值在6.0~10.0时,最大吸收波长保持一定,且Vc 在pH 为6.0 时性质较为稳定。本实验的前期工作发现,100 mg/L 的Vc 水溶液本身pH 在4.5 左右,紫外分光光度法检测最大吸收波长为247 nm,而用碳酸氢钠调pH 为6.0和8.0 时,最大吸收波长稳定为266 nm,与文献报道一致。因此,本实验选择pH 6.0 的Vc 溶液作为研究对象,并将相关试剂pH 调至6.0~8.0,以使得后续吸光度测定能够在恒定波长下进行,操作更加便捷,结果更加准确。
4.2 实验条件的优化
除了本实验所考查的影响因素外,Vc 对光和水中溶解氧等因素同样不稳定,因此,本实验一方面选用棕色离心管和棕色试剂瓶来装Vc 溶液,尽量减少光照干扰;另一方面,本实验涉及溶液均需要现用现配,所用蒸馏水为新煮沸冷却后的蒸馏水,以尽量减少水中的溶解氧,更严格的做法是在水中通入惰性气体如二氧化碳,这也是Vc 注射液的常用配制方法。除此之外,本实验测定吸光度用到的是Nanodrop2000C 超微量分光光度计的基座模式,其优点是样品用量少,操作简单,只需一个点样步骤后就能够在数秒间给出190~840 nm 的全波长扫描图谱与最大吸收波长下的吸光度值,既节省样品又节省时间,因此能够有效避免因操作时间过长而导致Vc 含量变化,大大降低了实验误差。
5 教学设计
本实验面向药学专业大二年级学生开设,受众面广,实验内容不仅包含多组Vc 稳定性影响因素的考察,还涉及紫外分光光度法的应用以及较多的数据分析,而常规课堂实验学时有限,无法充分满足本实验的教学需求。因此,课程组录制了相关微课和微视频,并挂到专门网站上供学生预习,学生可根据预习内容在网站上与教师进行反馈与互动。通过翻转课堂的教学模式,教师可以在有限的学时里针对关键点和学生薄弱环节进行有的放矢的讲解,提高了学生自主学习能力和实验教学效率。值得一提的是,教师会在课后布置相关的开放性思考题供学生讨论,如“Vc 注射液配制中,除焦亚硫酸钠外,还有什么常用的抗氧化剂,请设计一个实验,考察该成分对Vc 稳定性的影响”,开展课后研讨不仅能够夯实学生的课堂所学,激发学生的学习兴趣,更有利于充分建立课堂知识与学生专业之间的关联,进一步体现学科之间的交叉性,提高学生理论联系实践的能力[13-14]。
6 结语
Vc 是常见的基础药物之一,广泛用于治疗和预防多种疾病,其含量稳定性会直接影响到临床应用。因此,考察影响Vc 稳定性的因素对于药学专业中药物制备、贮存和配伍显得尤为重要。Vc 含量测定是我校生命科学学院面向药学专业开设的常规实验教学项目之一,为突出生物学基础理论与实验方法在药学中的应用,增强生命科学与药学的关联性与交叉性,课程组对原先单一条件下对样品进行定量的实验教学内容进行改革,通过建立准确、便捷、安全的紫外分光光度法,对温度、作用时间、pH、抗氧化剂、金属离子和络合剂等因素导致的Vc 含量变化进行了检测。改革后的实验内容与药学专业领域的研究内容更加契合,对于打破学科知识界限,促进2 个学科知识技能的深度融合,进一步培养学生综合素质与协同创新能力具有积极作用[15]。

