药物性肝损伤伴一过性肝静脉狭窄*1例并文献复习
郝 娟 ,洪金鹏 ,陈嘉屿 △
(1.甘肃中医药大学中西医结合学院,甘肃 兰州730000;2.中国人民解放军联勤保障部队第940医院消化内科,甘肃 兰州730050)
药物性肝损伤 (drug-induced liver injury,DILI)是影响患者、卫生保健提供者、药物开发人员和药物监管人员的主要公共卫生问题,由于缺乏客观的诊断试验、特异的组织病理学特征及临床表现,使得DILI的诊断对临床医师而言仍然是一个重大挑战。现将甘肃中医药大学中医结合学院收治的1例药物性肝损伤伴一过性肝静脉狭窄报告如下,并进行文献复习,以期提高临床认识。
1 病例介绍
患者,女,35岁,因“皮肤巩膜黄染1月”入院。4月前因双侧乳腺增生服用中药(具体不详)“消肿散结”治疗3月,1月前又因“感冒”服用“三九感冒灵”,次日发现小便发黄、逐渐呈酱油色,并出现皮肤巩膜黄染,大便呈陶土色,外院肝功提示:TBIL 186.8umol/L、DBIL 165.6umol/L、ALB 31.6g/L、ALT 1300.5U/L、AST 955.2U/L、ALP 198U/L、r-GT 161.8U/L,PTA 47.4%,腹部CT提示门静脉压力增高,MRCP提示肝实质致密、脉管结构增厚毛糙、轻度脾大,诊断为药物性肝损伤,给予异甘草酸镁、还原型谷胱甘肽、强的松片(40mg 1/d×6d,30mg 1/d×2d)、补充白蛋白及血浆等治疗后无明显好转,以“黄疸待查”收住本院。
入院时患者一般情况尚可,小便量可、色黄,大便呈陶土色、成形、每日1次,近期体重无明显增减。查体:T 36.4℃、P 16次/min、R 74次/分、BP 116/72mmHg。神志清晰,精神欠佳,问答切题。皮肤巩膜重度黄染,面色晦暗。未见瘀斑及蜘蛛痣。双侧乳腺可触及散在大小不等结节、右侧明显,右侧乳腺外上象限可触及3cm×3cm包块,质硬、活动度好,轻触痛,右侧腋下淋巴结可触及,质软,活动好。双肺呼吸音清晰,未闻及明显干湿性啰音及胸膜摩擦音。腹平软,无压痛及反跳痛,肝脾肋下未及,移动性浊音阴性,肠鸣音正常。双下肢无水肿。生理反射存在,病理反射未引出。辅助检查:WBC 11.84×109/L、NEU%78.1%、TBIL 410.10umol/L、DBIL 291.00umol/L、AST 387IU/L、ALT 432IU/L、ALP 113IU/L、γ -GT 115IU/L、α1-MG 4.00mg/L、PTA 66.7%、APTT 38.4sec、AFP 78.45ug/L、CEA 6.77ug/L、IL-6 20.9pg/mL、PCT 0.345ng/mL、内毒素 (G-脂多糖)54.05pg/mL、C3 57.3mg/dL、CRP 0.899mg/dL、TG 2.98mmol/L、apolA1/apolB 0.15,降钙素原、铜蓝蛋白及自身抗体未见异常。入院腹部CT(图1)提示:肝脏及脾脏增大,肝实质密度不均匀减低,门静脉高压;肝右静脉中度狭窄(管径约为0.4cm),肝左静脉及肝中静脉重度狭窄(管径均为0.2cm),以上考虑布加综合征 (Budd-Chiari syndrome,BCS)。腹部 CT 检查提示 BCS,亦不排除有肝小静脉闭塞症 (hepatic veno-occlusive disease,HVOD)可能,为明确诊断行肝穿刺活检,病理(图3、图4)提示肝细胞点灶状坏死,散在淋巴细胞、嗜酸性粒细胞、中性粒细胞浸润,肝细胞内外胆汁淤积,而肝窦、门静脉小分支、中央静脉未见明显狭窄,可排除HVOD。虽然病理改变提示为肝细胞受损,而BCS主要为较大的肝静脉受累,这与腹部CT显示一致,故仍不能排除BCS可能。肝静脉狭窄多考虑与肝损伤导致血液灌注不足有关。目前诊断:DILI合并 BCS,混合型,急性,RUCAM 9 分(极可能),严重程度4级。经予头孢曲松钠抗感染、异甘草酸镁抗炎保肝、还原型谷胱甘肽解毒保肝、丁二磺酸腺苷蛋氨酸利胆退黄等对症处理,监测血常规、肝功提示血象、肝酶及胆红素进行性下降,1月后复查TBIL 59.30umol/L、DBIL 54.10umol/L、AST 43IU/L、ALT 49IU/L、AFP 10.09ug/L,血象、感染指标、凝血功能已恢复正常。复查腹部CT(图2)提示:肝右静脉中度狭窄(管径约为0.6cm),肝左静脉及肝中静脉中度狭窄(管径均为0.4cm)。可见肝静脉狭窄较前明显减轻,患者好转出院。患者出院4月后再次复查腹部CT提示:肝静脉狭窄已完全好转,之前狭窄现考虑静脉充盈不良所致。现回顾之前的诊断,患者多考虑为混合型DILI而并未合并BCS。

图1 腹部CT冠状位重建(肝静脉中重度狭窄)
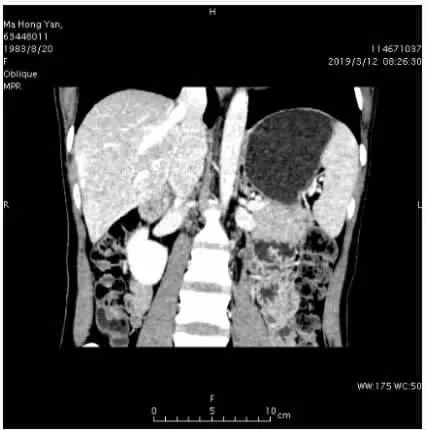
图2 腹部CT冠状位重建(肝静脉狭窄好转)
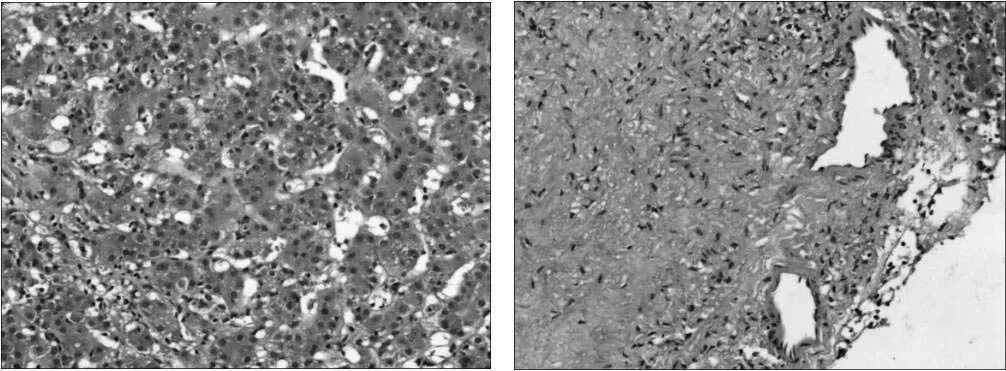
图3 肝脏活检组织病理

图4 肝脏活检组织病理
2 讨论
DILI的发生发展依赖于肝脏特殊的解剖位置和生理生化功能,是一种潜在的危及生命的药物不良反应,也是急性肝衰竭(acute liver failure,ALF)最常见的原因。BCS较罕见但死亡率高,可导致潜在的ALF和门脉高压相关并发症,若不治疗一年存活率为30%,三年存活率仅为10%[1-2],所以尽早诊断及治疗尤为重要。BCS的定义为从肝小静脉到下腔静脉与右心房交界处的肝静脉流出梗阻,但应排除由HVOD引起的肝静脉流出阻塞,这是因为静脉闭塞性疾病是由于内皮细胞损伤使肝细胞萎缩、弥漫性肝纤维化而导致窦状或肝中央静脉阻塞,是肝循环的非血栓性梗阻。HVOD的病理改变通常为肝窦、肝小静脉内皮细胞损伤,中央静脉闭塞甚至消失导致血栓形成,而本例肝脏病理组织改变以肝细胞坏死、肝实质炎症为主,故可排除HVOD可能。欧洲肝脏研究学会2016年发布的肝脏血管疾病临床实践指南中推荐(A1级):任何肝病患者无论有无症状均应考虑BCS可能[3]。本例患者有黄疸、肝脾大及门脉高压等表现,加之影像学检查提示肝静脉中至重度狭窄,起初考虑BCS,肝静脉阻塞型。而肝静脉阻塞型BCS病情凶险,应首选介入治疗,对于ALF患者及危急重症患者应行经颈静脉肝内门腔静脉分流术(transjugular intrahepatic portosystemic shunt,TIPS)和肝移植。反观本例患者,排除病毒性肝炎、自身免疫性肝病等,明确有致急性肝损伤的药物服用史,且经保肝降酶常规治疗患者病情明显好转,腹部CT提示肝静脉狭窄短期内明显减轻,可提示BCS诊断不成立的可能性更大,而肝静脉狭窄多考虑急性肝损伤致肝静脉充盈不良所致,临床需谨慎鉴别以免误诊。
DILI的确切发病率因目前缺乏大规模的流行病学数据尚不能统计,发达国家的DILI发病率估计介于 1/10 万~20/10 万[1,2],而 DILI在我国住院人口中的构成比约为1.69‰,普通人群DILI发生率不低于24.20/10万[3],仅次于病毒性肝炎及脂肪性肝病,因其主要来自回顾性大样本抽样调查,真实发生率可能要远高于目前估计数值。急性肝损伤住院患者中有20%为急性DILI,10%~50%的ALT升高是由药物引起的。国内报道的引起肝损伤的药物主要有传统中药(TCM)、抗感染药、抗肿瘤药、激素类药、心血管药物、非甾体抗炎药(NSAIDs)、免疫抑制剂、镇静和神经精神药物[4],而TCM引起的肝损伤所占比例目前已上升至第一位。本例患者就有明确的TCM及NSAIDs服用史,但由于患者本人不清楚服用何种中药,还未能判断DILI具体由何种药物引起。
按照国际医学组织理事会制订的DILI临床分型标准[5],单纯按R值划分本例DILI为肝细胞损伤型,但结合肝脏生化和病理组织学特点,该患者实际上应考虑为混合型DILI。众所周知,脂溶性药物在肝脏内转化为水溶性物质再通过胆汁或尿液排出体外这一过程会产生有毒性的代谢物,从而引起一系列免疫反应。DILI组织病理学改变不具特异性,常以肝细胞变性坏死、嗜酸性粒细胞及中性粒细胞浸润作为特征性病理诊断标准。Wang等[6]对2003-2014年中日友好医院590例无其他并发肝病的DILI患者进行病理分级,基于肝细胞、胆管上皮细胞、肝血管及肝窦内皮细胞四种肝脏靶细胞提出了新的DILI病理分型:肝细胞损伤型、胆汁淤积型、混合型及肝血管损伤型。其中,肝血管损伤型较罕见,轻者可有肝窦内皮损伤或局部窦样扩张并成形紫癜,重者可致肝内静脉内皮损伤,致肝静脉狭窄甚至血栓形成,最终导致HVOD或BCS的发生。本例确有药物性肝细胞损伤,肝血管损伤机制虽尚不清楚,但不排除肝内静脉内皮损伤导致肝血管灌注不足而引发肝静脉狭窄。
DILI的发病机制十分复杂,Russmann等[7]已经提出了一个三步模型:(1)药物或其活性代谢物直接引起细胞应激;(2)免疫反应被触发;(3)细胞凋亡或坏死。传统观点认为,DILI的发病机制可分为药物直接损伤和特异质肝毒性。药物直接损伤发生在单次、高剂量或药物累积剂量之后,又称为固有型DILI。这一机制是现成的、可重复的,是由药物的毒性代谢物引起的。相反,特异质肝毒性是通过酶与药物代谢物的反应 (代谢特异,即所谓的非过敏反应)或对药物的代谢过敏(免疫特异,即所谓的过敏反应)而发生的[8,9]。这一机制与给药途径、剂量或用药时间没有明显的关系,与宿主受体的遗传变异、免疫应答和代谢途径有关,在一般人群中的发生率较低[10]。在少数具有特定II类人类白细胞抗原(HLA)等位基因的个体中,药物及其反应代谢物可通过抗原递呈细胞 (APCs)刺激免疫系统激活和增殖T细胞,导致肝细胞死亡。目前有五种基本理论来解释特殊药物反应,包括药物代谢、半抗原假说、炎症模型、危险假说和药物相互作用[9]。最近,一些研究报道了其他机制在DILI中也发挥着重要作用。如线粒体功能障碍被认为是DILI发展的中心阶段[11],药物应激使参与脂肪酸代谢、氧化磷酸化、三羧酸循环等代谢过程的线粒体破坏,以致机体的固有循环过程被破坏。线粒体中产生的大量活性氧触发线粒体膜通透性转变和膜电位的破坏,启动肝毒性通路,是导致肝脏损伤的关键步骤[12]。细胞应激和线粒体损伤可导致调节细胞死亡和存活的各种信号转导通路的激活。c-Jun激酶(JNK)信号通路是一种重要的细胞应激成分,持续激活可导致细胞死亡。目前已知JNK从细胞质转移到氧化还原修饰的线粒体,诱导线粒体通透性转变并随后释放凋亡因子[12]。尽管JNK作用重大,但其活化和程序性坏死的程度仍有待确定。细胞色素P450(CYP450)是位于肝细胞内质网上的约30种酶的一个家族,CYP450中的某些多态性与肝毒性有关,CYP3A4和CYP2D6在药物的氧化代谢中起着最为显著的作用[13],可产生活性毒性代谢物导致肝损伤。胆盐输出泵 (the bile salt export pump,BSEP)是一种选择性胆盐转运体,虽不直接参与药物转运,但特异性药物可以抑制BSEP活性。据推测,由药物介导的BSEP抑制而使肝细胞暴露于有毒胆盐中,从而增加了DILI的风险[13]。另有研究显示[14],机体在发生炎症时对药物的敏感性会增加,药物本身或其产生的代谢产物能够直接启动肝细胞凋亡甚至加快凋亡速度。目前对DILI发病机制的研究在代谢组学、转录组学和蛋白质组学等领域也逐步展开,但仍有待进一步评估。
目前对肝损伤的诊断临床主要依靠ALT、AST、ALP、TBIL等指标,但这些指标往往缺乏特异性和灵敏性而使诊断变得困难,随着对肝损伤机制及分子生物学地深入研究,许多新的生物标志物不断被发现和报道,为DILI的诊断提供更广的思路。miR-122是一种在肝脏中高度表达的miRNA,它可能比几种传统的肝酶对肝脏更具特异性。Starckx[15]等在大鼠急毒试验中发现了miR-122明显升高,并与传统生物标志物的升高和组织病理学肝损伤的评价一致。Lee等[16]对32名健康受试者进行阿莫西林-克拉维酸给药监测,也发现miR-122浓度与ALT水平升高高度相关,且变化较ALT水平出现更早也更剧烈,这表明miR-122对肝脏损伤更敏感,显示了其作为DILI早期标志物的潜力。脂肪酸结合蛋白1(fatty acid-binding protein 1,FABP1) 是参与脂肪酸摄取、转运和代谢的细胞内脂结合蛋白,当肝细胞受损时被释放入血。Mikus等[17]通过应用抗体磁珠序列的方法对DILI患者血清蛋白进行分析,发现FABP1水平在DILI组显著升高,在组织分布与动力学方面,比ALT具有更突出的特性。由于其在心肌及骨骼肌中不表达,故可作为DILI的特异性指标。已有研究表明,鸟氨酸氨基甲酰转移酶(OCT)是一种主要在肝脏中表达的线粒体蛋白,与ALT一样是由人类受损的肝细胞释放出来的。Furihata等[18]通过七种潜在的肝毒性药物,阐明OCT在体外从大鼠原代肝细胞中的释放过程,发现所有被试药物均能观察到受损肝细胞的OCT释放,其释放动力学既大于ALT又有着ALT不具有的随被测药物的不同而不同的优势,这将有助于更好地了解临床和药物开发环境中的毒性类型。整合素(Integrin)家族成员是一种细胞表面结合蛋白,参与介导粘附和行使信号传递等多种细胞生物学过程。Dragoi等[19]通过双氯芬酸钠诱导DILI使用蛋白组学分析MH细胞确定特异性生物标志物,发现整合素β3(ITGβ3)在MH细胞中特异性上调且在受损肝细胞中聚集,并通过流式细胞术分析和肝活检组织染色为ITGβ3作为DILI早期生物标志物提供了证据。同时ITGβ3可以像肝酶一样易被评估,也能够识别肝损伤的原因,还可以用于预后评估。虽然这些新的生物标志物的特异性和敏感性以及如何在体外液体检测中保持稳定、可靠、易于检测尚需充分验证,不过组学时代的到来已经给DILI的早期诊断带来了科学突破的希望和期待。

