miR-24-3p靶向MMP-16对鼻咽癌5-8F细胞侵袭、迁移和裸鼠成瘤的影响①
徐 杰 徐 鹏 李梦娇 任建兰 刘俊玲 郎锦义
(西南医科大学临床医学院肿瘤科,泸州 646000)
鼻咽癌(nasopharyngeal carcinoma,NPC)是常见的头颈部肿瘤,具有明显区域性,常见于我国华南地区[1]。目前我国大部分NPC患者病理类型为低分化型或未分化型非角化性癌,占比95%以上,平均自然生存时间约为18.7个月[2,3]。微小RNA(miRNA)是一类长度约22 bp的内源性非编码RNA,是生物体内重要的转录基因调控因子,在细胞增殖与凋亡中发挥重要作用[4,5]。王路等[6]研究表明,miR-24与NPC的发生发展密切相关。李吉茜等[7]研究表明其可抑制NPC细胞增殖。本文研究miR-24-3p 靶向作用于MMP-16对NPC 5-8F细胞侵袭、迁移和裸鼠成瘤的影响,阐明其作用机制,为NPC治疗提供理论依据。
1 材料与方法
1.1材料
1.1.1细胞组织标本 NPC 5-8F细胞购自中国科学院细胞库。收集NPC患者肿瘤样本及癌旁组织34例,男18例,女16例,年龄23~67岁,平均年龄(45.13±10.25)岁;体质量40~82 kg,平均体质量(61.28±8.59)kg,低分化鳞状细胞癌30例,泡状核细胞癌患者4例。癌旁组织为用免疫组化ABC法染色距病灶2 cm的组织,光镜下可见细胞浆或核被染成黄色或棕色,-80℃冰箱备用。
1.1.2实验动物 SPF级3周龄雄性裸鼠30只,由北京维通利华实验动物技术有限公司提供,许可证号:SCXK(京)2017-0022,5只/笼,饲养于我院动物中心实验室。
1.1.3药物与试剂 RPMI1640培养液、胎牛血清和0.25%胰蛋白酶均购自美国Gibco公司;MMP-16抗体购自北京傲锐东源生物科技有限公司;LipofecamineTM2000购自美国ThermoFisher公司; Reverse transcriptase Kit反转录试剂盒购自上海联迈生物工程有限公司;TRIzol、SYBR PCR Master Mix试剂盒购自日本TOYOBO公司;中性福尔马林、酒精、二甲苯购自天津科密欧有限公司。
1.1.4仪器 BS-124s 型电子天平购自北京赛多斯仪器系统有限公司;TDL-5 型台式离心机购自上海安亭科学仪器厂;光学显微镜购自东莞市同创仪器有限公司;切片机购自德国Leica公司;低温离心机购自湖南恒诺离心机有限公司;蛋白电泳及转膜仪购自美国Bio-Rad公司;ABI9700 PCR仪购自上海赛默生物科技发展有限公司。
1.2方法
1.2.1建模 参考文献[8],裸鼠右前肢皮下接种过表达miR-24 的5-8F细胞,3.5×107个/ml、0.2 ml/只,隔日观察肿瘤生长情况及小鼠一般情况。
1.2.2细胞培养 NPC 5-8F细胞培养于含10%FBS、100 U/ml 青霉素和100 U/ml链霉素的RPMI1640培养基,37℃、5%CO2,取对数生长期细胞进行实验。
1.2.3细胞转染 细胞传代培养于6孔板,培养24 h后进行细胞转染。根据转染试剂盒说明书将目的基因miR-24-3p转染于5-8F细胞(转染前1 d接种2.5×105个细胞至含2 ml完全培养基的6孔板,铺板密度为45%左右,siRNA浓度为30 nmol/L,6 h 后弃培养基换成完全培养基继续培养,48 h后收集细胞,进行后续实验。
1.2.4RT-PCR检测MMP-16及miR-24-3p表达 TRIzol试剂提取组织样本及各组细胞总RNA,测定RNA浓度和纯度,茎环法逆转录,Reverse transcriptase Kit反转录试剂盒合成cDNA,PCR扩增,SYBR PCR Master Mix试剂盒检测miR-24-3p和MMP-16表达水平。引物均采用Primer 3网站设计,由Takara公司合成。MMP-16引物序列:F:5′-CTGAAGCTGATGAAGCAGCC-3′,R:5′-AGTCCAAGAG-AATGGCCGAG-3′,miR-24-3p引物序列:F:5′-TGCTGTGTAGTGTTTCCTACTTTATGG-3′,R:5′-CCTGTTGTAGTGTTTCCTTTTATGGAG-3′。
1.2.5荧光素酶报告实验检测miR-24与MMP-16靶向关系 扩增包含靶基因与miRNA互补位点的3′UTR序列及mutant序列,上下游引物5′端各含有不同的酶切位点,电泳检测目的条带,观察条带大小,试剂盒纯化PCR产物备用,配制连接反应混合液,接种/转染后于96孔板加入1×Passive Lysis Buffer,20 μl/孔,移液枪反复吸打裂解细胞吸出15 μl,加入至luciferase assay substrate混匀,酶标仪500 nm处检测并记录数据,2次测得数据的比值代表各孔样本的相对荧光强度。
1.2.6Transwell实验检测细胞侵袭情况 将转染后的细胞传代培养于基质胶预包被的Transwell小室,1×105个/ml,取细胞悬液200 μl加入Transwell小室上室,无血清培养液培养,小室下层加入含血清的细胞培养液。培养24 h后用无菌棉签擦去小室内细胞,用结晶紫对侵袭至小室下层的细胞进行染色,每孔随机选取5个视野进行计数,每组设3个复孔,重复3次。
1.2.7Western blot检测蛋白表达 取对数期细胞,吸除培养皿中的培养基保存于灭菌离心管。1 200 r/min 离心10 min后加入裂解液重悬细胞,BCA法测定蛋白浓度,加入5×SDS凝胶电泳缓冲液,100℃变性 10 min,待电泳分离完全后,半干法将蛋白移至PVDF膜,5%脱脂奶粉室温封闭2 h后加入各检测蛋白的特异性一抗(GAPDH 1∶10 000)和(兔抗MMP-16,1∶1 000),4℃孵育过夜,加二抗(1∶1 000),孵育2 h,TBS洗净,以β-actin为内参,显色液显色后行吸光度分析,计算各蛋白相对表达量。
1.2.8划痕实验检测细胞迁移 实验前1 d于12孔板背面划平行的5条直线,消毒灭菌后置于无菌环境备用。第2天将细胞传代培养于12孔板,1×105个/ml,转染48 h,10 μl枪头垂直于培养板背面横线划痕。预冷PBS洗涤3次,每次5 min,加入无血清培养液继续培养24 h,分别于0 h和24 h于荧光显微镜下每孔随机选取3个视野记录。
1.2.9免疫组化检测MMP-16阳性表达 取各组裸鼠肿瘤组织样本,多聚甲醛固定,制成组织切片,MMP-16免疫组化染色:将组织切片用二甲苯溶液浸泡5 min/次,重复2次;后梯度乙醇水合,依次在无水乙醇、95%乙醇、85%乙醇、70%乙醇中浸泡5 min;PBS浸洗3次,加入2滴3% H2O2-甲醇溶液,孵育10 min,PBS清洗3次;加入血清封闭20 min,一抗、二抗依次室温孵育30 min,PBS清洗3次,DAB显色、复染、脱水封片,显微镜下观察组织中蛋白表达。
1.3统计学处理 采用SPSS20.0软件和GraphPda Prism5软件对数据进行处理和分析,方差分析采用单因素方差分析,当组间差异有统计学意义时,进一步采用SNK方法进行比较;P<0.05表示差异有统计学意义,本研究所有检验均为双侧检验。
2 结果
2.1miR-24-3p表达情况 与NPC肿瘤样本相比,癌旁组织miR-24-3p表达显著升高(P<0.05,图1A)。与空白对照组相比,阴性对照组miR-24-3p表达差异无统计学意义(P>0.05);与阴性对照组相比,目的基因组miR-24-3p表达显著升高(P<0.05,图1B)。
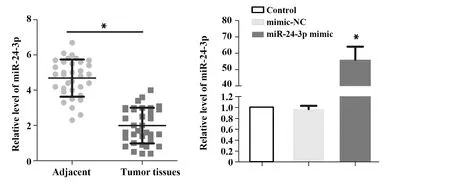
图1 miR-24-3p表达情况Fig.1 Expressions of miR-24-3pNote:Compared with mimic-NC,*.P<0.05.
2.2Transwell检测细胞侵袭情况 与空白对照组相比,阴性对照组细胞侵袭情况无明显变化,且单位面积内侵袭细胞数目差异无统计学意义(P>0.05);与阴性对照组相比,目的基因组单位面积内侵袭细胞数目显著降低(P<0.05),见图2。
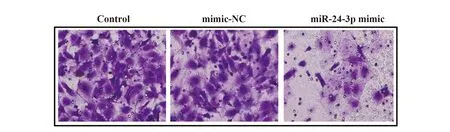
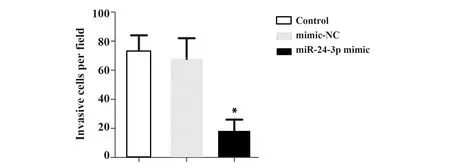
图2 Transwell检测细胞侵袭情况(×400)
2.3划痕实验检测细胞迁移情况 与空白对照组相比,阴性对照组细胞迁移情况无显著变化,且24 h细胞划痕愈合率差异无统计学意义(P>0.05);与阴性对照组相比,目的基因组24 h细胞划痕愈合率显著降低(P<0.05),见图3。
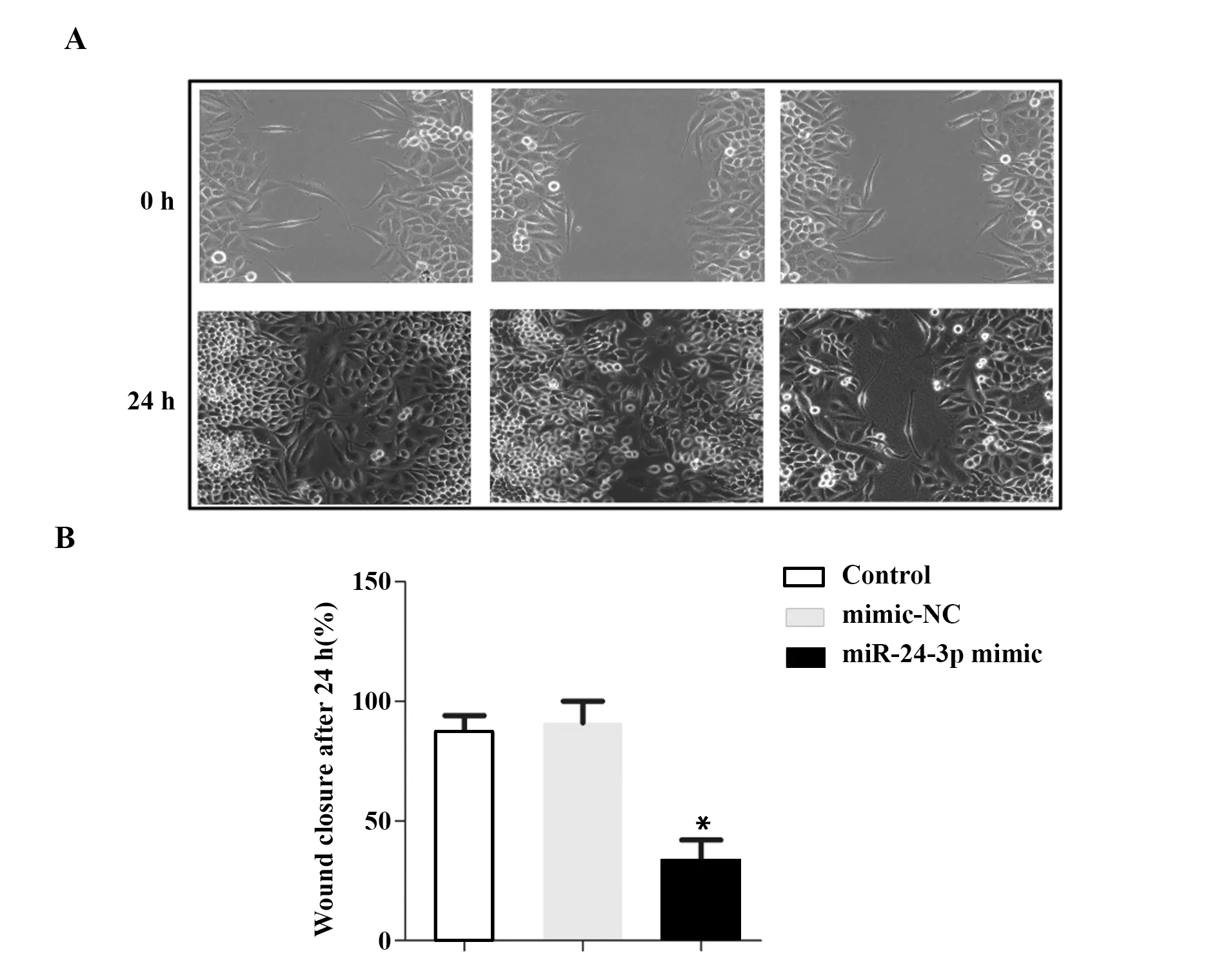
图3 划痕实验检测细胞迁移情况(×400)Fig.3 Cell migration detected by scratch assay(×400)Note:Compared with mimic-NC,*.P<0.05.
2.4miR-24 与MMP-16靶向关系 miR-24 与MMP-16存在互补位点,见图4A;NPC肿瘤样本MMP-16表达显著高于癌旁组织(P<0.05),见图4B;与空白对照组相比,阴性对照组MMP-16表达差异无统计学意义(P<0.05),见图4C;与阴性对照组相比,目的基因组MMP-16表达显著降低(P<0.05),见图4D;与阴性对照组相比,目的基因组MMP-16蛋白表达显著降低(P<0.05);miR-24 mimic显著降低MMP-16野生质粒的荧光素酶活性,但对其突变质粒荧光素酶活性无明显影响,表明miR-24 与MMP-16存在靶向调控关系。
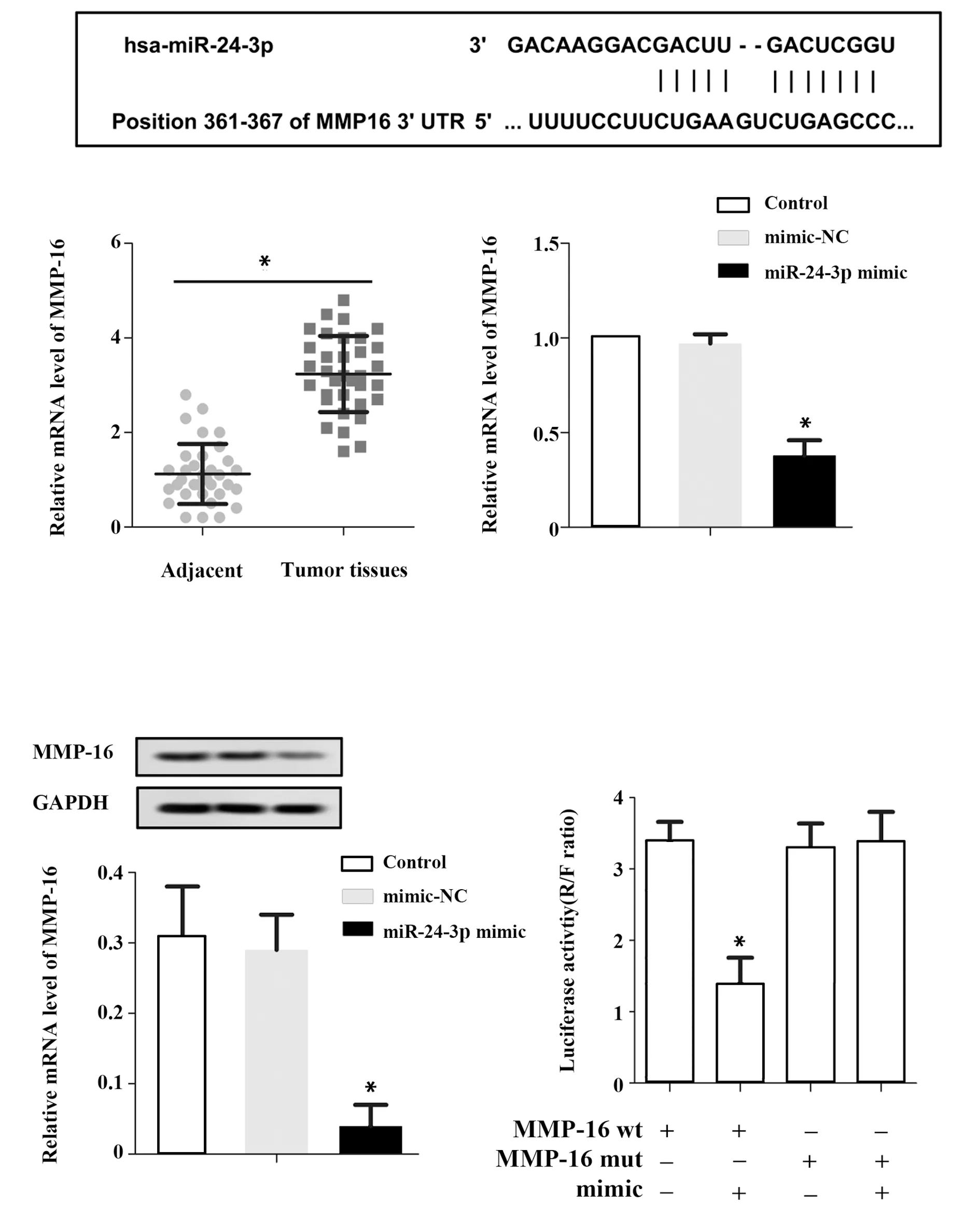
图4 miR-24 与MMP-16靶向关系检测情况Fig.4 Detection on targeting relationship between miR-24 and MMP-16Note:Compared with mimic-NC,*.P<0.05.
2.5过表达miR-24对5-8F细胞裸鼠成瘤的影响 与空白对照组相比,目的基因组裸鼠肿瘤组织miR-24-3p表达显著升高(P<0.05,图5A),肿瘤重量显著降低(P<0.05,图5B),MMP-16蛋白表达显著降低(P<0.05,图5C),MMP-16阳性率显著降低(P<0.05,图5D)。
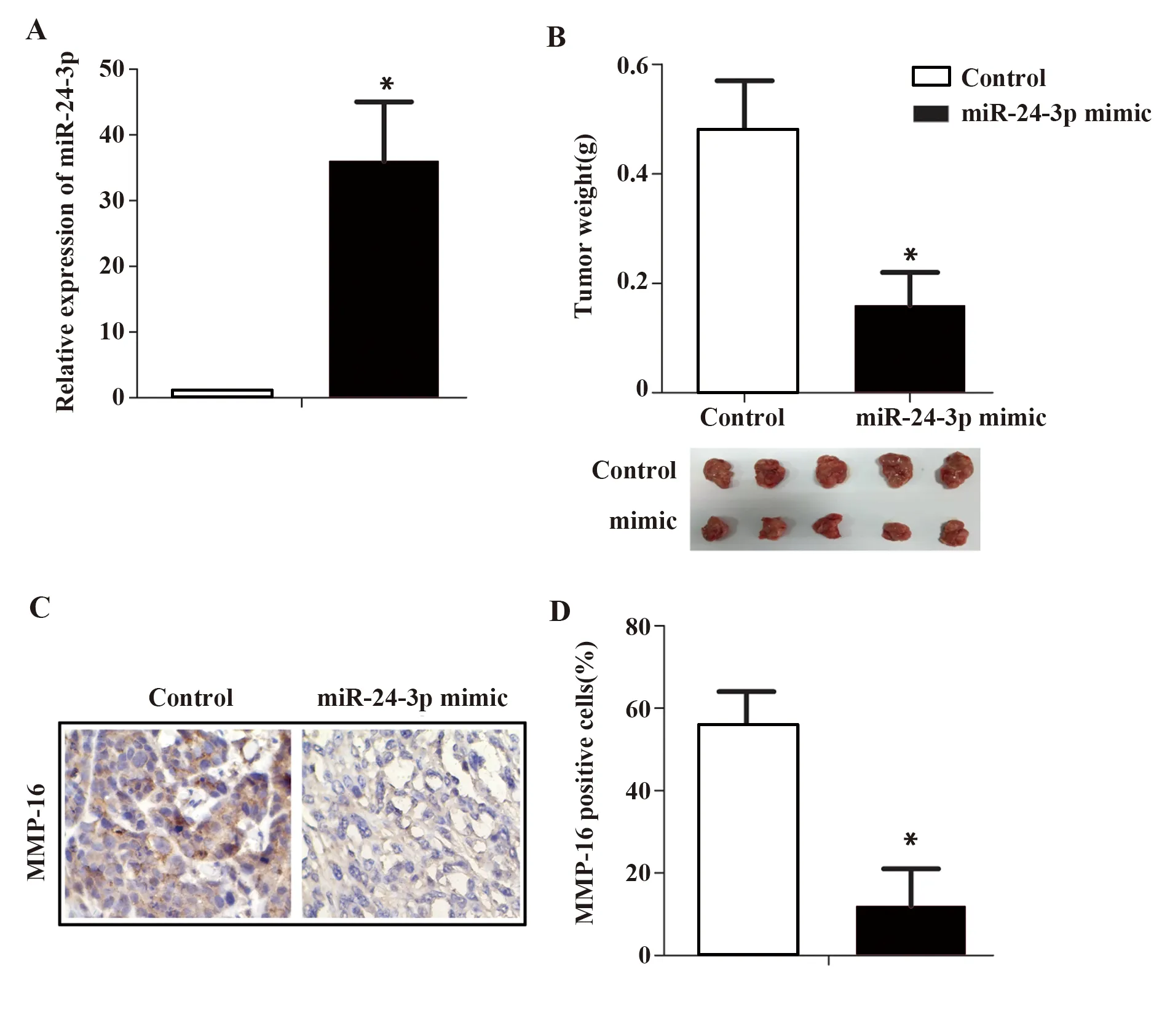
图5 miR-24过表达对5-8F细胞裸鼠成瘤及MMP-16表达的影响Fig.5 Effect of miR-24 overexpression on tumor formation and MMP-16 expression in 5-8F cells in nude miceNote:Compared with Control,*.P<0.05.
3 讨论
近年来miRNA在恶性肿瘤发生、发展中的作用受到广泛关注。张海花等[9]研究表明,基因治疗可通过抑制miRNA的翻译来沉默对应的靶基因,从而调节其生物学过程。田翎含等[10]研究表明,miRNA在肿瘤中可能起癌基因或抑癌基因作用。miRNA在恶性肿瘤发生、发展中主要通过2种方式发挥作用,作为抑癌因子抑制原癌基因的激活,或通过下调肿瘤抑制因子水平或下调抑癌基因表达引发癌症并促进肿瘤生长[11]。汪祖益等[12]研究表明,miRNA在调控鼻咽癌细胞增殖、 运动、 侵袭、转移及治疗敏感性方面发挥重要作用。恶性肿瘤的侵袭和转移分为黏附、降解和迁移3个步骤,其转移必须进入血管,在血液中存活,迁移出血管,侵袭外周组织。在肿瘤早期,MMP16介导细胞外基质及基底膜降解,为肿瘤增殖创造微环境。
本研究Transwell实验结果显示,miR-24-3p高表达的目的基因组细胞侵袭数目显著降低,说明miR-24-3p高表达可有效抑制肿瘤细胞侵袭,划痕实验发现miR-24-3p高表达的目的基因组细胞的迁移能力显著降低,说明miR-24-3p高表达可有效抑制肿瘤细胞迁移,因此miR-24-3p可靶向调控MMP-16抑制鼻咽癌5-8F细胞的生长、侵袭及迁移。
肿瘤细胞的增殖和转移需要水解肿瘤细胞外基质蛋白,穿越基底膜屏障进入循环系统,从而发生转移。基质金属蛋白酶是一种能降解细胞外基质预防肿瘤细胞侵袭转移的金属离子的蛋白水解酶,比较常见的为Ⅱ型:MMP-2、MMP-9,可降解细胞外基质结构蛋白,抑制脑胶质瘤细胞U87的侵袭及转移抑制[13];基质金属蛋白酶组织抑制剂是特异的内生 MMPs 抑制剂[14]。赵聪等[15]研究表明MMPs抑制剂可直接或间接抑制 MMPs活性,使MMPs含量增加或Timps含量减少,破坏肿瘤细胞屏障从而抑制肿瘤细胞侵袭转移。肿瘤从原位增殖到侵袭转移,除必须具有降解细胞外基质的能力外,还必须具备黏附基质生长、迁移的能力。MMPs 是一种能降解细胞外基质和血管基底膜的锌离子依赖性内肽酶,在肿瘤细胞突破基底膜屏障而浸润转移中起重要作用[16]。本研究显示,miR-24-3p高表达的目的基因组鼻咽癌5-8F细胞中MMP-16蛋白表达及阳性率显著降低且鼻咽癌5-8F细胞侵袭、迁移能力显著降低,说明miR-24-3p可通过降低MMP-16表达抑制鼻咽癌5-8F细胞的细胞活性及增殖、迁移、侵袭等恶性生物学行为,与Kang等[17]结论一致。
综上所述,miR-24-3p可通过靶向MMP-16抑制鼻咽癌5-8F细胞增殖、侵袭和迁移,同时裸鼠实验发现miR-24-3p可有效抑制肿瘤生长,其作用机制可能与降低MMP-16表达有关。本研究涉及的蛋白表达较少,且未涉及相关信号通路,miR-24-3p通过信号通路对裸鼠鼻咽癌的作用机制仍需进一步研究。

