沉默Bin1 基因对膀胱尿路上皮癌T24 细胞生物学功能的影响
罗 丹,杨承纲
(昆明医科大学第三附属医院/ 云南省肿瘤医院病理科,云南昆明 650118)
膀胱癌是泌尿系统最常见的恶性肿瘤,其中膀胱尿路上皮癌占90%以上,具有复杂多变的生物学行为,突出表现为易复发、多发、浸润和转移。目前,针对膀胱癌的主要治疗手段是手术切除以及放化疗,但膀胱癌的高复发率使得治疗效果不理想,因此,寻找特异性分子靶向治疗对提高膀胱尿路上皮癌的临床预后具有重要意义。桥接整合因子1(bridging integrator-1,Bin1)亦称Amphiphysin2,是一种C-myc N-末端连接蛋白,在多种肿瘤中表达异常,且Bin1 的表达异常与癌的进展有关[1],但在膀胱尿路上皮癌中的作用机制尚未明确。该研究旨在观察沉默Bin1 基因对膀胱尿路上皮癌T24 细胞在体内外生长的影响,初步探讨Bin1 在膀胱尿路上皮癌细胞中的基因调控作用,有助于揭示Bin1 与膀胱尿路上皮癌发生发展的关系。
1 材料与方法
1.1 材料
T24 细胞、shRNA 病毒、阴性对照病毒购于上海吉凯有限公司;CCK8 试剂盒、PI 核酸荧光染料购于Sigma 公司;凋亡试剂盒购于eBioscience 公司;裸鼠购于上海灵畅生物科技有限公司;荧光显微镜为日本Olympus 公司;倒置显微镜为上海蔡康光学仪器有限公司;流式细胞仪为Millipore 公司。
1.2 细胞培养与慢病毒感染
膀胱尿路上皮癌细胞株T24 采用10%的胎牛血清的RPMI-1640 基培养,培养条件37℃、5%CO2。培养生长状态良好的T24 细胞,依据《慢病毒感染细胞手册》[2]对其进行感染。实验随机分为实验组(KD 组,转染Bin1 基因的shRNA 病毒,能沉默Bin1 基因)和阴性对照组(NC 组,转染阴性对照病毒),感染后第72 h 检测感染效率并进行后续试验。
1.3 细胞活力检测(CCK8 法)
将处于对数生长期的两组细胞制备成细胞悬液,并接种于96 孔板,再置于37℃、5%CO2培养箱中继续培养。待细胞贴壁后24、48、72、96、120 h,加入10 μL CCK-8 试剂于孔中,并继续培养4 h。用酶标仪测定波长为450 nm 的光的吸光率(OD450 nm 值),然后绘制曲线。
1.4 流式细胞凋亡检测
将两组T24 细胞接种于6 孔板,待细胞生长至覆盖率约为70%时,制备成细胞悬液,收集全部细胞于离心管中,每组设三个复孔,离心弃上清后洗涤细胞沉淀,用结合缓冲液重悬细胞,加入10 μL Annexin V-APC 染色,室温避光15 min,上机检测。
1.5 流式细胞周期检测法
将两组细胞生长至覆盖率约为80%时(细胞未进入生长平台期),消化收集细胞,每组设三个复孔,离心弃上清后洗涤细胞沉淀,用75%的乙醇进行固定,离心去固定液,再次洗涤细胞沉淀,用无RNA 酶的碘化丙啶染色液对细胞进行染色后,采用流式细胞仪检测细胞周期分布情况,绘制直方图。
1.6 克隆形成实验
将处于对数生长期的两组细胞消化制备成细胞悬液,按照800 个细胞/孔接种于6 孔板中,每个实验组设3 个复孔。置于培养箱中培养16 d 后,多聚甲醛固定细胞克隆,GIMSA 染色后,拍照计数,计算各组细胞克隆形成数。
1.7 裸鼠皮下成瘤实验
取适应性饲养4 周裸鼠20 只,均为雌性,随机分为两组:实验组及对照组,每组10 只。取对数生长期的转染了Bin1 基因的shRNA 病毒与阴性对照病毒的T24 细胞悬液200 μL(含活细胞数1×107)分别注射到两组小鼠皮下,构建裸鼠皮下成瘤模型。从细胞注射开始,每天观察裸鼠的生长状态及成瘤情况,绘制肿瘤生长曲线,41 d 后处死两组成瘤裸鼠,取肿瘤测量体积、称重记录、比较及分析。
1.8 统计学处理
采用SPSS 统计软件,计量资料符从正态分布,以均数±标准差()表示,组间比较采用t检验分析,P<0.05 为差异有统计学意义。
2 结果
2.1 沉默Bin1 基因的表达对膀胱尿路上皮癌T24细胞增殖的影响
采用CCK8 法分析沉默Bin1 基因的表达对细胞增殖的影响。OD450 在这里反映了具有活力的细胞的数量。实验结果显示:相比对照组,从第1~5 天,实验组细胞增殖减缓(图1),沉默Bin1 基因表达能够抑制膀胱尿路上皮癌细胞的增殖活性[NC vs KD:(1.28±0.67)vs(0.74±0.15),P<0.001]。
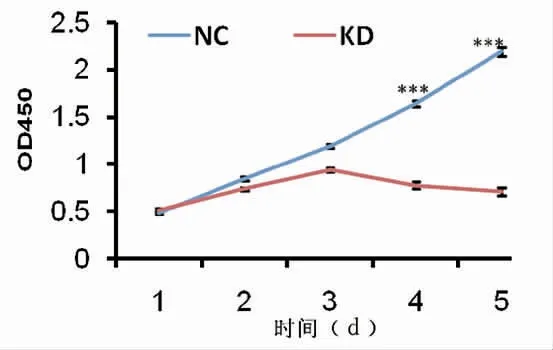
图1 沉默Bin1 基因的表达对膀胱尿路上皮癌T24 细胞增殖的影响Fig.1 Effect of silence of Bin1 gene on the cell proliferation in T24 cells
2.2 沉默Bin1 基因的表达对膀胱尿路上皮癌T24细胞凋亡的影响
细胞凋亡实验结果显示:相比对照组,试验组凋亡数增多(图2),说明沉默Bin1 基因表达可以促进膀胱尿路上皮癌T24 细胞凋亡[NC vs KD:(4.31±0.17)vs(6.41±0.54),P<0.01]。

图2 沉默Bin1 的表达对膀胱尿路上皮癌T24 细胞凋亡的影响Fig.2 Effect of silence of Bin1 gene on the cell apoptosis in T24 cells
2.3 沉默Bin1 基因的表达对膀胱尿路上皮癌T24细胞周期的影响
通过流式细胞术分析沉默Bin1 表达对细胞周期进程的影响。实验结果显示:相比对照组,实验组处于S 期的细胞减少(P<0.05),处于G1、G2/M 期的细胞增多(P<0.05,图3),说明沉默Bin1 基因的表达对T24 细胞周期有一定的调节作用。

图3 沉默Bin1 基因的表达对膀胱尿路上皮癌T24 细胞周期的影响Fig.3 The effect of silence of Bin1 gene on the cell cycle progression in T24 cells
2.4 沉默Bin1 基因的表达对膀胱尿路上皮癌T24细胞克隆形成的影响
克隆实验结果显示:相比对照组,实验组细胞克隆数显著减少(P<0.001,图4)。结果表明,沉默Bin1 基因的表达能抑制T24 细胞克隆形成的能力。
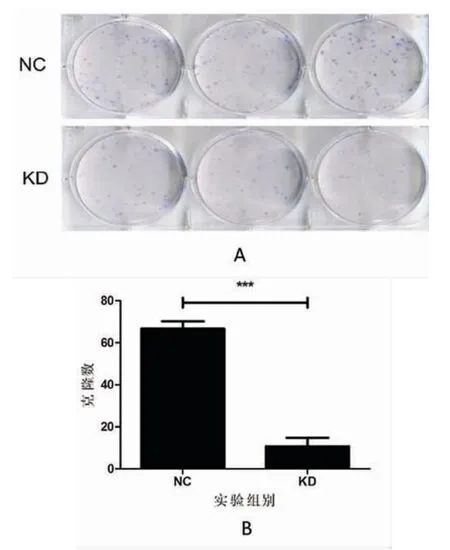
图4 沉默Bin1 基因的表达对膀胱尿路上皮癌T24 细胞克隆形成的影响Fig.4 Effect of silence of Bin1 gene on the colony formation in T24 cells
2.5 沉默Bin1 基因的表达对膀胱尿路上皮癌T24细胞裸鼠皮下成瘤性的影响
处死小鼠,观察裸鼠成瘤情况,结果显示:与对照组比较,实验组的裸鼠移植瘤体平均体积明显减小(P<0.05,图5),实验组瘤体重量减小(P<0.05,图6),绘制肿瘤体积生长曲线,可以发现实验组肿瘤生长速度减慢(P<0.05,图7)。这提示沉默Bin1 基因的表达能抑制膀胱尿路上皮癌T24细胞种植瘤在裸鼠体内的生长。
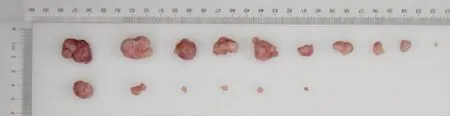
图5 实验组与对照组T24 裸鼠种植瘤大小(种植瘤照片)Fig.5 Effect of silence of Bin1 gene on the colony formation in T24 cells (the photo of planted tumors)

图6 实验组与对照组T24 裸鼠种植瘤重量Fig.6 The weight of planted T24 tumors in NC and KD group

图7 肿瘤体积生长曲线Fig.7 Tumor growth curves
3 讨论
恶性肿瘤的发生发展通常与癌基因的激活、抑癌基因的失活缺失密切相关。Bin1 因具有抑癌作用的配体蛋白而被发现[3],能广泛表达于正常细胞中,但在多种恶性肿瘤中低表达或缺失[4-7],多个研究中发现Bin1 能促进肿瘤细胞凋亡[8]、抑制细胞周期[9]、抑制细胞增殖[4,10],并与肿瘤转移[11]、肿瘤免疫逃逸与治疗[12-14]、肿瘤耐药[9,15]、DNA 修复相关[1],具有影响癌症的进展及预后的作用[1]。该实验通过慢病毒沉默Bin1 基因的表达对膀胱尿路上皮癌细胞的生物学功能进行研究。实验中采用了CCK8、细胞周期、细胞凋亡、克隆形成等方法,结果发现沉默Bin1 基因可以使膀胱尿路上皮癌T24 细胞的增殖活性降低、凋亡增多、体外成瘤能力降低(克隆形成减少);且通过构建裸鼠皮下成瘤模型,发现沉默Bin1 基因的表达能使T24 细胞体内成瘤能力降低,此外,还发现Bin1 对T24 细胞周期具有一定的调节作用。此次试验证明Bin1 有促进膀胱尿路上皮癌细胞的生长作用,与Bin1 抑癌的作用相互矛盾。这种矛盾的表现,推测具有以下可能:(1)基因在肿瘤的生长进展中有多个肿瘤通道及多个基因调控,单个基因的沉默后可能出现的预期结果被其他基因的作用而掩盖;(2)Bin1 在膀胱尿路上皮癌中可能具有一定的组织特异性。
综上所述,沉默Bin1 基因的表达能够明显影响膀胱尿路上皮癌T24 细胞的增殖、凋亡、周期进展、体内外成瘤能力,这表明Bin1 在膀胱尿路上皮癌细胞株T24 中具有重要作用,它可能与膀胱尿路上皮癌的进展相关,为进一步深入研究膀胱尿路上皮癌的发生发展机制提供了一定实验基础。

