miR-411-3p靶向PAK2介导Wnt信号通路对口腔鳞状细胞癌侵袭和转移的影响及调控机制①
麦明思 赵 焱 马 锴 (三亚市人民医院口腔科,三亚 572000)
口腔鳞状细胞癌指发病于口腔,以鳞状细胞为主的恶性肿瘤,是头颈部肿瘤中恶性程度最高且危害最大的肿瘤[1,2]。肿瘤的侵袭和转移是引起患者病情恶化的重要因素,因此寻找抑制肿瘤侵袭转移的方法十分重要[3]。p21活化激酶2(p21 activated kinase 2,PAK2)属于进化保守的丝氨酸/苏氨酸蛋白激酶,是小G蛋白Rho家族中GTP的重要效应物[4]。研究表明PAK2活性升高与人类肿瘤发生发展相关,如PAK2/PIX通路活化能诱导乳腺癌雌激素抵抗[5]。PAK2活化与晚期胃癌的进展及预后不良相关[6]。口腔鳞状细胞癌相关研究发现,相比于正常口腔黏膜组织,PAK2在口腔鳞癌中表达显著增强[7]。miR-411经研究证实在肾细胞癌、乳腺癌、大肠癌等多种肿瘤中均发挥抑癌因子作用[8-10]。但其在口腔鳞癌中的作用尚未阐明。Wnt通路经研究证实在包括口腔癌在内的头颈部肿瘤中均存在异常活化现象。本研究旨在探讨miR-411-3p靶向PAK2在口腔鳞状细胞癌中的作用及机制。
1 材料与方法
1.1材料
1.1.1试剂与仪器 基因组DNA提取试剂盒、Lipofectamine 3000试剂盒、Trizol试剂盒、TransScriptⅡGreen One-Step qRT-PCR SuperMix试剂盒、CCK8试剂盒购自赛默飞世尔;人舌鳞癌细胞株HSC-4、Tca8113、TcaSll3及人颊鳞癌细胞株BcaCD885购自拜力生物;miR-411-3p agomir、miR-411-3p antagomir购自上海吉玛制药技术有限公司;DAB染液、苏木素染液、伊红染液购自北京索莱宝;所有抗体购自ABCAM;Transwell小室购自北京明阳科华生物科技有限公司;Anexin-V-FITC染液、PI染液购自上海碧云天;流式细胞仪购自德国贝克曼;倒置显微镜购自奥林巴斯;实时荧光定量PCR仪购自赛默飞世尔;PCR引物序列由华大基因合成。
1.1.2组织来源 收集我院2017年5月至2018年10月通过外科手术切除的口腔鳞癌组织52例,术前均未进行放化疗及免疫治疗,其中男性38例,女性14例,年龄22~72岁,平均年龄 (42.2±7.3) 岁。其中高分化鳞癌28例,中分化鳞癌13例,低分化鳞癌11例。淋巴结转移36例,无淋巴结转移16例。以52例正常的口腔黏膜上皮组织作为对照,其中男性31例,女性21例,年龄24~68岁,平均年龄(40.3±6.9)岁。本研究经我院伦理委员会审批且所有患者知情同意。
1.2方法
1.2.1免疫组化检测 将癌组织及正常黏膜上皮组织以石蜡包埋后切片。60℃温箱烤干,二甲苯脱蜡,梯度酒精脱水,双氧水和蒸馏水洗涤,微波抗原修复。切片冷却后PBS冲洗,5% BSA室温封闭,加入一抗兔抗小鼠PAK2孵育1 h,加入二抗山羊抗兔IgG孵育20 min,PBS冲洗,DAB显色,苏木素复染,自来水冲洗。梯度酒精脱水,中性树胶封固。倒置显微镜观察组织染色情况。Image J软件统计癌组织及正常黏膜组织的PAK2阳性表达率。
1.2.2PAK2沉默重组质粒构建 UCSC获取人PAK2编码区序列(NM_002577),BLOCK-iTTMRNAi Designer网站在线设计PAK2的shRNA序列(5′-CACCGTCTGATAACGGAGAACTGGACGAATCCAGTT-CTCCGTTATCAGAC-3′)。在shRNA序列两端加上EcoRⅠ 和BamHⅠ 酶切位点。T4DNA连接酶将酶切后的pcDNA3.1(+)质粒线性化载体与目的基因片段连接并过夜,转化至DH5α大肠杆菌克隆。酶切电泳鉴定后提取大肠杆菌中重组载体,-80℃保存备用。
1.2.3细胞分组及转染 人舌鳞癌细胞株HSC-4、Tca8113、TcaSll3及人颊鳞癌细胞株BcaCD885培养于含10%FBS及1%P/S的MEM培养基中,Western blot筛选PAK2蛋白表达最高的细胞系用于后续实验并分为:阴性对照组(转染含有无关序列的重组质粒)、miR-411-3p agomir组(转染miR-411-3p agomir)、miR-411-3p antagomir组(转染miR-411-3p antagomir)、基因沉默组(转染含有PAK2 shRNA的重组质粒)及联合组(miR-411-3p agomir联合PAK2沉默处理细胞)。
传代后取对数期细胞,待细胞生长至70%~90%融合度进行转染,Opti-MEM培养基调整细胞密度至3×105个/ml并接种于24孔板。将50 μl Opti-MEM分别与1.5 μl Lipofectamine 3000及1 μg PAK2 shRNA重组质粒(浓度为2 μg/μl)混匀,以1∶1 充分混匀并于室温孵育5 min。将DNA-脂质体复合物加至含有口腔鳞癌细胞的24孔板,轻柔摇晃,培养24~48 h后更换培养基。miR-411 agomir、miR-411 antagomir及阴性对照的转染方式同上。
1.2.4qRT-PCR检测 按Trizol试剂说明书提取口腔鳞癌细胞系总RNA。DEPC处理的超纯水溶解RNA,TransScriptⅡGreen One-Step qRT-PCR Super Mix试剂盒一步完成RT-PCR合成及PCR。反应体系和反应条件均依据试剂盒说明书操作。实时荧光定量PCR仪进行扩增,miR-411-3p以U6为内参,其他检测因子以GAPDH为内参,引物序列见表1。2-ΔΔCt法计算相对表达量。

表1 qRT-PCR引物
1.2.5Western blot检测蛋白表达 弃细胞培养液,PBS洗涤,RIPA裂解液裂解细胞,匀浆,离心后去上清,去离子水调整蛋白浓度,行SDS-PAGE凝胶电泳并将细胞转至PVDF膜。加入含5% BSA的TBST,室温封闭1 h。加入一抗兔抗鼠Wnt1、GSK3β、β-catenin、E-cadherin、N-cadherin抗体,4℃过夜。加入二抗山羊抗兔IgG,4℃孵育,取化学发光试剂A液与B液按1∶1混匀后,均匀滴加至NC膜,显影液显影。分析条带光密度,蛋白质相对表达量为目标条带与内参条带的灰度值比值。
1.2.6CCK8测定细胞活力 将细胞悬液(约1×105个)加入96孔板,设置阴性对照,37℃、5%CO2培养过夜。加入CCK8溶液,检测0、24、48 h吸光度(450 nm)。
1.2.7细胞划痕实验 实验前用marker笔对12孔板做背面标记,0.25%胰酶消化细胞,将细胞接种于12孔板。待细胞铺满板底后,1 ml枪头垂直于孔板划痕。去除细胞培养液,PBS冲洗,加入无血清MEM培养基,放入培养箱,48 h后拍照并统计细胞迁移率。
1.2.8Transwell细胞侵袭实验 按1∶10比例采用MEM培养基稀释Matrigel胶,后将100 μl Matrigel胶加入上室。DMEM培养基重悬细胞,调整至3×105个/ml,取100 μl细胞加入上室,下室加入600 μl 含10%血清的DMEM培养基,依据Transwell说明书进行结晶紫染色。染色结束后于光镜下选取3个视野对跨膜细胞进行计数,计算侵袭细胞数目。
1.2.9Annexin V-FITC/PI双染检测口腔鳞癌细胞凋亡 取转染后细胞,PBS冲洗,离心后弃上清,调整细胞浓度为4×105个/ml,加入500 μl结合缓冲液,加入5 μl Anexin-V-FITC及5 μl PI染液混匀,避光孵育10 min。流式细胞仪检测凋亡情况,激发波长488 nm,530 nm处检测FITC,575 nm检测PI,统计细胞凋亡情况。
2 结果
2.1miR-411-3p与PAK2存在靶向结合关系 与NC组相比,PAK2野生型3′UTR荧光素酶活性被miR-411-3p显著抑制,而突变型3′UTR荧光素酶活性未被抑制。说明miR-411-3p可靶向抑制PAK2基因表达(图1)。
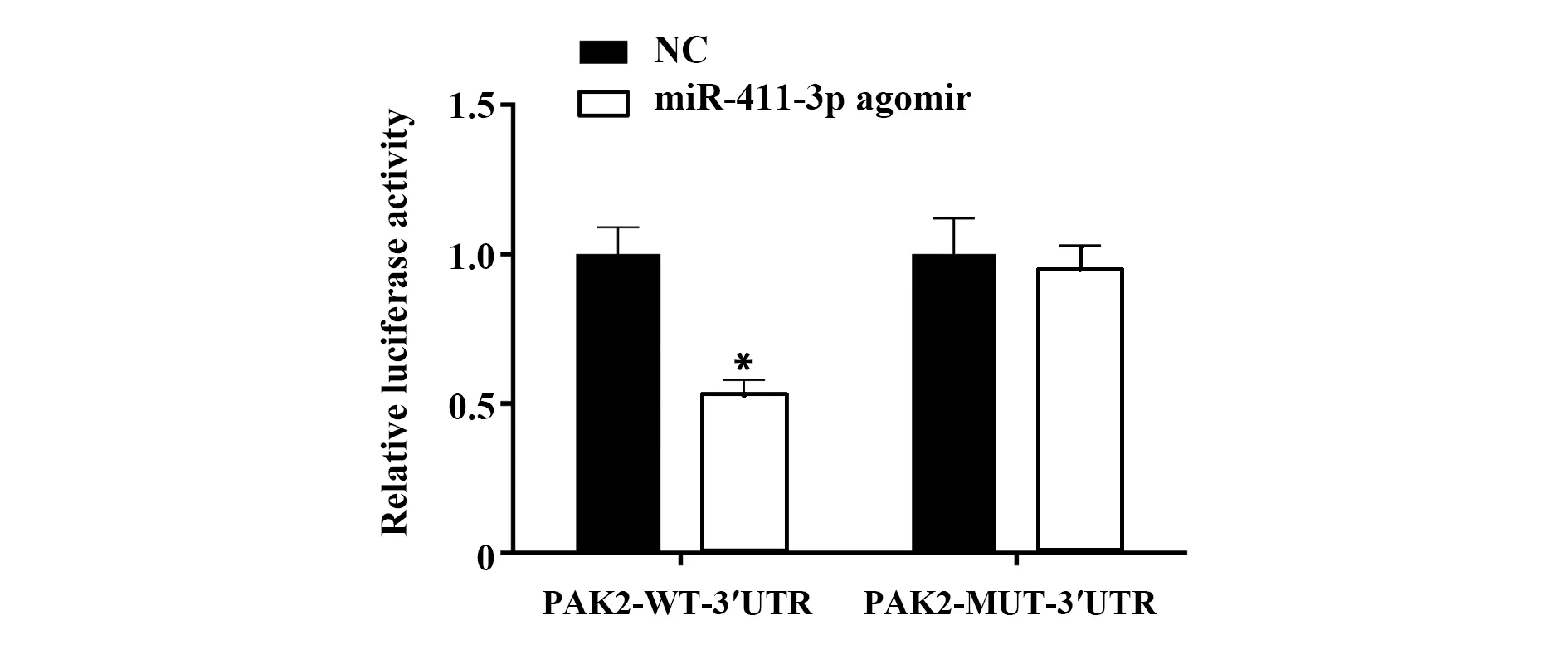
图1 miR-411-3p与PAK2靶向调控关系验证
2.2正常组织口腔鳞癌组织中miR-411-3p、PAK2表达 PAK2蛋白在胞浆和核内表达存在差异(图2)。与癌旁组织[(15.34±1.71)%]相比,癌组织中PAK2细胞阳性率[(73.12±6.29)%]上调。与正常口腔黏膜上皮组织相比,癌组织miR-411-3p表达显著下降,PAK2表达显著上升(P<0.05)。
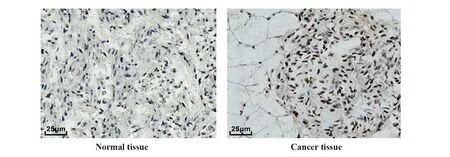
图2 各组miR-411-3p及PAK2表达情况
2.3过表达miR-411-3p或沉默PAK2对上皮间质转化的影响 qRT-PCR及Western blot检测结果显示,与阴性对照组相比,miR-411-3p过表达或沉默PAK2可抑制Wnt信号通路相关因子(Wnt1,β-catenin)及N-cadherin表达,促进E-cadherin及GSK3β表达,且联合组效果更为显著(P<0.05),抑制miR-411-3p表达则效果相反,见图3。
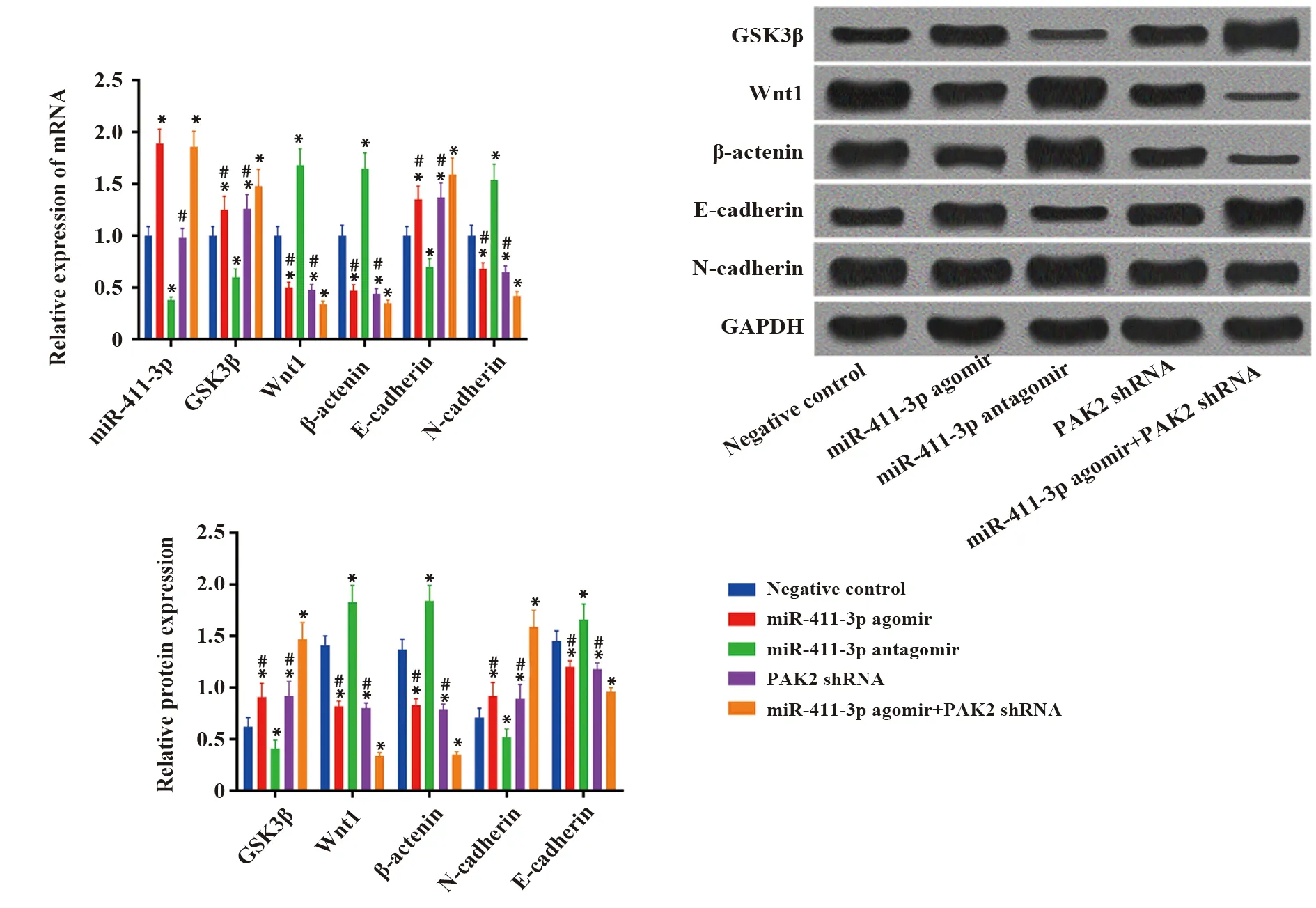
图3 过表达miR-411-3p或沉默PAK2对上皮间质转化的影响
2.4各组细胞活力检测结果 CCK8检测各组细胞生长活力情况显示,与阴性对照组相比,上调miR-411-3p表达或抑制PAK2表达可抑制口腔鳞状细胞癌细胞的生长活力且联合处理效果更为显著(P<0.05)。抑制miR-411-3p表达可显著提高口腔鳞状细胞癌细胞活力(P<0.05),见图4。
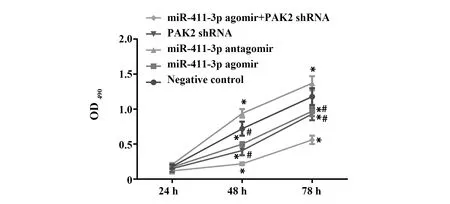
图4 各组细胞活力检测结果
2.5各组细胞划痕愈合情况检测 与阴性对照组相比,miR-411-3p agomir组及PAK2 shRNA组划痕愈合率显著下降,且联合组效果更为明显(P<0.05),miR-411-3p antagomir组细胞划痕愈合率显著上升(P<0.05),见图5。

图5 各组细胞划痕检测结果
2.6各组细胞侵袭情况检测结果 与阴性对照组相比,miR-411-3p agomir组及PAK2 shRNA组细胞侵袭明显减少,且联合组效果更显著(P<0.05),miR-411-3p antagomir组细胞侵袭为显著增加(P<0.05),见图6。

图6 各组细胞Transwell检测结果
2.7各组细胞凋亡情况检测结果 与阴性对照组相比,miR-411-3p agomir组及PAK2 shRNA组细胞凋亡明显著增加,且联合组效果更为明显(P<0.05),miR-411-3p antagomir组细胞凋亡显著减少(P<0.05),见图7。
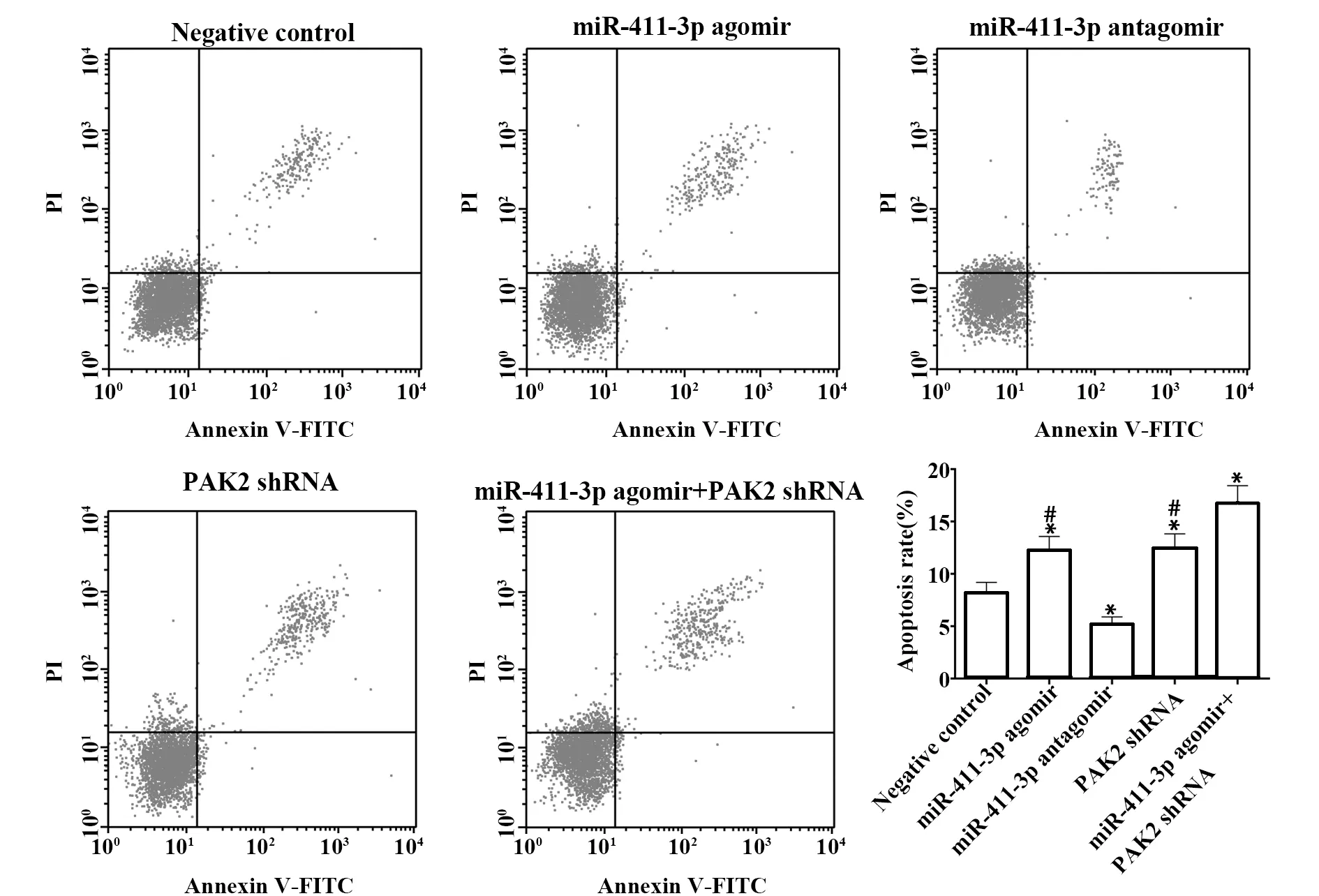
图7 各组细胞凋亡情况
3 讨论
口腔鳞状细胞癌是指不同程度鳞状分化、合并上皮侵袭性的肿瘤,也是口腔恶性肿瘤中最为常见的类型[11]。尽管近年来针对该病的治疗取得了一定进展,但患者的5年生存率仍然较低,尤其是晚期合并远处转移的患者,常规手术、放化疗等治疗方式效果均不理想[12]。本研究从基因靶向治疗的角度出发,探讨miR-411-3p对口腔鳞癌细胞侵袭转移的影响及其作用机制,发现miR-411-3p可靶向PAK2基因介导Wnt信号通路进而调控口腔鳞癌细胞的生物学特性。
研究证实PAK2活性在多种肿瘤细胞中显著升高,且PAK2高表达与肿瘤的预后不良有关。Zhang等[5]预后研究发现PAK2高表达与药物治疗管腔性乳腺癌不良相关。抑制PAK2表达可抑制皮肤黑色素瘤细胞增殖[13]。下调PAK2表达可抑制卵巢癌细胞系迁移和侵袭能力[14]。关于口腔鳞癌的研究也证实PAK2在口腔鳞癌组织中表达显著上升且与肿瘤分级相关[7]。本研究通过免疫组化、qRT-PCR及Western blot检测发现,相对于正常口腔黏膜组织,癌组织中PAK2表达显著上升,与既往研究结论一致。本研究证实miR-411-3p是PAK2的靶向miRNA,在口腔鳞癌中表达显著下降。既往研究证实miR-411在多种癌症中均发挥抑癌因子作用。Bai等[15]在关于胃癌的研究中发现,miR-411能够抑制胃癌细胞增殖和迁移。miR-411能够延缓膀胱癌进展[16,17]。miR-411在卵巢癌和宫颈癌中可抑制肿瘤细胞增殖,延缓癌症进展[18,19]。
本研究在前人研究的基础上进一步发现miR-411-3p在口腔鳞癌细胞中同样发挥抑癌因子作用,通过抑制PAK2基因及激活Wnt信号通路发挥作用。Wnt信号通路的异常激活是肿瘤发生的重要因素,β-catenin大量积聚是引发Wnt通路激活及肿瘤发生的关键原因[20]。糖原合成酶激酶-3β(glycogen synthase kinase-3β,GSK-3β)在Wnt通路中起调控开关作用,能够促进β-catenin磷酸化及转录过程调控[21]。研究证实口腔鳞癌中GSK-3β失活,在口腔鳞癌、鼻咽癌等恶性肿瘤中均发挥抑癌因子作用[22]。本研究发现,相对于阴性对照组,激活miR-411-3p或沉默PAK2表达可促进GSK3β表达,抑制Wnt通路激活,延缓口腔鳞癌进展。上皮间质转化在恶性肿瘤浸润转移中的作用备受关注。上皮间质转化主要表现为间质表型神经性钙黏蛋白N-cadherin表达上升及上皮表型钙黏蛋白E-cadherin丢失,在包括口腔癌在内的多种恶性肿瘤中均发现E-cadherin表达降低、N-cadherin表达增高[23]。本研究发现激活miR-411-3p或沉默PAK2后E-cadherin表达上调,N-cadherin表达降低,表明过表达miR-411-3p或沉默PAK2可减少口腔鳞癌上皮间质转化。进一步通过MTT、划痕愈合实验、Transwell实验等对各组细胞的增殖活性、迁移和侵袭能力进行检测发现,抑制miR-411-3p能够显著增强细胞活力及迁移和侵袭能力,而激活miR-411-3p或沉默PAK2表达则能够显著抑制细胞活力,减少癌细胞迁移和侵袭。流式细胞术进一步证实过表达miR-411-3p及沉默PAK2在促进癌细胞凋亡中的重要价值。
综上所述,本研究发现miR-411-3p能够靶向抑制PAK2表达,通过影响Wnt信号通路的活性调控口腔鳞状细胞癌的生物学特性进行调控。过表达miR-411-3p能够显著抑制口腔鳞癌细胞增殖、侵袭和转移,促进癌细胞凋亡,miR-411-3p有望成为口腔鳞状细胞癌靶向治疗的重要分子靶点。