PD-L1通过调控PKC-α-NF-κB信号通路延迟脓毒血症中性粒细胞凋亡①
罗玉娇 郑小莉 罗 波 曾静媛 左 英
(西南医科大学基础医学院,泸州 646000)
脓毒血症属于多因素诱发的全身炎症反应综合征,病情进展迅速,可导致休克或多器官功能衰竭,病死率高达50%以上[1]。研究发现,脓毒血症诱导机体免疫抑制所致的炎症因子过量产生是其发生的重要病理生理过程[2]。多形核性粒细胞(polymorpho-nuclear neutrophil,PMN)是天然免疫系统的关键细胞,在机体感染病原体时,PMN可从血管处迁移出并迅速趋化募集至感染部位并吞噬和杀伤病原体,在完成吞噬、灭菌作用后即发生凋亡,若凋亡延迟,可导致组织细胞损伤[3]。研究表明,脓毒血症患者体内PMN凋亡受到抑制,且迁移、杀菌等功能降低,可能在脓毒血症的发生发展中发挥重要作用[4]。程序性死亡配体 1(programmed death ligand 1,PD-L1)是免疫应答的协同抑制分子之一,对免疫功能起负性调控作用[5]。研究显示敲除 PD-L1基因的脓毒血症小鼠生存率及细菌清除率均显著高于未敲除PD-L1的小鼠[6]。故推测PD-L1可能是脓毒血症免疫治疗的潜在靶点。本研究通过分析脓毒血症患者外周血PMN凋亡及PD-L1表达、构建 PD-L1 质粒并建立大鼠脓毒血症模型,以研究体内沉默PD-L1基因对脓毒血症大鼠外周血PMN表达的影响。
1 资料与方法
1.1资料
1.1.1病例选择及分组 选择2017年1月~2018年12月于本院住院治疗的12例脓毒血症患者作为脓毒血症组,其中肺部感染7例,急性腹腔感染2例,颌面部感染2例,感染部位不明但血培养阳性者1例。均为年龄为21~75岁的非妊娠患者。所有患者均符合1991年美国胸科医师学会(ACCP)/危重病医师协会(SCCM)联席会议有关脓毒血症的诊断标准。同时选取本院同期行健康体检的15名健康志愿者对照组。两组年龄、性别差异无统计学意义(P>0.05)。本研究经本院医学伦理委员会批准,所有患者或家属知情同意。
1.1.2实验动物 SPF级成年雄性SD大鼠60只,7周龄,体质量250~300 g,购自西南医科大学动物实验中心,动物合格证号:SCXK(川)2018-17。大鼠饲养环境温度控制在22~25℃,相对湿度40%~70%,昼夜节律每12 h交替,自由饮水和进食,所有大鼠均适应性喂养1周后进入本实验。
1.1.3试剂 转染试剂Lipofectamine 2000、opti-PD-L1 单克隆抗体(Ebioscience公司);PVDF 膜(美国Millipore公司);细胞凋亡检测试剂盒(广州杰特伟生物科技有限公司);293T细胞(广州沛瑜生物制品有限公司);DMEM培养基(赛默飞世尔科技有限公司,中国);AXIS-SHIELD polymorphprep分离液(北京先明乐科技发展有限公司); FBS(上海彩佑实业有限公司);肝素(上海沪震实业有限公司);Histopaque 1119、Histopaque 1083(上海北诺生物科技有限公司);Annexin V-FITC、PI(上海翊圣生物科技有限公司);TRIzol(北京优尼康生物科技有限公司);Cleaved caspase-3、PKC-α及NF-κB抗体(沈阳万类生物科技有限公司);羊抗兔抗体(赛默飞世尔科技有限公司,中国)。
1.2方法
1.2.1外周血PMN的制备及检测 分别于确诊6、12 h内抽取患者外周空腹静脉血5 ml,肝素抗凝后,加入AXIS-SHIELD polymorphprep分离液,采用密度梯度离心法分离患者外周血PMN,采用10%FBS重悬细胞后,置于DMEM培养基中培养24 h,流式细胞术检测PMN凋亡率,Western blot检测PMN中PD-L1表达。
1.2.2慢病毒质粒的制备 将PD-L1 siRNA序列克隆到红色荧光蛋白标记的载体中,取5 μg刚合成的载体和1 μl慢病毒包装质粒,转染至293T细胞,进行腺病毒重组、包装和扩增,生成慢病毒质粒。转染48 h后,采用0.45 μm醋酸纤维素过滤器过滤含有慢病毒质粒的上清液,离心,弃上清,-80℃冰箱冻存备用。
1.2.3分组及模型建立 按照随机数字表法将60只实验大鼠随机分成假手术组、模型组及实验组,每组20只。假手术组仅开腹翻动盲肠,不予以结扎穿孔。模型组采用经典的盲肠结扎穿孔术制备脓毒血症大鼠模型,造模前大鼠禁食12 h,自由饮水,10%水合氯醛腹腔麻醉后,切开大鼠腹中线,长约2 cm,分离并找到盲肠后进行结扎,采用9号针穿刺盲端肠壁2次,留置贯穿盲肠的橡皮片后,挤出少量粪便,还纳盲肠,缝合腹壁,待大鼠清醒后,继续进入代谢笼自由进食饮水。实验组按照模型组的方法制备脓毒血症大鼠模型,在造模前7 d腹腔注射PD-L1 500 μg,注射容积为80 ml/kg,假手术组及模型组注射等量生理盐水。
1.2.4外周血 PMN的提取 各组分别于术后3、6、12 h抽取大鼠下腔静脉血2.5 ml,肝素抗凝,加入Histopaque 1119和Histopaque 1083后,700 g离心 30 min,抽取PMN 富集层,PBS清洗2次,去除溶解的红细胞,PBS清洗1次,采用瑞氏-姬姆萨染色,PMN纯度达到95%以上方可用于后续实验。
1.2.5流式细胞术检测PMN的凋亡情况 各组分别于术后6、12 h抽取大鼠下腔静脉血450 μl,分别加入5 μl液体Annexin V-FITC和50 μl PI,室温避光孵育15 min,流式细胞术检测PMN凋亡率。
1.2.6Western blot检测PMN中Cleaved caspase-3、PKC-α及NF-κB水平 TRIzol法提取细胞总蛋白,经电泳分离蛋白、转膜、封闭后,加入浓度为1∶500的一抗,4℃过夜;加入1∶1 000的二抗,室温孵育2 h。ECL发光法显色,以β-actin为内参,Odyssey扫描系统检测蛋白条带灰度值,采用目的条带灰度值/β-actin灰度值计算目的蛋白的相对表达量。
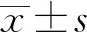
2 结果
2.1外周血PMN的凋亡率 脓毒血症组患者在6、12 h时PMN的凋亡率分别为(27.45±2.47)%和(11.45±1.67)%;健康对照组在6、12 h时PMN的凋亡率分别为(63.22±2.88)%和(62.69±2.59)%。与健康志愿者相比,脓毒血症患者在6、12 h时PMN凋亡水平显著降低,差异具有统计学意义(P<0.05)。见图1。

图1 外周血PMN的凋亡率
2.2外周血PMN中PD-L1表达 脓毒血症患者在6、12 h时PD-L1表达水平分别为1.05±0.14和1.28±0.16;健康对照组在6、12 h时PMN的PD-L1表达水平分别为0.42±0.08和0.53±0.11。与健康对照组相比,脓毒血症患者在6、12 h时PD-L1的表达水平显著提高,差异具有统计学意义(P<0.05)。见图2。
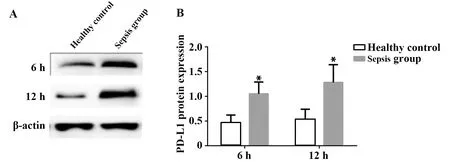
图2 外周血PMN中PD-L1表达
2.3脓毒血症组粒细胞凋亡率和PD-L1表达的相关性 PMN 6、12 h的凋亡率分别与对应时段的PD-L1表达水平呈显著负相关(r=-0.693,P=0.012;r=-0.685,P=0.014)。见图3。

图3 脓毒血症组粒细胞凋亡率和PD-L1表达的相关性
2.4沉默PD-L1基因表达对脓毒血症大鼠外周血PMN凋亡率的影响 流式细胞术检测结果显示,模型组6、12 h外周血PMN凋亡率为6.09%及5.91%,显著低于假手术组同时段的22.97%及24.61%(P<0.05);实验组6、12 h外周血PMN凋亡率为17.22%及18.65%,显著高于模型组同时段的凋亡率(P<0.05),见图4A、B。同时,模型组各时间点PMN中凋亡相关蛋白Cleaved caspase-3表达量亦显著低于假手术组同时段(P<0.05);实验组各时间点Cleaved caspase-3表达量显著高于模型组(P<0.05),见图4C、D。

图4 沉默PD-L1基因表达对脓毒血症大鼠外周血PMN凋亡率影响
2.5沉默PD-L1基因表达对脓毒血症大鼠外周血PMN中PKC-α/NF-κB 信号通路相关蛋白表达的影响 模型组外周血PMN中PKC-α及NF-κB的磷酸化水平明显增高,显著高于假手术组(P<0.05);实验组外周血PMN中PKC-α及NF-κB的磷酸化水平明显降低,显著低于模型组(P<0.05),见图5。

图5 沉默PD-L1基因表达对脓毒血症大鼠外周血PMN中PKC-α/NF-κB信号通路相关蛋白的影响
3 讨论
研究表明,脓毒血症患者发病早期,内毒素可刺激单核-巨噬细胞活化,导致免疫炎症瀑布样连锁反应,机体内可出现大量未成熟PMN,PMN功能障碍、凋亡延迟,其迁移、细菌清除及吞噬功能均发生异常,导致机体出现持续的免疫紊乱及严重感染[7,8]。本研究显示,与健康志愿者相比,脓毒血症患者在6、12 h时PMN凋亡水平显著降低,提示脓毒血症患者体内PMN的凋亡发生延迟,可能促进机体炎症反应进展,加重脓毒血症患者的病情,因此,改善患者体内PMN的凋亡延迟,可能有利于改善脓毒血症患者的预后,提高治愈率。推测脓毒血症患者体内可能存在一些抑制PMN凋亡的物质。
最新研究发现,PMN表面的协同抑制分子PD-L1在人体发生严重感染时呈高表达,PMN的活性受到明显抑制[9,10]。提示PD-L1可能成为脓毒血症患者的潜在治疗靶点,但其与脓毒血症患者PMN凋亡之间的关系研究报道较少。本研究结果显示,与健康志愿者相比,脓毒血症患者在6、12 h时PD-L1表达水平显著提高,且PMN 6、12 h的凋亡率与6、12 h PD-L1表达水平呈显著负相关,提示PD-L1可能是介导脓毒血症患者外周血PMN凋亡延迟的重要因子。
动物研究显示,相较于野生型小鼠,基因敲除PD-L1的脓毒血症小鼠生存时间显著延长,炎症因子表达水平显著降低,进一步提示PD-L1在脓毒血症的病程进展中发挥重要作用。基于此,本研究观察了沉默PD-L1基因对脓毒血症大鼠外周血PMN凋亡的影响,结果显示,模型组6、12 h血清PMN凋亡率显著低于假手术组同时段水平,且模型组各时间点PMN中凋亡相关蛋白Cleaved caspase-3表达量亦显著低于假手术组同时段水平,提示脓毒血症大鼠体内PMN凋亡发生延迟。而实验组6、12 h PMN凋亡率显著高于模型组同时段凋亡率,且实验组各时间点Cleaved caspase-3表达量显著高于模型组同时段水平。提示沉默PD-L1基因能够改善脓毒血症大鼠PMN凋亡延迟的状态,促进细胞凋亡,与本研究在脓毒血症患者体内的检测结果一致。
研究发现,PKC介导的NF-κB信号通路在炎症性疾病的发病中发挥关键作用[11,12]。当PKC-α被激活后,可降解IκBα的磷酸化,从而促进NF-κB与抑制性蛋白IκB形成复合物,使NF-κB磷酸化而进入细胞核,促进TNF-α及IL-1β等炎症因子释放,促进机体炎症反应的发生发展。本研究结果显示,模型组外周血PMN中PKC-α及NF-κB的磷酸化水平明显增高,显著高于假手术组,提示脓毒血症大鼠PMN中PKC-α/NF-κB信号通路被激活,促进炎症因子的释放。但实验组外周血PMN中PKC-α及NF-κB的磷酸化水平明显降低,显著低于模型组,提示沉默PD-L1基因可抑制脓毒血症大鼠PMN中PKC-α/NF-κB信号通路的激活。
综上所述,脓毒血症患者体内PMN凋亡发生延迟,而PD-L1在脓毒血症患者中呈高表达,二者表达呈显著负相关,提示PD-L1可能是调控脓毒血症患者PMN延迟凋亡的重要分子。同时,通过大鼠实验可以得出沉默PD-L1基因能够改善脓毒血症大鼠PMN凋亡延迟的状态,其机制可能与抑制脓毒血症大鼠PMN中的PKC-α-NF-κB信号通路的激活有关。由于研究时间较短,样本量过少,故未进行人体内相关信号通路的检测,使研究结论存在一定的缺陷。在下一步的研究中将和其他研究机构合作进行多中心研究,扩大病例数,深入研究影响患者PMN凋亡延迟的具体信号通路。