常用色谱法对不同产地牡丹皮差异性研究*
孙露萍
(安徽省中西医结合医院,安徽 合肥 230031)
牡丹皮来源于毛茛科的植物牡丹(PaeoniasuffruticosaAndr.)的干燥去心根皮;苦、辛,微寒;归心、肝、肾经;具有清热凉血,活血化瘀的功效[1]。牡丹皮是在中医临床上应用比较广泛的一种中药,市场年需求量约在八千吨左右,六味地黄丸、活血散瘀汤等著名方剂的配方中均包含牡丹皮,其中含有鞣质类、单萜类等主要化学成分[2]。目前,牡丹皮药材的主产地有安徽的亳州、铜陵与陕西商洛、山东菏泽等地,其中安徽的产量占总产量的50%左右。各相关记载与现代研究,皆首推铜陵凤凰山一带的“凤丹”为最优,因此称其为道地药材,闻名于海内外[3-5]。牡丹皮的药用部位的化合物的种类与含量均易受到种属、气候、种植环境等的影响,进而影响牡丹皮及其它相关产品的质量;现如今牡丹皮药材的质控方法通常是将丹皮酚作为考察的依据和指标来定性或定量的,很显然,这样的做法既不具有专属性,而且缺乏整体性。为加强牡丹皮的质量控制,用指纹图谱技术研究牡丹皮药材,对其质控方法与标准等的完善具有非常重要的意义。本文通过对不同产地牡丹皮薄层色谱法鉴别、HPLC法测定含量和指纹图谱,来区分不同产地的牡丹皮,并通过结合两种主要有效成分丹皮酚、芍药苷的定量检测,对不同产地的牡丹皮药材的质量评估体系进行了完善和补充。
1 实验材料
1.1 药 材
多批次牡丹皮(采收地见表1),经鉴定为毛茛科的植物牡丹的干燥去心根皮;牡丹皮的对照药材(采购自中国食品药品检定研究院,批号:121490-201102)。

表1 牡丹皮采收地Table 1 Moutans Cortex harvesting areas
1.2 仪 器
Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm);SPDM-10Avp DAD检测器,岛津;LC-10ADvp泵,CTO-10AC柱温箱,SIL-10A自动进样器,SCL-10A控制器,LC Solution色谱工作站;AB135-S型电子天平,瑞士梅特勒。
1.3 试剂与耗材
色谱甲醇、乙腈,纯化水,芍药苷对照品(批号MUST-13113009,购自成都曼斯特生物科技有限公司,纯度99.97%),丹皮酚对照品(批号MUST-16071405,购自成都曼斯特生物科技有限公司,纯度大于98%);高效硅胶G薄层板,青岛海洋公司。
2 不同产地牡丹皮薄层检视
2.1 丹皮酚薄层色谱鉴定
取牡丹皮粉末各0.5 g,置于25 mL锥形瓶,加甲醇10 mL,称量,密塞超声20 min,用甲醇补足失重,作为供试品溶液。取丹皮酚适量,加甲醇制成0.50 mg·mL-1溶液为丹皮酚对照品。取对照品溶液与各样品溶液各10 μL,分别点于同一块硅胶G板上,以正己烷-乙酸乙酯(2:1)为展开剂,展开,取出,晾干,喷以三氯化铁乙醇溶液,显色。

图1 丹皮酚薄层色谱鉴别 (从左到右依次为丹皮酚对照品、1、2、4、5、7、9)Fig.1 TLC identification of Paeonol (from left to right: paeonol reference substance, 1, 2, 4, 5, 7, 9)
2.2 芍药苷薄层色谱鉴定

图2 芍药苷薄层色谱鉴别Fig.2 TLC identification of Paeoniflorin
取牡丹皮粉末0.5 g,置于25 mL锥形瓶,甲醇10 mL,称量,密塞超声20 min,用甲醇补足失重,作为供试品溶液。取芍药苷适量,加甲醇制成0.50 mg·mL-1溶液为芍药苷对照品。取对照品溶液与各样品溶液各10 μL,分别点于同一块硅胶G板上,以氯仿:乙酸乙酯:甲醇:甲酸(40:5:10:0.2)为展开剂,展开,取出,晾干,喷以5%香草醛硫酸乙醇溶液,在105 ℃加热至斑点显色清晰。
2.3 薄层检视总结
经薄层鉴别,不同产地牡丹皮均含有芍药苷和丹皮酚,期望通过薄层方法对不同产地牡丹皮进行区分难度较大,而薄层检视长处在于定性鉴别,方法简单快捷,适用于快速检查,为更好的区分不同产地牡丹皮,因此对不同牡丹皮中芍药苷和丹皮酚进行含量测定。
3 牡丹皮芍药苷与丹皮酚的含量测定[6-9]
3.1 色谱条件
色谱柱:选用Phenomenex Luna C18柱(250 mm×4.6 mm,5 μm);流动相:0.1%甲酸溶液的水(A)-乙腈(B),梯度洗脱0~15 min(10%B~20%B),15~27 min(20%B),27~40 min(20%B~30%B),40~60 min(30%~50%B);检测波长:选取230 nm和274 nm(中国药典所规定的芍药苷与丹皮酚的检测波长);柱温:30 ℃;流速:1 mL·min-1;进样量:10 μL。
3.2 对照品溶液的制备
分别取2.36 mg芍药苷标准品与3.99 mg丹皮酚标准品,置于10 mL的容量瓶中,加入色谱甲醇定容到容量瓶的刻度线,即可得到本次实验所需的混合对照品(芍药苷与丹皮酚)溶液。混合对照色谱图如图3所示。

图3 混合对照色谱图Fig.3 Mixed standers chromatogram
3.3 供试品溶液的制备
精密称定0.5 g的各样品粗粉,分别置于具塞锥形瓶中;再精确添加50 mL色谱甲醇,密塞,称定重量;超声处理30 min后,取出,待冷却,再次称定重量,用甲醇补足减失的重量;摇匀,用0.45 μm微孔滤膜滤过,即可得到本次实验所需的供试品溶液。
3.4 线性关系考察
精密称定芍药苷3.13 mg、丹皮酚5.28 mg,根据2.2项下所述配制方法来配制,然后用移液管吸取5 mL第一份样品溶液置于另一10 mL容量瓶,再用色谱甲醇溶液定容到容量瓶的刻度线,摇晃均匀后,即得第二份样品。第三份样品取第二份样品溶液5 mL,定容,以此类推,共制成七份对照品标准溶液。每次进样10 μL检测,记录并分析HPLC色谱图,以所测得的色谱峰峰面积A作为线性回归的Y坐标,样品的浓度(μg/mL)作为线性回归的X坐标进行回归计算,得芍药苷的线性回归方程为Y=11267X-35242,r=0.9991(n=7),丹皮酚的线性回归方程为Y=44643X+65589,r=0.9999(n=7)。由结果可知芍药苷和丹皮酚两者分别在4.89~313 μg/mL与8.25~528 μg/mL浓度范围内,丹皮酚与芍药苷的色谱峰峰面积与其浓度之间有着较好的线性关系。
3.5 精密度实验
精密称定0.5 g样品粗粉,依照3.3项下所述的配制溶液的方法来配制,每次进样10 μL所配制的供试品溶液,依照3.1项所述条件下连续进样5次检测,以进样检测的芍药苷和丹皮酚的色谱峰峰面积计算,两种化学成分的相对标准偏差(RSD)分别为 2.93%、1.96%,表明仪器精密度良好。
3.6 重复性实验
精密称定同一批样品的(根皮)粗粉共5份,每份0.5 g,依照3.3项下所述配制方法来配制,各样品溶液分别进样10 μL,根据3.1项下所述的条件分别进样检测,以进样检测的的含量来计算,芍药苷和丹皮酚两者的相对标准偏差(RSD)分别为1.93%和1.77%,表明该方法重复性良好。
3.7 稳定性实验
精密称定0.5 g样品(根皮)粗粉,依照3.3项下所述的配制溶液的方法来配制,每次进样10 μL样品溶液,根据上述的色谱条件先后在0、2、4、6、8、12 h进样检测,以测定的芍药苷和丹皮酚色谱峰的峰面积计算,得到芍药苷与丹皮酚的相对标准偏差(RSD)分别为1.91%、2.31%(如表4所示),说明供试品溶液在12 h内较稳定。
3.8 加样回收率实验
精密称定样品(根皮)粗粉共6份,每份0.25 g,每份样品中加入一定量的芍药苷和丹皮酚标准照品,根据3.3项下所述的配制溶液的方法,配制供试溶液,每份进样10 μL检测,记录并分析HPLC色谱,分别计算芍药苷与丹皮酚的回收率(详见表5、表6),得到芍药苷与丹皮酚二者的平均回收率分别为98.05%、98.72%,芍药苷与丹皮酚二者的相对标准偏差(RSD)均小于5%(如表2、表3所示),表明回收率符合该实验研究的规定。

表2 芍药苷加样回收试验(n=6)Table 2 Paeoniflorin sample recovery test (n=6)

表3 丹皮酚加样回收试验(n=6)Table 3 Paeonol sample recovery test (n=6)
3.9 样品测定与数据分析
按3.1项下色谱条件,对上述各供试品与对照品溶液进行测定,每次进样10 μL,经计算,得到不同产地中丹皮酚和芍药苷的含量,质量分数平均值结果见表4。
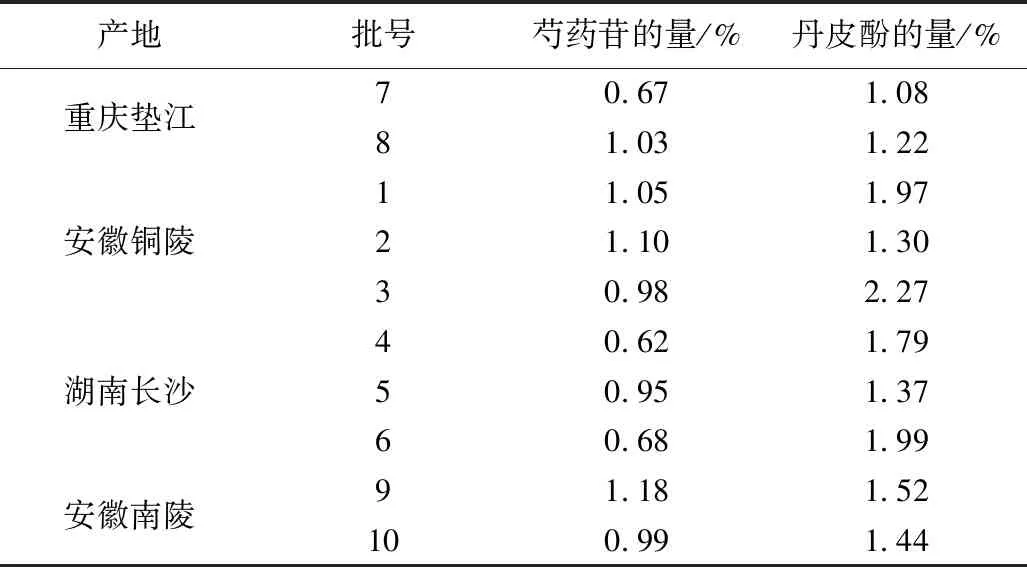
表4 各样品中芍药苷与丹皮酚的质量分数Table 4 The mass fraction of paeoniflorin and paeonol in each sample
利用SPSS数据处理软件,对10批样品测得的芍药苷与丹皮酚的含量数据进行方差分析,以显示产地与含量之间的关系,结果表明不同产地牡丹皮芍药苷与丹皮酚的含量有显著性差异。
4 牡丹皮HPLC指纹图谱研究[10-13]
4.1 色谱条件
同2.1。
4.2 对照品溶液的制备
同2.2。
4.3 供试品溶液的制备
同2.3。
4.4 精密度试验
精密称定0.5 g的样品(根皮)粗粉,根据3.3项下配制的方法来配制,每次进样10 μL所配制的样品溶液,依照3.1项所述的实验条件连续进样5次检测。因2号峰(芍药苷峰)出峰时间适中,峰面积大,所以选择2号峰为参照峰,计算其余5个峰的相对峰面积,并计算RSD的值。结果显示,它们的相对标准偏差(RSD)分别为0.70%、0.00%、1.72%、2.90%、1.01%、0.54%、2.92%、1.62%、0.45%、0.61%,均小于3%,表明仪器精密度较好。
4.5 重复性实验
精密称定同一批样品的(根皮)粗粉共五份,每份0.5 g,根据3.3项下溶液配制的方法来配制,每次进样10 μL的各样品溶液,根据3.1项所述的条件分别进行检测。因2号峰(芍药苷峰)出峰时间适中,峰面积大,所以选择2号峰为参照峰,计算其余5个峰的相对峰面积,并计算RSD的值。结果显示,它们的相对标准偏差(RSD)为0.53%、0.00%、1.48%、2.07%、1.21%、1.80%均小于3%,说明方法的重复性良好。
4.6 稳定性实验
精密称定0.5 g的样品(根皮)粗粉,根据3.3项下的溶液配制方法来配制,每次进样10 μL的样品溶液,按照3.1项下所述的条件先后在0、2、4、6、8、12小时进样检测。因2号峰(芍药苷峰)出峰时间适中,峰面积大,所以选择2号峰为参照峰,计算其余5个峰的相对峰面积,并计算RSD的值。结果显示,它们的相对标准偏差(RSD) 为2.04%、0.00%、0.61%、2.80%、1.13%、1.01%、4.24%、3.03%、1.03%、0.55%,均小于3%,说明供试品溶液在12 h内较稳定。
4.7 样品的HPLC指纹图谱的测定
根据3.3项下供试品溶液配制方法,首先依法配制好各样品溶液,然后分别进样,每次10 μL,根据3.1项下的实验条件进样检测,记录分析各样品60 min的HPLC色谱图。结果如图4所示。

图4 不同产地牡丹皮根皮样品指纹图谱与对照药材叠加图Fig.4 The fingerprint of Moutans Cortex samples from different places and the superposition of the control medicinal materials
4.8 样品的HPLC指纹图谱相似度分析

表5 不同产地样品HPLC与对照药材图谱相似度比较Table 5 Comparison of similarity of HPLC and control medicinal materials of samples from different origins
利用国家药典委员会发布的《中药色谱指纹图谱相似度评价系统2004A版》软件,将AIA格式的HPLC色谱图文件依次导入软件,将相同产地的色谱图通过指纹图谱软件先进行合成,拟合产地指纹图谱,再将各产地指纹图谱进行比较。结果如表5所示,不同产地的牡丹皮药材相似度为0.912~0.985,安徽铜陵产牡丹皮指纹图谱与对照药材的指纹图谱的相似度最高,各产地间指纹图谱相似度存在差异,表明指纹图谱可用来对不同产地间牡丹皮进行比较。
5 结论与讨论
5.1 检测波长的选定
实验在用HPLC法对不同产地牡丹皮进行指纹图谱的研究时,利用DAD全波长扫描检测,在190~400 nm的色谱图中,参考丹皮酚的检测波长,选定274 nm作为本次实验研究的检测波长时,HPLC显示的色谱峰较少;参考芍药苷的检测波长,选取药典所规定的芍药苷检测波长230 nm作为指纹图谱的检测波长时,色谱图基线漂移明显;选取248 nm为检测波长时,所显示的HPLC色谱图基线平稳、峰的数目较多,并且峰的峰形与分离度都较好,能够实现较为理想的分离效果,故此选择248 nm作为检测波长对牡丹皮及其它样品HPLC 指纹图谱研究。
5.2 含量测定与指纹图谱相似度分析结果讨论
化学成分含量的比较往往是鉴定、区分中药好坏的重要指标之一,但单纯的比较单个成分的多少进行产地区分,缺乏整体观念,而指纹图谱法有着信息量大,“整体性”和“模糊性”为显著特点,因此通过不同产地指纹图谱进行比较可以对不同产地药材进行区分。本文采用含量测定与指纹图测定同时进行的方法,在保证区分度的前提下,相较于单独进行含测和指纹图谱分析,减少分析所需时长,与一测多评相符合,可作为牡丹皮质量评价的补充。

