高浓度葡萄糖诱导的神经元毒性及分子机制
常梦圆 孙文静 徐新军 付晓艳
山东第一医科大学(山东省医学科学院)基础医学院,山东 泰安 271000
糖尿病是以血糖升高为主要症状的慢性病,患病人数逐年增加,长期慢性高血糖可造成毛细血管基底膜增厚,使管腔狭窄,加上糖尿病患者脂代谢紊乱,造成血液黏稠度升高,血流缓慢,可致脑血流量减少而引发一系列问题。近年来,糖尿病对中枢神经系统的影响已引起人们的广泛重视,大量临床和实验研究表明,糖尿病人更容易发生脑卒中[1],长期高糖可引起中枢神经系统损害,进而引起认知、学习等能力减退,发展为糖尿病脑病[2],即糖尿病引起的认知障碍和大脑的神经生理及结构改变[3-4]。高浓度葡萄糖介导的神经毒性严重限制了其临床治疗效果。因此,探讨高糖介导的神经毒性及可能的分子机制对糖尿病神经病变的预防及治疗具有重要的研究意义和临床价值。
1 资料与方法
1.1 材料
PC12大鼠嗜铬瘤细胞系购自美国ATCC公司;MTT和PI购自Sigma公司;BCA蛋白定量试剂盒、线粒体膜电位检测探针 (JC-1) 均购自江苏碧云天生物技术研究所;所有抗体均购自美国CST公司。
1.2 方法
1.2.1细胞培养 使用含有10%胎牛血清的DMEM培养基来培养PC12细胞,置于37℃,5% CO2的培养箱中,取对数生长期的细胞用于实验。
1.2.2药物处理及细胞活性检测 取对数生长期的PC12细胞,以每孔8×103个细胞的密度接种于96孔板,预培养24 h,待细胞贴壁后进行高糖毒性检测。分别以100、200、400、600和800 mM 5个浓度的葡萄糖处理PC12细胞48 h,随后加入5 mg/mL的MTT溶液20 μL,作用6 h后弃掉上清,每孔加入150 μL的DMSO,轻微震荡20 min后570 nm处读取光吸收值。以正常细胞活性的百分比来反映细胞生长情况,细胞活性(%)=(药物处理组光吸收值/正常对照组光吸收值)×100%。
1.2.3流式细胞仪检测细胞凋亡 细胞经药物处理后,胰酶消化、离心收集细胞,PBS洗2次,弃掉多余的培养基。用预冷的75%的酒精固定细胞过夜,次日离心弃掉酒精,PBS洗2次,加入PI染液,于37℃避光染色40 min;细胞过滤后经流式细胞仪检测细胞凋亡及细胞周期分布,以Sub-G1峰间接定量细胞凋亡比例。
1.2.4线粒体膜电位检测 将6×105个PC12细胞接种于6 cm的培养皿中;细胞分别经200、400、600 mM葡萄糖处理48 h后,加入终浓度10 μM的JC-1探针孵育10 min;PBS洗2次,荧光显微镜观察线粒体膜电位的变化。以红色荧光向绿色荧光的转变反应线粒体膜电位的耗散。
1.2.5Western blotting检测蛋白表达 将8×105个PC12细胞接种至9 cm的培养皿;细胞分别经200、400、600 mM葡萄糖处理48 h后,用细胞刮刀刮取细胞,离心收集;RIPA裂解液裂解细胞,提取总蛋白;BCA试剂盒蛋白定量;总蛋白40 μg/孔上样,SDS-PAGE电泳,浓缩胶70 V,40 min;分离胶110 V,1.5 h;转膜,110 V,75 min;5%脱脂奶粉室温固定2 h;兔源一抗以1∶1 000稀释,4℃孵育过夜;次日,TBST洗3次,每次5 min;孵育HRP标记的羊抗兔二抗IgG (1∶2 000),室温2 h;TBST洗3次,每次5 min;ECL增强型发光液显色,Bio-Rad成像系统成像;β-actin作为阳性内参照。
1.3 统计学处理
2 结 果
2.1 高浓度葡萄糖对PC12细胞活性的影响
首先筛选了不同剂量葡糖糖对PC12细胞的毒性。如图1所示,PC12细胞经不同浓度葡萄糖处理48 h后,剂量依赖性地抑制了PC12细胞的生长,表现为细胞活性的下降。如600 mM 和800 mM葡萄糖处理48 h,细胞活性分别降低到64.4%和52.9%,与正常对照组相比差异具有统计学意义(P<0.01)。高浓度的葡萄糖表现出剂量依赖性的细胞毒性。

与对照组比较,*P<0.05,**P<0.01。图1 葡萄糖对PC12细胞成活率的影响
2.2 高浓度葡萄糖对PC12细胞凋亡的影响
为检测PC12细胞死亡的机制,细胞分别经200、400、600 mM葡萄糖处理48 h后,用PI染色,使用流式细胞仪检测细胞凋亡。凋亡的细胞将会发生DNA的断裂,出现一个亚二倍体峰,故本实验以亚二倍体峰 (Sub-G1)来反应细胞凋亡情况。如图2所示,与正常对照组相比,200 mM葡萄糖处理仅诱导了轻微的细胞凋亡,凋亡比例为6.3%;400 mM葡萄糖处理诱导了明显的细胞凋亡,表现为Sub-G1峰的显著升高,凋亡细胞的比例上升到36.3%(P<0.01);而600 mM葡萄糖处理组凋亡比例进一步升高,达到51.2%(P<0.01)。细胞凋亡比例的升高伴随G0/G1期和G2/M期的升高,S期的降低(表1)。以上结果表明:高糖抑制PC12细胞生长主要是通过诱导细胞凋亡来实现的。

图2 葡萄糖对PC12细胞凋亡的影响
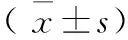
表1 葡萄糖对PC12细胞凋亡及细胞周期的影响
2.3 高浓度葡萄糖对PC12细胞线粒体膜电位的影响
为进一步探讨高糖诱导的细胞凋亡机制,我们采用JC-1探针来检测线粒体膜电位的变化。如图3所示,随着葡萄糖浓度的增高,红色荧光逐渐减弱,绿色荧光逐渐增强,提示葡萄糖剂量依赖性地降低了PC12细胞线粒体膜电位。结果表明:高浓度葡萄糖通过启动线粒体膜电位耗散启动了PC12细胞线粒体介导的凋亡。

红色代表线粒体基质荧光,绿色代表细胞质基质荧光;红色荧光向绿色荧光的转变代表线粒体膜电位的降低。图3 葡萄糖对PC12细胞线粒体膜电位的影响
2.4 高浓度葡萄糖对Caspase-3和Caspase-9表达的影响
为进一步确认高浓度葡萄糖诱导的细胞凋亡,本实验用Western blotting方法检测了活性Caspase-3和Caspase-9的表达。Caspase-3的活化可直接启动凋亡程序,Caspase-9作为线粒体凋亡的启动者,在启动线粒体介导的凋亡中起着至关重要的作用。结果如图4所示,葡萄糖浓度依赖性地增强了活性Caspase-3和活性Caspase-9的表达,进一步从蛋白水平证实了葡萄糖启动了PC12细胞线粒体介导的凋亡。

图4 葡萄糖对活性Caspase-3和Caspase-9表达的影响
3 讨 论
糖尿病是一种以血糖升高为主要特征的代谢障碍综合征,流行病学显示其发病率呈显著升高的趋势。证据表明,糖尿病对神经的损伤[5-6]、认知功能的影响与持续的高血糖水平有密切关系[7]。糖尿病患者持续高血糖介导的神经毒性,严重限制了其临床治疗效果,影响了患者的生命健康和生活质量[8]。因此,深入研究高糖介导的神经毒性及可能的分子机制,有助于理解其在脑老化等中枢神经系统退行性变中的作用,对糖尿病神经病变的预防及治疗具有重要的研究意义和临床价值。
本研究结果显示,葡萄糖剂量依赖性的抑制了PC12细胞生长,主要是通过诱导细胞凋亡实现的,表现为Sub-G1峰的升高。线粒体膜电位在调控线粒体凋亡通路方面起到至关重要的作用[9]。线粒体膜电位的降低是细胞凋亡的一个早期事件,往往早于线粒体内凋亡因子的释放[10]。线粒体膜电位的降低,进而会促进线粒体内部因子的释放,如活性氧自由基、凋亡诱导因子、细胞色素C等[11]。本研究中,高浓度葡萄糖的处理有效诱导了PC12细胞线粒体膜电位的降低,这是高糖诱导PC12细胞凋亡的关键,提示葡萄糖诱导细胞凋亡可能是通过线粒体介导的凋亡通路。Caspase是一类水解酶,其激活后可传递凋亡信号。Caspase-3是凋亡的执行者,可汇集死亡受体和线粒体信号,最终引起细胞凋亡[12]。本研究中,Western blotting从蛋白水平检测到Caspase-3的激活,进一步证实葡萄糖诱导了PC12细胞凋亡。与对照组相比,高浓度葡萄糖有效地诱导了PC12细胞Caspase-3和Caspase-9的激活,表明高浓度葡萄糖诱导了PC12细胞线粒体介导的凋亡。总之,高糖可通过诱导细胞凋亡抑制PC12细胞生长,预示着潜在的神经毒性,提示抑制高糖介导的神经毒性可能是治疗糖尿病脑病的新策略。

