炊具用钢氧化动力学和氧化铁皮结构研究
王 进 曹光明 王 皓 周忠祥 裴新华
(1.宝钢股份中央研究院梅钢技术中心,江苏 南京 210039; 2.东北大学轧制技术及连轧自动化国家重点实验室,辽宁 沈阳 110819)
热轧过程中钢板表面形成的氧化铁皮是影响钢板表面质量的最重要因素之一[1- 2]。高温轧制后钢板表面氧化皮包括极薄的Fe2O3外层、Fe3O4中间层及FeO内层[3]。在570 ℃以下,FeO不稳定,从高温冷却到室温会发生共析反应转变成α- Fe和Fe3O4,最终获得不同结构的氧化铁皮。
氧化铁皮控制主要包括厚度和结构两个方面。对于氧化铁皮厚度的控制,可用Wagner[4]理论来分析。Sachs等[5]通过对比纯铁与低碳钢在700~1 100 ℃下的高温氧化行为,验证了在氧气或空气中氧化增重曲线遵循抛物线规律,且低碳钢的氧化速度要比纯铁的氧化速度低。Quadakkers等[6]建立了考虑晶界效应的有效计算氧化动力学的理论算法。对于氧化铁皮结构的控制,Chen等[7]通过大量研究发现:高温下FeO会发生共析反应,最终得到片层状的Fe+Fe3O4组织,且含量随着在共析区间停留时间的延长而有较大变化。Gleeson等[8]研究证明:机械除鳞过程中,在基体- 氧化铁皮界面氧化铁皮结构中保留的Fe3O4越多,除鳞效果越差。
梅钢生产的炊具用钢在实际轧制过程中,由于厚度相对较薄,温度变化较大,造成热轧钢板表层的氧化铁皮有较大差异,从而引起产品表面特别是边部的氧化铁皮脱落严重。因此,本文对该炊具用钢的高温氧化行为和卷取后氧化铁皮的结构转变进行研究,并对其氧化特性及结构转变特性进行评价,最后,将试验结果应用于实际产线,以提高产品的表面质量。
1 试验材料与方法
试验钢的化学成分如表1所示。使用Setsys Evolution型高温同步热分析仪分别进行氧化增重和连续冷却转变试验。氧化增重试验过程如图1(a)所示。首先将试样悬挂于炉膛内,待天平稳定后抽真空,充入标准大气压的Ar气;然后以20 mL/min的流速继续向炉膛内充入Ar气,在保护性气氛条件下以30 ℃/min的速率将试样加热至氧化温度(1 000、1 050、1 100、1 150和1 200 ℃)。当炉温达到氧化温度时,以100 mL/min的流速充入空气,然后等温氧化90 min生成氧化铁皮。高温氧化试验结束后,再将气路切换至Ar气,最后以30 ℃/min的速率将试样冷却至室温。

表1 试验钢的化学成分(质量分数)
连续冷却转变试验工艺如图1(b)所示。以同样步骤将炉膛抽真空并充入Ar气,然后将试样以60 ℃/min的速率升温至氧化温度1 000 ℃。之后关闭Ar气,并向炉内以100 mL/min的流速充入空气,然后等温氧化5 min生成氧化铁皮。再将试样在Ar气保护下以99 ℃/min的速率快速冷却至卷取温度(350~650 ℃),然后以不同的速率(0.5、1、5、10、25 ℃/min)冷却至室温。

图1 试验钢的(a)高温氧化和(b)连续冷却转变过程示意图
将试样镶嵌、磨制、抛光后用体积分数为4%的盐酸酒精溶液腐蚀,然后利用电子探针分析氧化铁皮的断面形貌和物相组成。最后用IPP图像处理软件统计各相面积分数,即得到氧化层中各相的比例。
2 试验结果
2.1 高温氧化行为
图2为试样在不同温度等温氧化90 min的氧化增重曲线,氧化增重结果如表2所示。从图2可以看出,试验钢的氧化过程分两个阶段,即快速氧化阶段和慢速氧化阶段。根据孙彬等[9]的试验研究,在快速氧化阶段,空气中O2能够与基体直接接触,即Fe离子与O离子的化学反应成为这个阶段氧化铁皮生长的主要控制因素,此时氧化增重速率较快,氧化增重曲线基本呈直线关系。随着氧化的进行,曲线逐渐变得平缓,进入缓慢氧化阶段,试样表面逐渐被氧化铁皮覆盖,化学反应需通过扩散来完成,氧化铁皮的生成主要受离子扩散控制,而离子扩散需要时间,因此该阶段的氧化速率降低。若氧化时间足够长,不同温度下钢的氧化增重将很缓慢,氧化曲线出现平台,并遵循抛物线规律。对不同温度下氧化增重的平方与时间进行拟合,获得氧化增重曲线直线段时间及抛物线段R2值,见表3。

图2 试验钢的氧化增重曲线

表2 试样在不同温度氧化90 min的增重

表3 不同温度下氧化增重曲线直线段时间及抛物线段R2值
根据Kofstad[10],建立氧化动力学模型为:
ΔW2=Kp·t
(1)
式中:Kp为氧化速率常数,ΔW为质量增重,t为时间。由Arrhenius公式Kp可表示为:
(2)
式中:Q为氧化反应激活能,J/mol;T为氧化温度,K;R为气体常数8.314 J/(mol·K);A为模型常数。计算得出炊具用钢在空气中不同温度下的氧化速率常数Kp,见表4。

表4 炊具用钢在空气中不同温度下的氧化速率常数
对式(2)两边取对数得:
(3)
以1/T为自变量、lnKp为因变量作散点图,拟合出一条直线。根据直线的斜率即可计算出试验钢的氧化激活能Q,如图3所示。根据Q值可计算出试验钢在特定温度下氧化不同时间后,单位面积上的氧化铁皮增重ΔW,然后推算出氧化铁皮的厚度。通过拟合得到炊具用钢的激活能为161.283 kJ/mol。与杨名[11]研究得出的Q值大于192 kJ/mol的Q235钢相比,炊具用钢在同样温度下更容易被氧化。
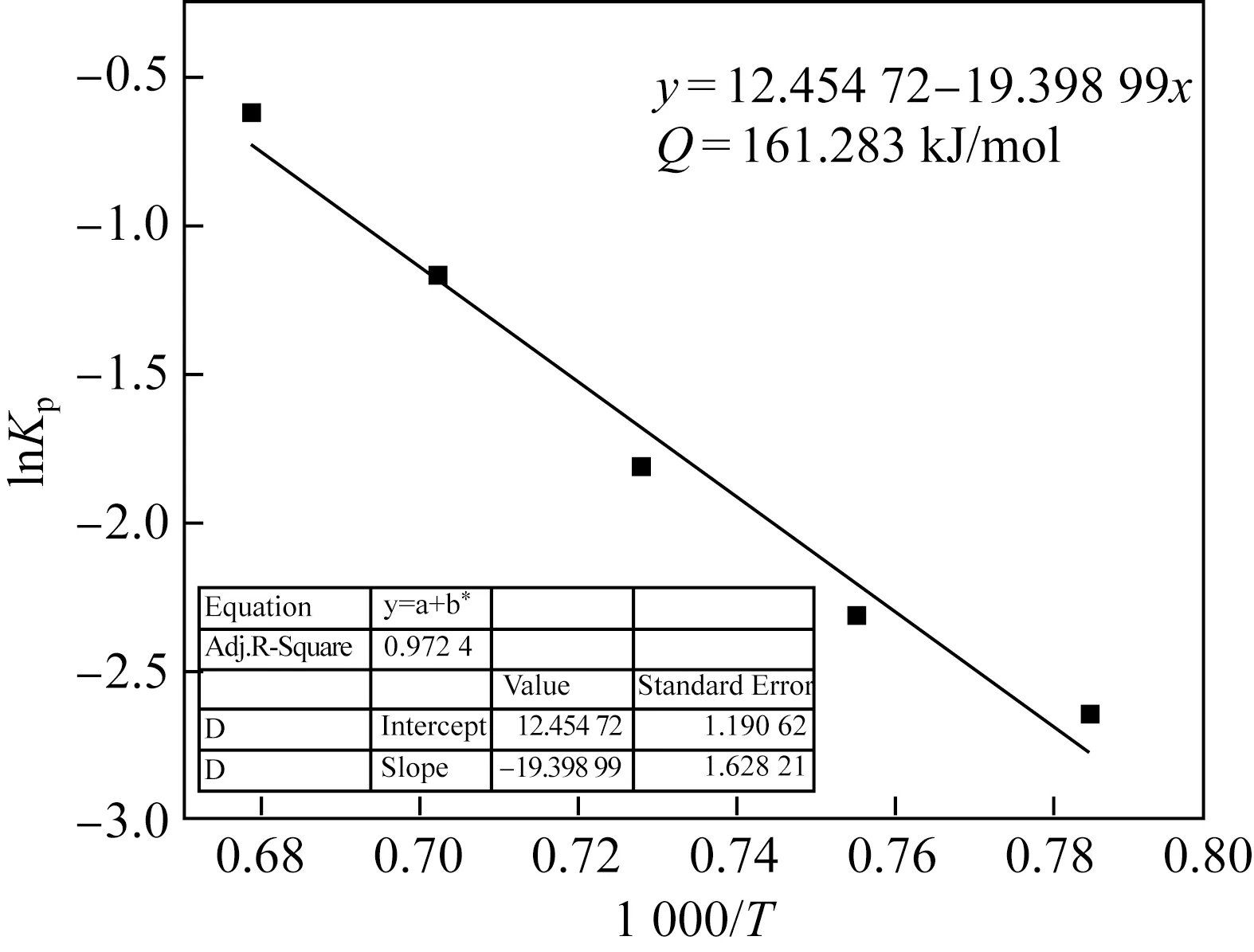
图3 试验钢lnKp与1 000/T拟合关系曲线
试验钢在不同温度氧化后氧化铁皮的断面形貌如图4所示。可以看出,氧化铁皮均由外层Fe2O3+中间层Fe3O4+内层FeO组成。随着氧化温度的升高,氧化铁皮的结构有一定差异,FeO层厚度比例逐渐减小,而Fe2O3和Fe3O4层厚度的比例逐渐增大。这是由于氧化温度越高,离子扩散越充分,氧化过程加速,从而促进了高价氧化物的形成。

图4 试验钢在不同温度氧化90 min后的氧化铁皮断面形貌
2.2 氧化铁皮结构转变
根据试验结果,在同一温度下,当冷却速度较慢时,FeO在共析区间停留时间长,有充足的扩散时间完成共析转变;而当冷速较快时,氧化铁皮中共析组织含量较少, 未转变的FeO或先共析Fe3O4含量增加。而在不同温度下,共析转变量变化较大,在500 ℃时达到最大。根据试验结果绘制出的试验钢连续冷却转变(CCT)曲线如图5所示。可以看出,CCT曲线的“鼻尖”温度在500 ℃左右,在此温度范围停留时间越长,氧化铁皮中共析组织含量越高。

图5 试验钢的CCT曲线
根据Hoffmann[12],在570 ℃以下,Fe3O4析出物总是在靠近外侧的FeO层中,在含氧量较高的区域优先析出,形成了先于共析反应产物析出的先共析Fe3O4。Paidassi[13]认为,在冷却过程中很难阻止先共析的Fe3O4在FeO层中生成,并且FeO层中的含氧量越高其越不稳定。当FeO层中的含氧量逐渐达到过饱和状态时,导致在靠近Fe3O4层的FeO层中析出先共析Fe3O4,其反应方程式如式(4)所示。Paidassi的研究也表明:温度低于450 ℃时,1-y=0.975。
(4)
温度进一步降低,FeO层达到了平衡成分,这时在贫氧区形成了单质Fe晶核,同时在富氧区Fe3O4形核,二者共同形成了一个共析反应产物的晶核。共析反应产物的晶核形成后继续长大,最后形成了片层状的Fe3O4/Fe共析转变产物。随着温度继续下降有一定的过冷度时,具有共析成分的FeO发生共析反应,如式(5)所示:
4Fe1-yO→Fe3O4+(1-4y)Fe
(5)
因此,结合图5的连续冷却转变曲线,通过合理控制卷取温度和冷却速率,可以控制FeO的转变行为,从而达到控制氧化铁皮结构的目的。
3 工业应用
梅钢生产的2.5 mm厚炊具用钢板表面氧化铁皮厚度为5.5~6.5 μm,且边部存在大范围的氧化皮脱落现象。根据上述试验结果对加热制度与卷取温度进行了调整。如图6和图7所示,工艺改进后的氧化铁皮厚度减小至4~5 μm,结构中共析组织比例增加了约10%。开平矫直后,钢板边部氧化铁皮脱落的现象得到了有效控制。

图6 工艺改进前(a)、后(b)氧化铁皮结构与厚度

图7 工艺改进后钢板表面状态
4 结论
(1)通过高温氧化试验测定炊具用钢的氧化增重曲线,并计算出该钢种的激活能为161.283 kJ/mol,相较于Q235钢,炊具用钢的氧化激活能更小,在同样温度下更容易被氧化。
(2) 根据氧化铁皮结构及共析反应绘制的氧化铁皮等温转变曲线,均遵循“C”曲线规律。FeO层发生先共析转变和共析转变的“鼻温”为500 ℃。
(3) 结合连续冷却结构转变曲线,通过合理控制卷取温度和冷却速率,氧化铁皮明显减薄,结构中共析组织比例增加。开平矫直后,钢板边部氧化铁皮大量脱落的现象得到了有效控制。

