COVID-19伴有糖尿病患者病情进展的危险因素总结
刘玉凤,蒋恩社,贾田田,王琳琳
(河南大学护理与健康学院,河南 开封)
0 引言
自2019年12月以来,在中国武汉首次出现了一种新型冠状病毒肺炎(coronavirus disease 2019, COVID-19),严重可导致急性呼吸综合征。该病毒迅速传播到187个国家,截止到6月3日,在全球范围内该病已经累计确诊638余万人,造成38余万人死亡。《中华人民共和国传染病防治法》已把该病纳入乙类传染病,但按甲类传染病处理。同时在国家卫生健康委办公厅发布的《新型冠状病毒肺炎诊疗方案(试行第七版)》中明确提出“老年人和有慢性基础疾病者预后较差[1]”。糖尿病是一种常见的免疫应答低下的慢性病,而我国糖尿病的发病率约为10.4%[2]。先前有研究称香港75岁及以上的糖尿病患者因肺炎而死亡的比率较这个年龄组别因心血管疾病及癌症而死亡的比率高[3]。在《Lancet》上发表的有关COVID-19 的研究中表示,41例 COVID-19的病例合并其他疾病感染者占32%,而合并糖尿病的感染患者占20%,居于首位[4]。在第三项研究中,入院治疗的140名COVID-19患者中仅有3人患有高血压,但患有糖尿病的感染者占12%[5]。意大利的最新数据显示,在死于SARS-CoV-2的患者中,超过三分之二的患者患有糖尿病[6]。COVID-19伴有糖尿病患者在治疗中有别与伴有其他慢性基础疾病的一些特点,而其病情的进展受到一些危险因素的影响。本文对近段时间以来新冠肺炎伴有糖尿病患者临床特点及影响疾病进展的一些危险因素做一综述,以期为在临床上为新冠肺炎伴有糖尿病患者的康复和护理提供参考。
1 SARS-CoV-2的基本特征
冠状病毒(coronavirus, CoV)是种广泛分布于人类及其他哺乳动物之间的一种无节段、有包膜的且现今发现最大的正链 RNA 病毒,从血清学和基因学上讲,分为 α,β,ɣ 和 δ 属冠状病毒[7,8]。现被发现的冠状病毒中有7种冠状病毒可致病,其中 SARS-CoV-2同 HCoV-OC43、SARS-CoV、MERSCoV、HCoV-HKUI均为β冠状病毒。SARS-CoV-2是被膜包围的单股正链RNA病毒, 直径为75-140nm,电镜下多呈圆形或者椭圆形[9]。同SARS-CoV一样,该病毒的包膜也是由RNA和衣壳蛋白组成,SARS-CoV-2 的基因组是由6个主要的功能性开放阅读框构成,SARS-CoV-2主要包含主蛋白酶、木瓜蛋白酶类水解酶、RNA 解旋酶、 RNA 聚合酶等8种非结构蛋白和棘突蛋白以及ACE2等6种结构蛋白[10]。研究发现SARS-CoV-2以ACE2作为 ACE2 表达细胞的受体,同时也可以编码附加糖蛋白[11,12]。SARS-CoV-2的传播途径主要通过接触、空气、飞沫传播,也有可能存在气溶胶传播,粪便传播是否存在仍不确定。
2 影响COVID-19伴有糖尿病患者病情进展的机制
2.1 COVID-19伴有糖尿病患者的免疫损伤
目前研究表明SARS-CoV2通过附着进入宿主细胞、复制酶的翻译及复制转录复合体组装、基因复合体组装、基因复制转录、结构性蛋白翻译及病毒粒组装和释放等途径感染宿主[9]。SARS-CoV2通过病毒颗粒外层的S蛋白受体同广泛分布在人体中的ACE2的靶向结合致使病毒的双层磷脂同细胞膜发生融合从而进入细胞,表面蛋白同ACE2间有比SARS病毒更强的结合自由能[11,13],且有研究表明蛋白受体也可同人体胰腺内分泌组织中的ACE2结合,继而推测该病毒可侵入攻击胰岛细胞,导致胰岛细胞受损,进一步加重糖尿病患者的病情[14]。ACE抑制剂和血管紧张素II受体阻滞剂是治疗1型和2型糖尿病的常用药,且在治疗中糖尿病患者ACE2的表达会显著增加[15]。因此当糖尿病患者感染新冠病毒时,可加重损伤机体的免疫系统,进而影响疾病的进展和预后。
2.2 COVID-19伴有糖尿病患者体内的急性炎症反应
SARS-CoV-2进入机体后会激活机体的先天免疫系统并与之对抗,这时机体将会释放大量的细胞因子致使出现细胞因子风暴并且诱发炎症反应,严重可导致肺损伤[16]。糖尿病患者本身就存在免疫细胞减少等一系列的免疫功能的异常,同时糖尿病患者也是病毒感染的高危人群之一。一方面炎症细胞因子可导致胰岛β细胞的结构与功能异常,加速胰岛β细胞衰亡,引起胰岛素分泌不足,另一方面,由于炎症细胞因子释放会损害内皮细胞、导致胰岛素转运障碍和胰岛分泌不足,因此可造成血糖升高。所以可推测COVID-19导致血糖升高从而加重糖尿病患者的病情,而基础病的加重会进一步影响COVID-19的病情进展及预后。
2.3 COVID-19伴有糖尿病患者的焦虑情绪可诱发高血糖
研究表明当机体受到外界应急源的刺激时,机体中枢系统环路通过各个神经核团和神经环路产生一系列焦虑行为,同时升高基础血糖在应急反应时为机体提供能量并且调节、控制胰高血糖素、肾上腺皮质激素、肾上腺素等应急激素合成,释放并维持应激反应[17]。COVID-19伴有糖尿病患者不仅要忍受长期的糖尿病带来的身体及心理上痛苦,而且还要面对被感染新冠病毒的事实以及每天从互联网等多角度获得的疫情相关信息,其心理承受的压力要比无合并症的感染者要多。有学者在对148例新冠肺炎患者调查研究中发现新冠肺炎患者存在一定程度的焦虑与抑郁情绪,其中焦虑发生率占21.63%[18]。Zhou J等学者表明COVID-19引起的焦虑可诱发高血糖[19,20]。由此推测当糖尿病患者得知自己被确诊为COVID-19感染后,机体就会进入应激状态,产生焦虑应激反应,诱发血糖升高,进一步加重病情,进而影响COVID-19伴有糖尿病患者的病情进展及预后。
3 COVID-19伴有糖尿病患者的临床特征
3.1 症状体征
赵勇等[21]研究表明67例新冠肺炎患者中糖尿病患者11 例,非糖尿病患者 56 例,糖尿病患者合并COVID-19感染的比例为 16.42%。在发热、咳嗽、咽痛、大便稀溏、肌痛、气短、纳差、心慌、呼吸困难、大便干结、口干、口苦、头痛症状上看,糖尿病组均高非糖尿病组。糖尿病组与非糖尿病组就体温状况相比糖尿病组患者以低热、中热为主,且在45 例发热的新冠肺炎患者中,就诊前最高体温为 40℃,平均体温为(38.59±0.64)℃(见表1)。Guo W等[3]研究认为与糖尿病患者比非糖尿病患者有更少的发热(59.5% VS 83.2%),这点和赵勇等的研究不同。

表1 67例新冠肺炎患者中两组性别、临床分型及发热情况比较[例(%)]
Zhou J等[20]在研究中回顾性分析了武汉市某定点隔离医疗中心收治的29例新冠肺炎伴有糖尿病患者,该研究采取美国临床内分泌医师协会和美国糖尿病协会建议的住院患者血糖指标进行监测和治疗,以7.8 mmol/L为餐前血糖,10.0 mmol/L为餐后血糖作为临界值[22]。在对这些患者进行的总计881次血糖检测中,有56.6%(499/881)的检测结果显示血糖异常。其中餐前血糖异常占29.4%(58/197),餐后血糖异常占64.5%(441/684)。69.0%(20/29)患者认为血糖水平不理想,10.3%(3/29)的患者至少有一次低血糖发作(<3.9mmol/L)。这些结果提示,对于COVID-19伴有糖尿病患者而言,尤其是餐后血糖患者,所采取的血糖管理策略是失败的,同时也可推测COVID-19伴有糖尿病患者血糖值较糖尿病患者在未感染COVID-19时的血糖值较高,这可对在临床中进一步控制和治疗COVID-19伴有糖尿病患者的血糖提供参考依据。
3.2 实验室检查
在Guo W等[3]的研究中选取武汉协和医院住院的174例COVID-19患者进行回顾性分析,结果表明糖尿病患者血清炎症相关生物标志物如IL-6、C反应蛋白、血清铁蛋白、凝血指数、D二聚体水平明显高于非糖尿病患者(P<0.01),提示糖尿病患者更容易受到炎症风暴的影响;糖尿病组淋巴细胞绝对计数、红细胞绝对计数、血红蛋白水平明显低于非糖尿病组;中性粒细胞绝对计数、和C反应蛋白的水平、ESR都明显高于糖尿病(见表2)。糖尿病患者的总蛋白、白蛋白、前白蛋白和血红蛋白水平明显低于非糖尿病患者,这意味着糖尿病患者更容易营养不良。赵勇等[21]研究也表明糖尿病组患者D-二聚体显著升高,淋巴细胞绝对值、血尿素、血肌酐均显著降低(P<0.05)。

表2 武汉协和医院住院的糖尿病与非糖尿病COVID-19患者实验室参数的比较
3.3 影像学检查
从影像学上看,赵勇等[21]学者认为67例新冠肺炎患者,胸部CT可见病灶者为65例,占97.0%,其中糖尿病组占100.0%,非糖尿病组占96.4%。双肺均见病灶者占80.6%,当中糖尿病组占81.8%。同非糖尿病组患者相比,糖尿病组患者的CT成像呈多样性及多灶性的特点(见图1)。Guo W等[3]研究表明糖尿病患者和非糖尿病患者的代表性胸部CT图像,糖尿病较非糖尿病患者表现出更严重的病理变化。此外糖尿病组的CT成像评分高于非糖尿病组,这表明糖尿病患者的肺炎症状较非糖尿病患者更为严重。
4 总结与展望
糖尿病是免疫缺陷性疾病,是病毒感染的高危人群之一。当合并新冠肺炎后机体免疫系统损伤、患者的焦虑情绪以及细胞因子风暴造成的炎症反应会导致血糖的升高,从而进一步加重患者病情,影响患者疾病的进程和预后。综上所述,新冠肺炎伴有糖尿病患者的临床症状、CT成像和疾病进展整体看来较普通感染者较重,死亡率较高。因此,展开就影响新冠肺炎伴有糖尿病患者病情进展的危险因素的研究及探讨可对新冠肺炎伴有糖尿病患者的临床治疗、用药及护理方面提供参考及理论依据。当然,对于影响新冠肺炎伴有糖尿病患者的病情进展是否还存在其他危险因素还需要专家及学者进一步探讨。
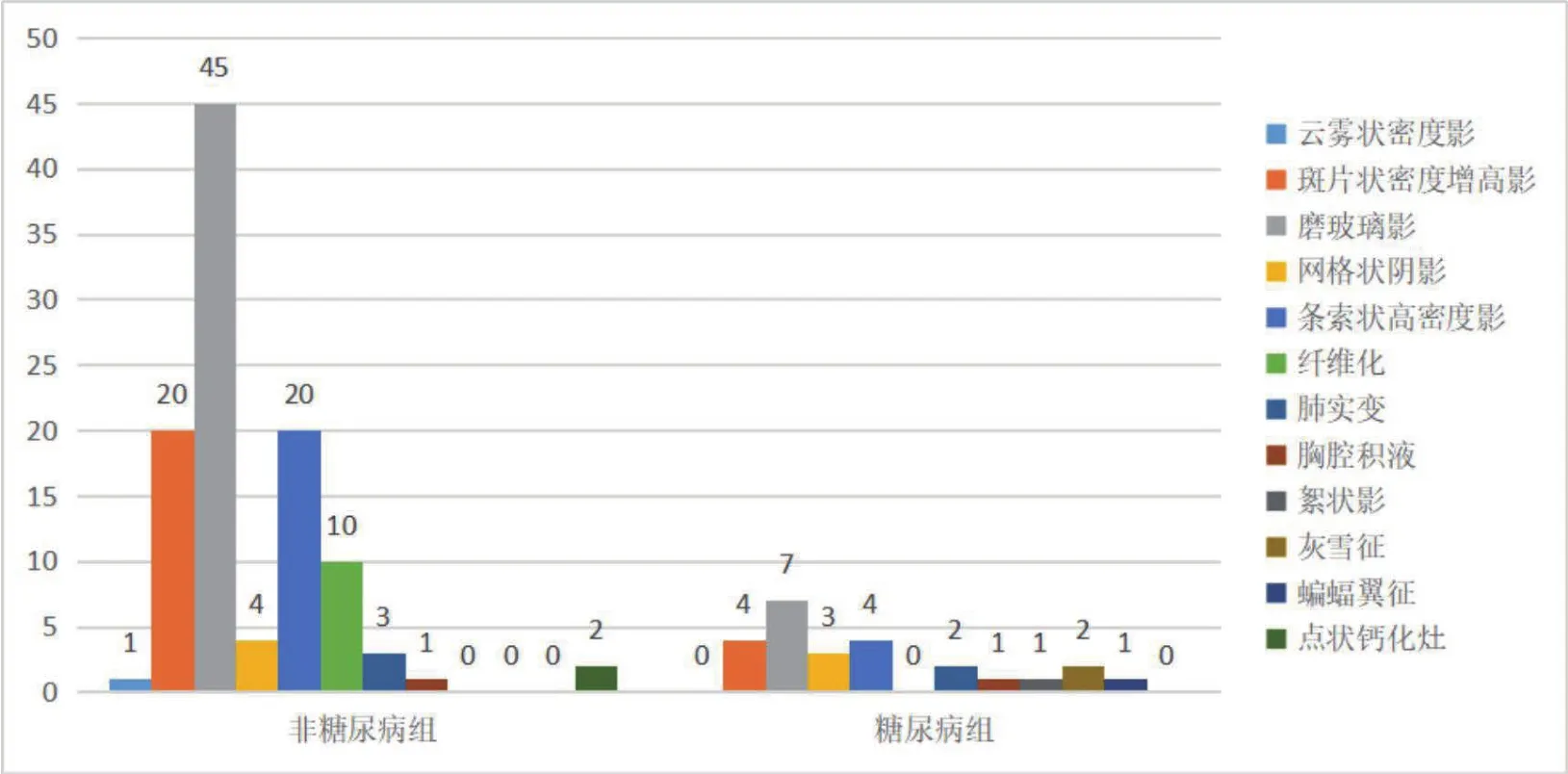
图1 67 例新冠肺炎患者糖尿病组与非糖尿病组患者CT病灶特点比较图

