肝硬化患者血清脂联素、脂多糖、基质金属蛋白酶-2水平及其诊断价值
(沧州市中心医院 消化内二科,河北 沧州 061000)
肝硬化是由一种或多种病因长期反复作用导致的肝病终末期[1]。其主要临床表现为腹胀、消瘦、下肢水肿、贫血等,随着病情进展,可出现腹水、肝性脑病、消化道出血等严重并发症导致多脏器功能衰竭,甚至死亡[2-3]。我国肝硬化发病原因主要是病毒性肝炎,其中以乙型肝炎和丙型肝炎最为常见。我国每年肝硬化发病率约1.7‰,大多为20~50岁男性,50~60岁男性患者的病死率约1.12‰。全球每年因肝硬化死亡的人数高达120万,严重危害患者的生命健康[4]。因此,肝硬化患者进行早期诊断及治疗对延缓患者病情发展、提高患者生活质量具有重要意义。脂联素(Adiponectin,APN)是由脂肪细胞分泌的细胞因子,具有调节糖脂代谢、增加胰岛素敏感性、抗炎、抗氧化等作用[5]。脂多糖(Lipopolysaccharides,LPS)是革兰阴性菌胞壁内毒素的主要成分,可促进肝纤维化的发生并导致肝损伤[6]。基质金属蛋白酶-2(matrix metalloproteinase-2,MMP-2)是降解胶原类的特异性蛋白因子,可对肝纤维化程度造成直接影响,是参与降解细胞外基质成分的重要因子[7]。然而,APN、LPS及MMP-2 能否用于诊断肝硬化的研究较少见。本研究旨在探讨肝硬化患者血清APN、LPS及MMP-2水平及三者联合检测对肝硬化的诊断价值。
1 资料与方法
1.1 一般资料
选取2017年6月—2019年6月沧州市中心医院消化内科诊断为肝硬化的患者90例作为观察组。其中,男性53例,女性37例;平均年龄(51.79±6.46)岁;乙型肝炎肝硬化39例,丙型肝炎肝硬化20例,酒精性肝硬化15例,胆源性肝硬化12例,其他肝硬化4例;Child-Pugh分级分为A级31例,B级32例,C级27例。患者均符合肝硬化诊断标准[8]。排除标准:①严重凝血功能障碍者;②恶性肿瘤者。选取同期本院健康体检者30例作为对照组。其中,男性20例,女性10例;平均年龄(52.42±7.65)岁。两组年龄及性别比较,差异无统计学意义(P>0.05),具有可比性。本研究通过医院伦理委员会批准,研究对象或家属均签署知情同意书。
1.2 方法
清晨抽取研究对象空腹静脉血5 ml,3 500 r/min离心10 min,取上清液于-70℃保存待测。经DL-ET 32 微生物动态检测系统采用定量动态浊度法检测血清LPS水平。测定时,解冻样品30 min,置于75℃水浴10 min,预热内毒素定量测定仪,于样品中加入鲎试剂后进行测定。采用酶联免疫吸附法检测血清APN和MMP-2水平。试剂盒购于美国R&D公司,测定时,在室温中解冻样品20 min,ELISA试剂盒在室温中放置30 min。严格按照试剂盒说明书进行操作。
1.3 统计学方法
数据分析采用SPSS 22.0 统计软件。计量资料以均数±标准差 (±s)表示,比较用t检验或方差分析,进一步两两比较用SNK-q法,绘制ROC曲线,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者血清APN、LPS及MMP-2比较
两组患者血清APN、LPS及MMP-2比较,经t检验,差异有统计学意义(P<0.05),观察组较对照组高。见表1。
表1 两组血清APN、LPS及MMP-2比较 (±s)
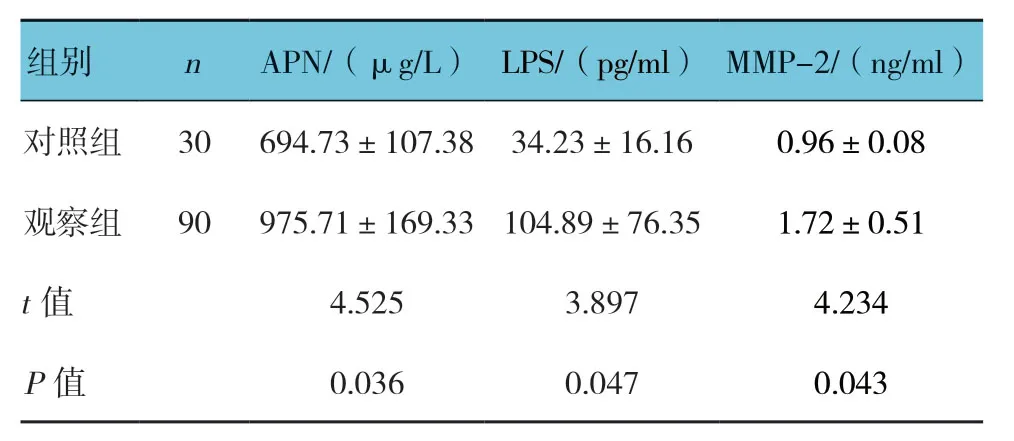
表1 两组血清APN、LPS及MMP-2比较 (±s)
组别 n APN/(μg/L)LPS/(pg/ml)MMP-2/(ng/ml)对照组 30 694.73±107.38 34.23±16.16 0.96±0.08观察组 90 975.71±169.33104.89±76.35 1.72±0.51 t值 4.525 3.897 4.234 P值 0.036 0.047 0.043
2.2 不同Child-Pugh分级患者血清APN、LPS及MMP-2水平比较
不同Child-Pugh分级患者血清APN 水平比较,差异无统计学意义(P>0.05)。不同Child-Pugh分级患者血清LPS、MMP-2水平比较,差异有统计学意义(P<0.05),B、C级较A级高,C级较B级高。见表2。
2.3 血清APN、LPS及MMP-2 对肝硬化的诊断价值
绘制血清APN、LPS、MMP-2 单独或三者联合诊断肝硬化的ROC曲线,结果显示:血清APN 诊断肝硬化的最佳截断值为0.228时,敏感性和特异性分别为75.0%(95%CI:0.687,0.816)和47.8%(95%CI:0.416,0.533);血清LPS诊断肝硬化的最佳截断值为0.249时,敏感性和特异性分别为79.2%(95%CI:0.728,0.875)和45.7%(95%CI:0.409,0.517);血清MMP-2 诊断肝硬化的最佳截断值为0.363时,敏感性和特异性分别为66.7%(95%CI:0.594,0.734)和69.6%(95%CI:0.651,0.750);3项指标联合诊断肝硬化的最佳截断值为0.645时,敏感性和特异性分别为66.7%(95%CI:0.603,0.742)和97.8%(95%CI:0.951,0.985)。见表3和图1。
表2 不同Child-Pugh分级患者血清APN、LPS及MMP-2水平比较 (±s)

表2 不同Child-Pugh分级患者血清APN、LPS及MMP-2水平比较 (±s)
注:①与A级比较,P<0.05;②与B级比较,P<0.05。
Child-Pugh分级 n APN/(μg/L)LPS/(pg/ml)MMP-2/(ng/ml)A级 31 913.97±143.21 87.89±57.32 1.49±0.61 B级 32 942.20±153.59 105.89±62.15① 1.75±0.10①C级 27 895.18±150.32 119.89±75.22①② 1.91±0.13①②F值 0.530 4.253 3.369 P值 0.578 0.042 0.035
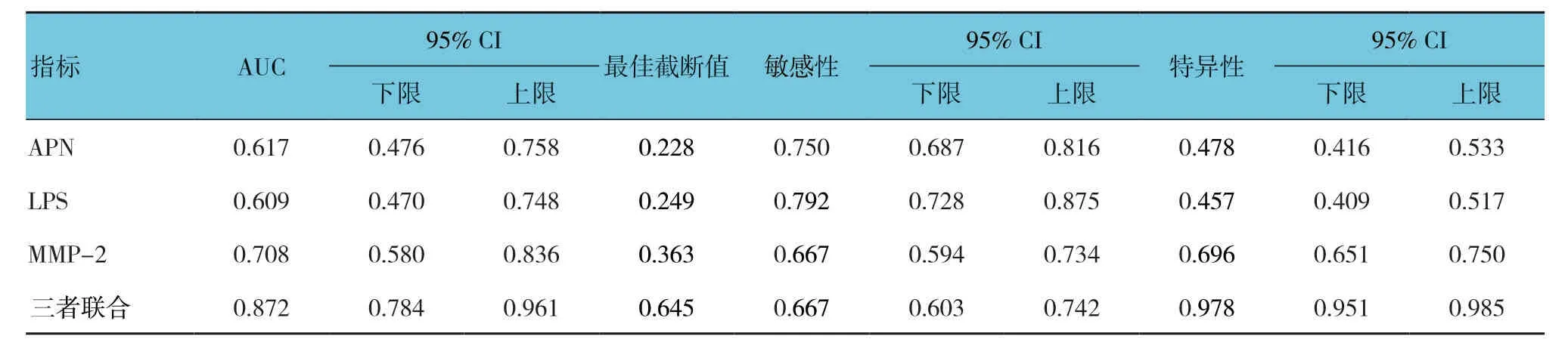
表3 血清APN、LPS及MMP-2 诊断肝硬化的ROC曲线参数
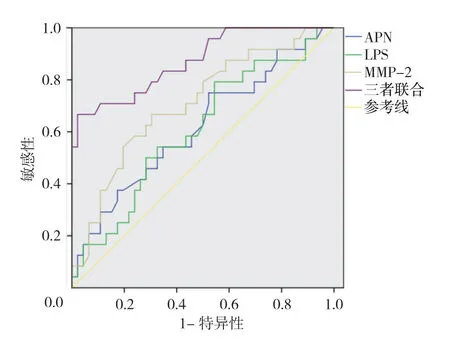
图1 血清APN、LPS及MMP-2 单独或联合诊断肝硬化的ROC曲线
3 讨论
肝硬化是各种肝病的终末期临床表现,大多由慢性肝炎引起[9]。由于感染、消化道出血、肝功能异常等原因,疾病反复发作,病情逐渐恶化或加重,从而出现肝衰竭、门静脉高压等严重并发症,可进展为原发性肝癌,对患者生命造成威胁[10-13]。因此,积极寻找准确有效的临床标志物,早期对肝硬化进行诊断、治疗及评估预后具有重要的意义。
APN是由成熟脂肪细胞分泌的一种特有的细胞因子,可改善胰岛素抵抗,并发挥抗炎、抗动脉粥样硬化等作用,在调节糖脂代谢中扮演关键角色[14-16]。本研究中,肝硬化患者血清APN 水平高于健康人群,但未随着Child-Pugh分级加重而升高。其原因可能为肝硬化患者肝脏对APN的代谢清除减少,且受损肝细胞APN 基因及蛋白表达升高,从而升高血清APN水平[17]。因此,血清APN表达升高与肝硬化的发生密切关系。此外,由革兰阴性菌产生的LPS是具有生物活性的热稳定物质[18]。健康人群血清中的LPS 主要来自于肠道,经肝脏代谢,而肝硬化患者的肠道菌群紊乱,肠道细菌过度生长,可导致肠道陷入淤血状态,从而造成LPS 增加[19]。肠道菌群的改变及其产生的LPS 在肝硬化的发生、发展中具有重要作用。同时,MMP-2是MMPs 酶系家族中参与降解细胞外基质成分的重要成员,活化后能降解变性胶原和纤维连接蛋白,而肝硬化是细胞外基质成分过多而肝纤维化持续增生引起的。因此,血清MMP-2水平随着患者病情严重程度的增加而升高[20-21]。本研究结果显示,肝硬化患者血清LPS、MMP-2水平明显增高,且随Child-Pugh分级加重而升高。结果表明,血清LPS、MMP-2水平与肝细胞损害程度关系密切,可作为肝硬化患者病情严重程度的诊断指标。临床上应尽早对肝硬化患者进行诊断治疗,防止病情进一步加重,有效控制并发症的发生。
ROC曲线结果显示,血清APN、LPS、MMP-2诊断肝硬化的AUC分别为0.617、0.609和0.708,三者联合诊断肝硬化的AUC为0.872。结果表明,血清APN、LPS及MMP-2 对肝硬化诊断、治疗及预后有一定价值,三者联合诊断较单一指标检测效果更好,具有更高的临床价值。
综上所述,肝硬化患者血清APN、LPS及MMP-2水平显著升高,且APN、LPS及MMP-2 对肝硬化诊断、治疗和预后有一定价值,三者联合诊断肝硬化具有更高的临床价值。

