宫颈癌组织中Hippo-Yes相关蛋白1的表达及临床意义
王文慧,邵志叶,陈豪
(1.杭州市妇产科医院 病理科,浙江 杭州 310000;2.慈溪市妇幼保健院病理科,浙江 慈溪 315300)
人乳头瘤病毒感染为宫颈癌发病的根本原因,而宫颈癌发病是一个复杂的过程,其发病机制尚不十分清楚。随着研究的不断深入,人们逐渐认识到宫颈癌的发病是一个多因素、多步骤共同导致的过程,从正常宫颈发展到宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN),再发展为宫颈癌。在这个过程中,原癌基因激活和抑癌基因突变或缺失发挥重要作用。关于原癌基因和抑癌基因变化的研究是宫颈癌发病机制研究的热点。Hippo信号通路为恶性肿瘤的抑制通路,在恶性肿瘤发病中发挥重要作用[1],Hippo-Yes相关蛋白1(Hippo-Yes-associated protein1,YAP1)位于该通路下游,为Hippo 通路转录共激活因子[2],参与生长、发育及DNA 修复等过程,在结直肠癌、卵巢癌等多种恶性肿瘤中表达升高,发挥抑癌基因的角色[3]。本文对宫颈癌组织中YAP1表达进行研究,探讨其临床意义。
1 资料与方法
1.1 一般资料
选取2013年1月—2019年6月杭州市妇产科医院和慈溪市妇幼保健院收治的100例宫颈癌患者的宫颈癌组织作为宫颈癌组,100例宫颈CIN 患者的宫颈组织作为CIN组,100例子宫肌瘤患者的正常宫颈组织作为正常组。宫颈癌组年龄(48.75±6.16)岁;临床分期:I期58例,Ⅱ期42例;鳞癌69例、腺癌31例;低分化19例,中分化42例,高分化39例;宫旁浸润深度:≤1/3 者31例,>1/3 者69例;神经脉管浸润67例;宫旁浸润65例;淋巴结转移53例。CIN组年龄(47.59±6.54)岁,正常组年龄(47.82±6.73)岁。纳入标准:①正常组选自子宫肌瘤行全子宫切除术患者,病理证实宫颈组织正常;②CIN组选自宫颈锥切患者,病理证实为宫颈CIN;③宫颈癌组为行广泛性子宫切除术+盆腔淋巴结切除术患者,病理证实为宫颈癌;④3组均临床资料完整、依从性好、接受正规治疗和随访,以及足够样本量进行免疫组织化学染色。排除标准:①其他恶性肿瘤;②随访过程中失访;③宫颈癌复发;④既往接受放化疗等其他治疗。本研究通过医院伦理委员会批准,患者及其家属知情同意。3组年龄比较,差异无统计学意义(P>0.05)。
1.2 方法
1.2.1 主要试剂及仪器鼠抗人YAP1 单克隆抗体购自美国Epitomics公司,二抗购自上海罗氏有限公司,DAB显色剂购自上海罗氏有限公司。
1.2.2 免疫组织化学染色将3组宫颈组织石蜡切片经烤箱烘烤1 h,二甲苯脱蜡,梯度酒精脱水,柠檬酸缓冲液高温修复抗原,过氧化氢孵育10 min,加入一抗。兔抗人YAP1 单克隆抗体(1∶400)过夜孵育,加入二抗(1∶2 000)孵育1 h,DAB显色,HE染色1 min,盐酸乙醇分化30 s,氨水返蓝1 min,常规脱水、透明、封固。阴性对照以PBS代替一抗。结果判断:YAP1阳性产物主要位于细胞浆和细胞核。①染色程度:无染色计0分;淡黄色计1分;棕黄色计2分;棕褐色计3分。②阳性细胞率:≤5%计0分;>5%~25%计1分;>25%~50%计2分;>50%~75%计3分;>75%计6分。染色程度和阳性细胞染色率相乘得到总分:总分0~2分为阴性;总分≥3分为阳性[4]。
1.3 随访
定期进行门诊或电话随访了解患者预后,随访开始时间为宫颈癌手术日期,随访截止时间为2019年12月31 日或死亡时间。无病生存期(disease-free survival,DFS)为手术日期至出现远处转移、复发、死亡或随访截止时间;总生存期(total survival,OS)为手术日期至死亡或随访截止时间。
1.4 统计学方法
数据分析采用SPSS 20.0 统计软件。计数资料以率(%)表示,比较用χ2检验;Kaplan-Meie 法绘制生存曲线,比较用Log-rank χ2检验;预后影响因素用多因素Cox 比例风险模型,P<0.05为差异有统计学意义。
2 结果
2.1 各组宫颈组织中YAP1蛋白阳性表达率比较
正常组、CIN组、宫颈癌组宫颈组织中YAP1蛋白阳性表达率分别为13%、42%和78%,经χ2检验,差异有统计学意义(χ2=85.930,P=0.000),CIN组、宫颈癌组高于正常组(P<0.05),且宫颈癌组高于CIN组(P<0.05)。见图1。
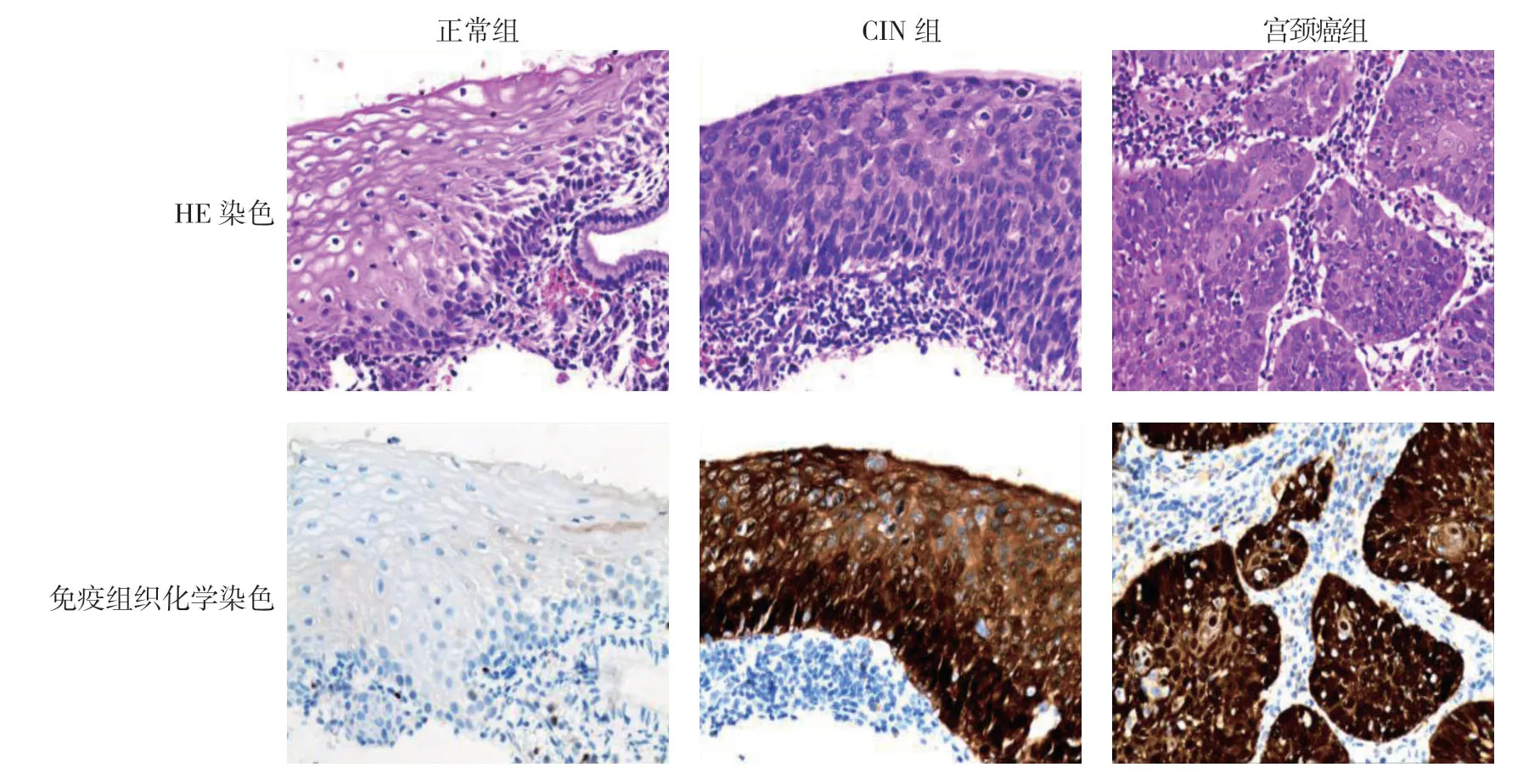
图1 各组宫颈组织染色 (×400)
2.2 不同因素的宫颈癌组织中YAP1蛋白阳性表达率比较
不同临床分期和有无淋巴结转移患者宫颈癌组织中YAP1蛋白阳性表达率比较,经χ2检验,差异有统计学意义(P<0.05),临床分期Ⅱ期宫颈癌组织中YAP1蛋白阳性表达率高于I期;有淋巴结转移宫颈癌组织中YAP1蛋白阳性表达率高于无淋巴结转移。而不同年龄、组织学类型、组织学分级、宫颈浸润深度、神经脉管是否浸润及宫旁是否浸润的宫颈癌组织中YAP1蛋白阳性表达率比较,差异无统计学意义(P>0.05)。见表1。
2.3 宫颈癌YAP1阳性表达组和阴性表达组生存时间比较
100例宫颈癌患者DFS中位数为61.15个月(95% CI:58.76,63.32)。其中,宫颈癌YAP1阳性表达组78例,DFS中位数为54.27个月(95% CI:52.16,67.36),5年DFS率为3.85%(3/78);YAP1 阴性表达组22例,DFS中位数为87.76个月(95% CI:85.54,90.73),5年DFS率为0.00%(0/22)。两组DFS比较,经Log-rank χ2检验,差异有统计学意义(χ2=5.241,P=0.023),YAP1阳性表达组低于YAP1阴性表达组。见图2。
100例宫颈癌患者OS中位数为63.57个月(95% CI:61.25,65.02)。其中,宫颈癌YAP1阳性表达组OS中位数为61.27个月(95% CI:58.76,53.64);YAP1 阴性表达组OS中位数为93.61个月(95% CI:90.25,96.02)。两组OS比较,经Log-rank χ2检验,差异有统计学意义(χ2=6.201,P=0.014),YAP1阳性表达组低于YAP1 阴性表达组。见图3。
2.4 YAP1 对宫颈癌预后的影响
以OS为因变量(赋值为总生存期实际值),以YAP1(阳性=1,阴性=0)、肿瘤大小(赋值为实测值)、临床分期(I期=0,Ⅱ期=1)、淋巴结转移(无=0,有=1)为自变量,进行逐步多因素Cox 比例风险分析,引入水准为0.05,剔除水准为0.10。Cox 比例风险模型分析结果显示,YAP1表达、临床分期及淋巴结转移为宫颈癌OS的独立影响因素(P<0.05)。见表2。
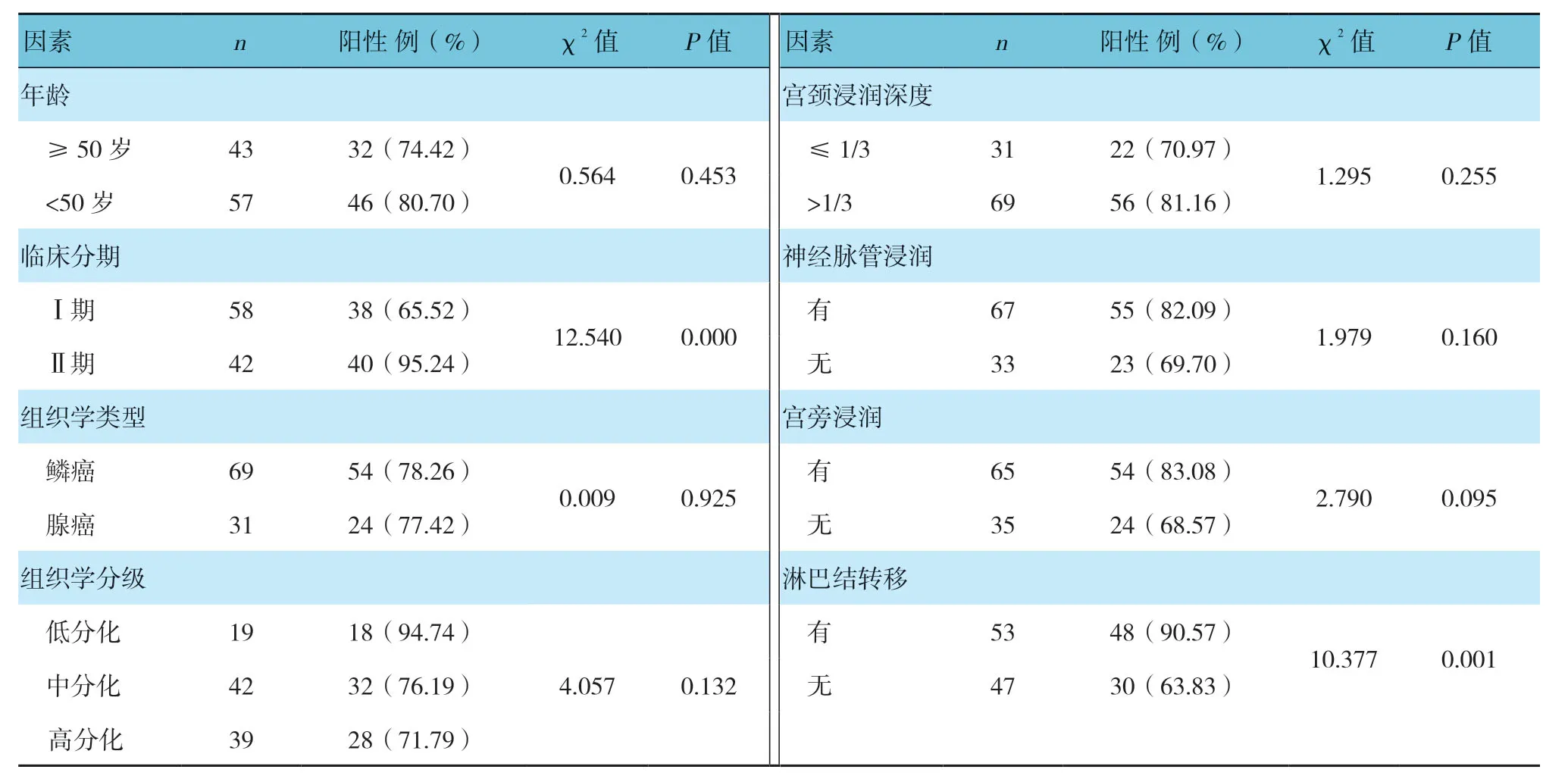
表1 不同因素的宫颈癌组织中YAP1蛋白阳性表达率比较 (n=100)

图2 YAP1不同表达宫颈癌患者的DFS
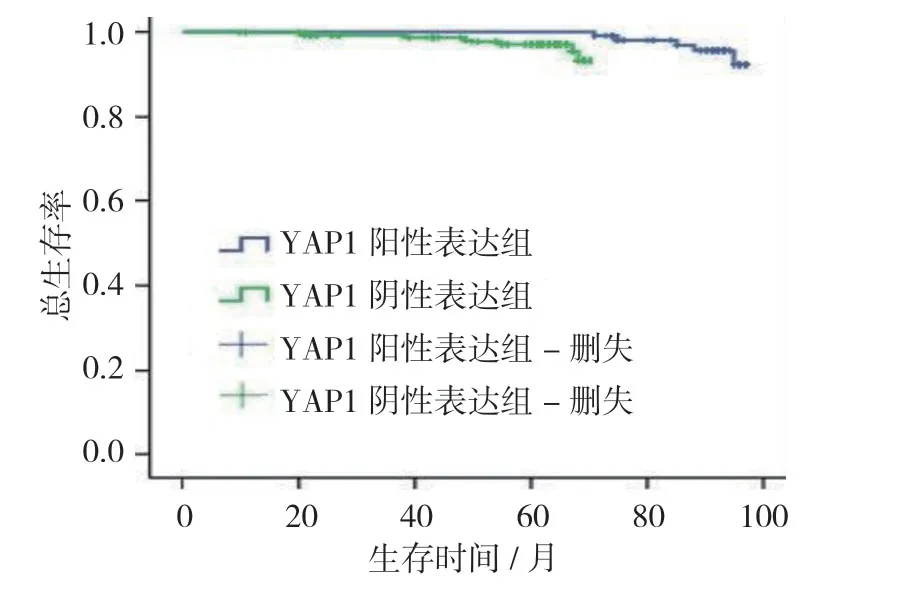
图3 YAP1不同表达宫颈癌患者的OS
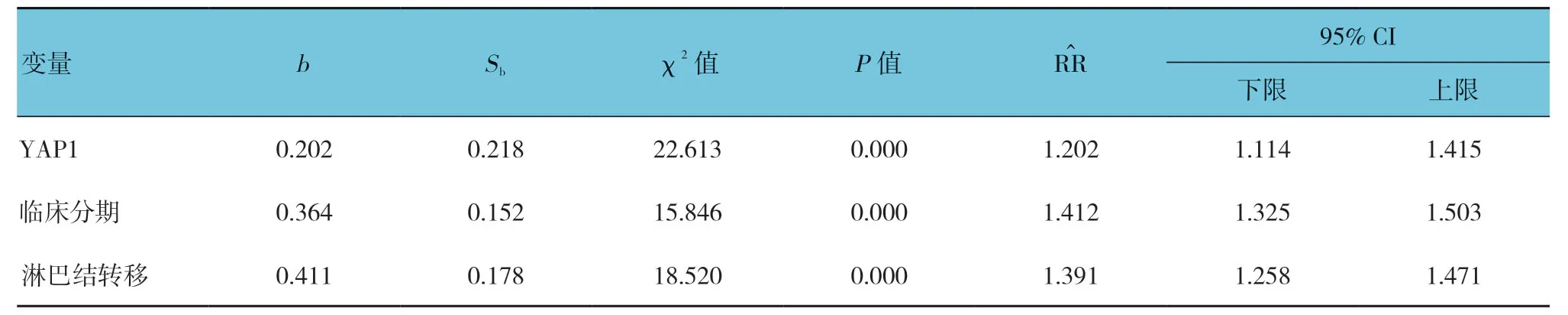
表2 宫颈癌总生存期影响因素的Cox比例风险分析参数
3 讨论
Hippo信号通路参与多种疾病的发生、发展过程,与恶性肿瘤的发病关系密切,尤其与其抑癌基因失活关系密切[5-6]。YAP1被证实为原癌基因,保护多个特异氨基酸结构域,通过这些氨基酸结构域与一些蛋白质发生作用,参与多种信号转导通路[7]。在Hippo 信号通路中,YAP1 发挥中心效应作用[8]。在生理条件下Hippo信号通路为一条激酶链,由多种抑癌因子共同构成,通过使YAP1 磷酸化,进而抑制YAP1 转录共激活活性,维持细胞增殖和凋亡的平衡[9-10]。当YAP1 过度表达或活性增加时,可激活下游靶基因表达,从而改变细胞增殖和凋亡的平衡[11-12]。在恶性肿瘤组织中,Hippo信号通路遭到破坏,导致YAP1 去磷酸化,活性增加,活化的YAP1 可诱导细胞增生相关的基因高度表达、抑制凋亡基因过度表达,从而打破细胞增殖和凋亡的平衡,促进细胞过度增殖[13],导致乳腺癌[14]、胰腺癌[15]等恶性肿瘤的发生、发展。故推测YAP1 在恶性肿瘤的发生、发展中发挥致癌基因角色[16-17]。
HE 等[18]发现,Hippo/YAP途径和HPV致瘤蛋白相互作用调节宫颈癌的进展。ZHANG 等[19]发现,miR-136/TFCP2/YAP 途径在宫颈癌中发挥致癌作用。惠慧等[20]发现,沉默YAP1 可影响宫颈癌细胞的增殖和侵袭。上述研究表明,YAP1 可通过多种途径参与宫颈癌的发生、发展过程,但上述研究主要对宫颈癌细胞进行研究。本文对宫颈癌组织中YAP1的表达及临床意义进行研究,发现宫颈癌组织中YAP1高表达率高于宫颈CIN组织,宫颈CIN组织中YAP1高表达率高于正常宫颈组织,宫颈癌组织中YAP1高表达与宫颈癌的临床分期和淋巴结转移关系密切。李灵芝等[21]对宫颈癌组织中YAP1表达进行研究发现,YAP1蛋白在宫颈癌前病变中呈高表达,在宫颈癌筛查中具有一定价值。本研究结果与该研究结果一致,表明YAP1 在宫颈癌癌前病变中已表达异常,检测YAP1表达在宫颈癌筛查和防治中具有一定价值。李娜等[4]研究发现,YAP 在宫颈癌组织中高表达,其高表达与宫颈癌淋巴结转移关系密切,与宫颈癌临床分期无关。而本研究结果显示,宫颈癌组织中YAP1与宫颈癌临床分期和淋巴结转移均有关。本研究与李娜等[4]研究结果不完全一致,分析可能与病例数少、病例来自不同医院等因素有关。结合上述基础研究结果得知,沉默YAP1 可影响宫颈癌细胞增殖和侵袭,分析YAP1在宫颈癌增殖和侵袭中发挥重要作用,YAP1高表达可促进宫颈癌增殖和侵袭。
本文对YAP1高表达与宫颈癌预后的关系进行研究,发现YAP1高表达组患者DFS和OS较短,YAP1表达为宫颈癌OS的独立影响因素。分析在宫颈癌组织中,Hippo信号通路受到破坏,导致YAP1 去磷酸化,YAP1 活性增加,活化的YAP1 可诱导宫颈癌细胞增殖,促进其侵袭能力,从而促进宫颈癌的发生、发展,宫颈癌临床分期较高,并出现淋巴结转移,导致宫颈癌严重程度增加,预后较差。
综上所述,宫颈癌组织中YAP1 呈高表达,YAP1表达水平一定程度上可反映宫颈癌的严重程度,在预测预后上也具有一定的辅助价值。

