静息态fMRI观察经颅电刺激对睡眠剥夺后青年志愿者后扣带回皮质连接紊乱的干预作用
张 宁,李继元,岳云龙*,邵永聪,金延方,刘洪亮
(1.首都医科大学附属北京世纪坛医院磁共振室,北京 100038;2.军事医学科学院基础医学研究所,北京 100010)
随着生活环境的变化,存在不同程度睡眠障碍者越来越多,睡眠问题已成为近年来的研究热点[1]。睡眠剥夺(sleep deprivation, SD)指24 h睡眠时间少于4 h,已有研究[2-3]表明SD可导致认知、情感等脑高级功能可逆性损害,其机制可能与脑内网络连接紊乱有关。默认网络(default mode network, DMN)为静息状态下特定的功能网络群,与静息状态下自发性思维、情感、记忆等功能密切相关,DMN各脑区的大小和作用并不一致,其中后扣带回皮质(posterior cingulate cortex, PCC)在认知功能中起着最关键的作用[4]。经颅电刺激(transcranial direct current stimulation, tDCS)为一种无创物理治疗/干预手段,当前在医学康复及心理学训练领域应用广泛[5]。本研究通过运用静息态功能MRI(resting state functional MRI, rs-fMRI)分析tDCS对SD后脑网络紊乱的干预作用。
1 资料与方法
1.1 研究对象 16名健康在校大学生,男7名,女9名,年龄18~23岁,平均(20.9±1.7)岁;既往身体健康,无遗传性或近亲无精神类疾病史,智力正常(瑞文智力测验示IQ≥110),睡眠习惯良好(匹兹堡睡眠质量指数<5分)。本研究获医院伦理委员会批准;受试者均自愿参加本研究并签署知情同意书。
1.2 研究设计 采用自身前后对照的配对试验设计,试验流程见图1。于专用室内进行SD试验,每次入组3名受试者,由主试人员全程陪伴,防止其入睡或进行其他可能影响试验结果的行为。
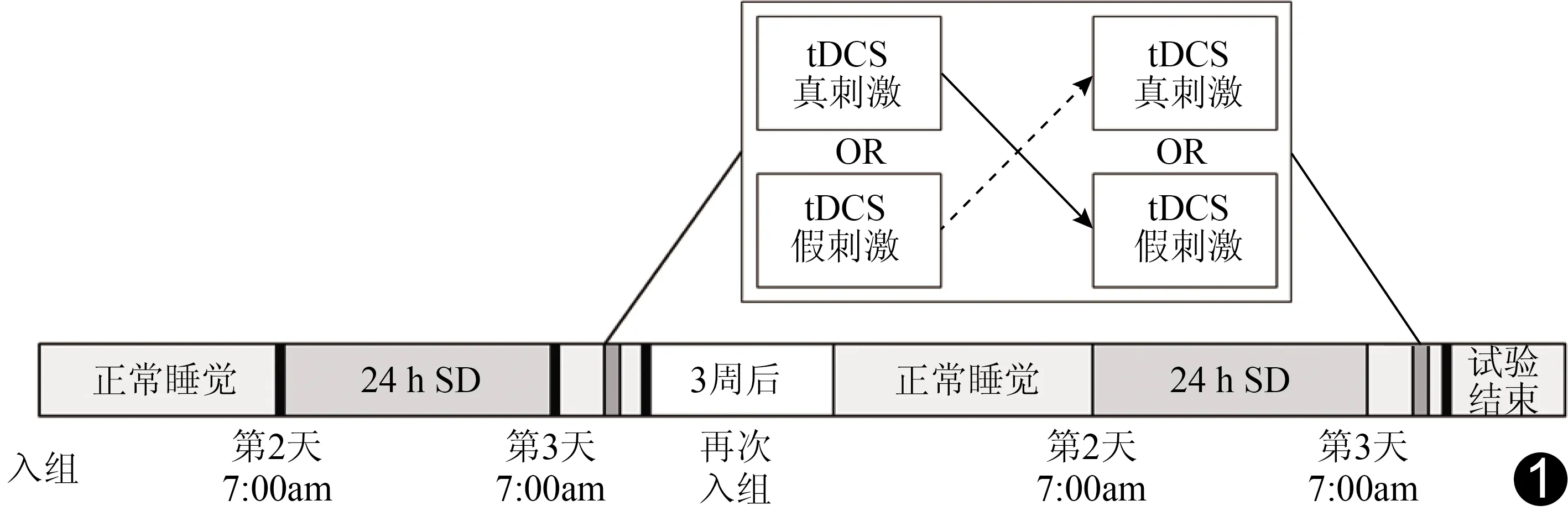
图1 试验流程图 (正常睡眠指连续睡眠时间达7 h;■表示给予电刺激;■表示相应时间节点进行认知评估并采集rs-fMRI)
1.3 仪器与方法
1.3.1 采集 rs-fMRI数据 采用GE 3.0T MR750 Discovery成像设备,8通道专用头线圈。嘱受试者仰卧,头部固定,闭目,不主动思考。扫描序列及参数:T1结构像,采用自旋回波(spin echo, SE)三维成像序列,TR 2 000 ms,TE 9 ms,层厚及层间距均 1 mm,矩阵320×320;rs-fMRI,采用平面回波成像序列,TR 2 000 ms,TE 30 ms,视野256×256,层厚5 mm,层间距1 mm,采集矩阵64×64,每个时间节点采集45层图像,210个时间节点,共计9 450层图像。使扫描定位线平行于前-后联合间线,扫描范围自头顶至枕骨大孔区。扫描过程中同步记录受试者心率和呼吸频率。
1.3.2 tDCS 使用DC-STIMULATOR治疗仪(Neuropathy Conn公司),将其阳极电极片置于右侧额部,阴极电极片置于左侧乳突部,治疗电流为1 mA[6]。真tDCS指电流持续时间为20 min,假tDCS指电流作用时间为20 s,干预试验持续时间均为20 min。
1.4 fMRI数据预处理及功能链接分析 对原始数据采用Matlab 2010b及SPM 12(www.fil.ion.ucl.ac.uk/spm/software/spm12)软件进行处理。rs-fMRI数据主要预处理步骤包括删除每名受试者前10帧图像,进行时间校正、头动校正及功能像与结构像之间的配准/标准化,如头动校正后在x、y、z轴方向上平移超过1.5 mm或旋转超过1°则剔除该受试者。
采用REST(http://www.restfmri.sourceforge.net)软件自动化解剖标记模板定位ROI[7],选取双侧PCC为种子点,获得种子点区域和全脑各体素间时间序列的Pearson相关系数模式图。以6 mm半高宽对所得数据进行平滑处理,得到种子点与全脑各体素间的功能连接模式图。分析过程中采用呼吸、心率为协变量,以减弱心跳及呼吸等因素对结果的影响。
1.5 认知功能评价 对所有受试者均于正常睡眠清醒休息状态(rest wakefulness, RW)、24 h SD后及真tDCS/假tDCS后进行蒙特利尔认知评估(Montreal cognitive assessment, MoCA)(北京版)。MoCA主要包括视空间与执行功能、命名、记忆-延时记忆、注意、语言、抽象及定向等测试内容,共计30分,总评分<26分表示认知功能存在损害。
1.6 统计学分析 利用全脑体素水平单样本t检验得到RW状态下双侧PCC种子点与全脑功能连接模式图(P<0.001,FDR 校正,体素大小>20)。采用配对t检验分别比较SD前后、真假tDCS之间认知变化情况(以双侧P<0.05为差异有统计学意义)及双侧PCC种子点与全脑功能连接的模式差异(P<0.001,FDR校正,体素大小>20) 。
2 结果
2.1 认知功能变化 24 h SD后受试者平均MoCA分值(24.75±2.41)较RW(29.44±0.73)显著降低(t=8.047,P<0.001)。真tDCS后平均MoCA分值(27.06±1.53)高于假tDCS后(25.13±1.86,t=-3.081,P=0.008)和SD后(24.75±2.41,t=3.306,P=0.005),而假tDCS后与SD后差异无统计学意义(t=0.808,P=0.432)。
2.2 SD前后双侧PCC种子点与全脑功能连接情况 SD后双侧PCC与双侧丘脑功能连接较RW上升,而与右侧楔前叶功能连接下降。见表1、图2。

表1 SD前后双侧PCC种子点与全脑功能连接差异
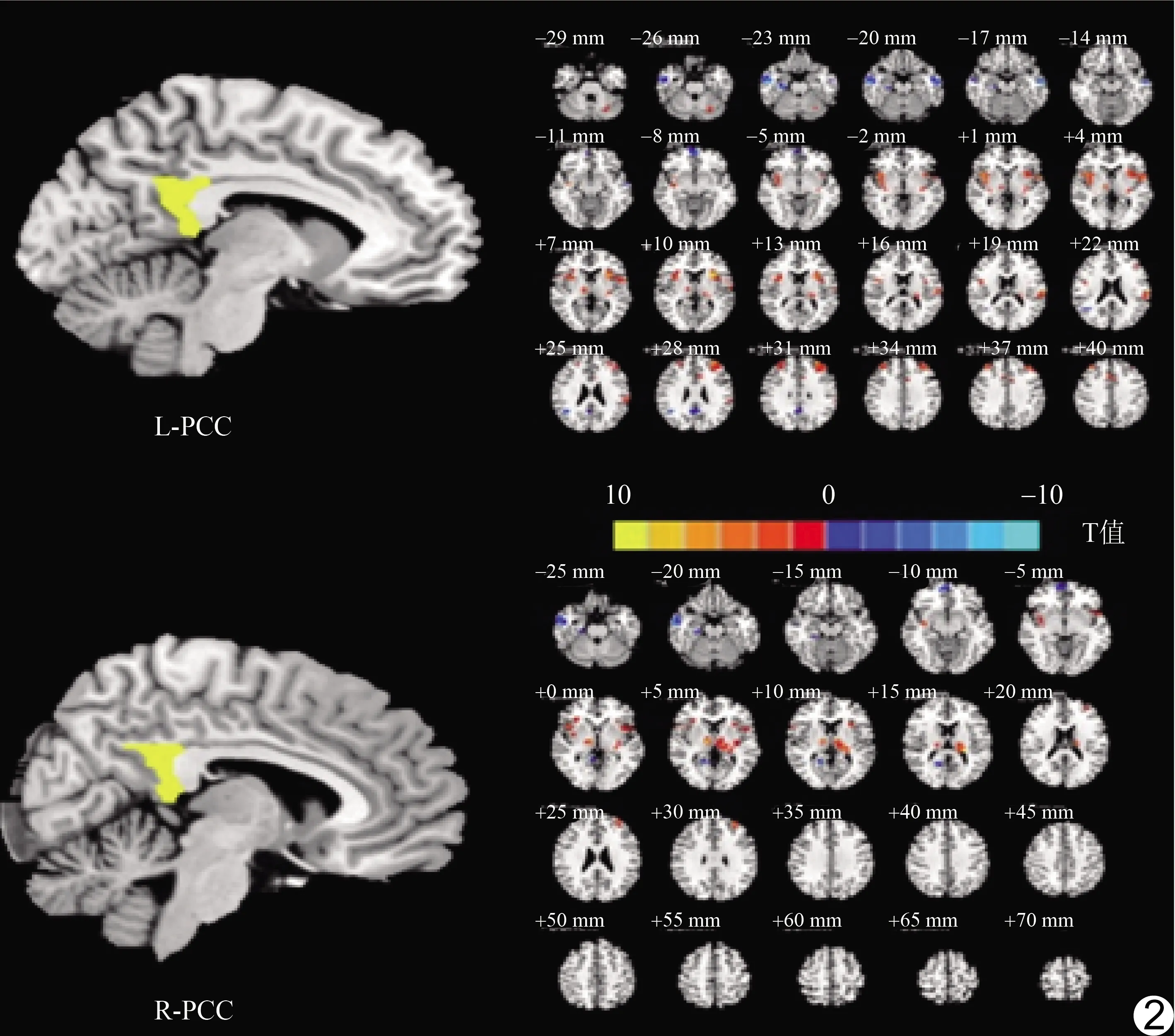
图2 SD前后双侧PCC与全脑功能连接模式差异图 (暖色调表示正功能连接,冷色调表示负功能连接;L:左侧;R:右侧)
2.3 真、假tDCS后功能连接变化 真tDCS后双侧PCC与双侧丘脑之间功能连接较假tDCS后下降,而左侧PCC与右侧楔前叶间功能连接上升,见表2、图3。
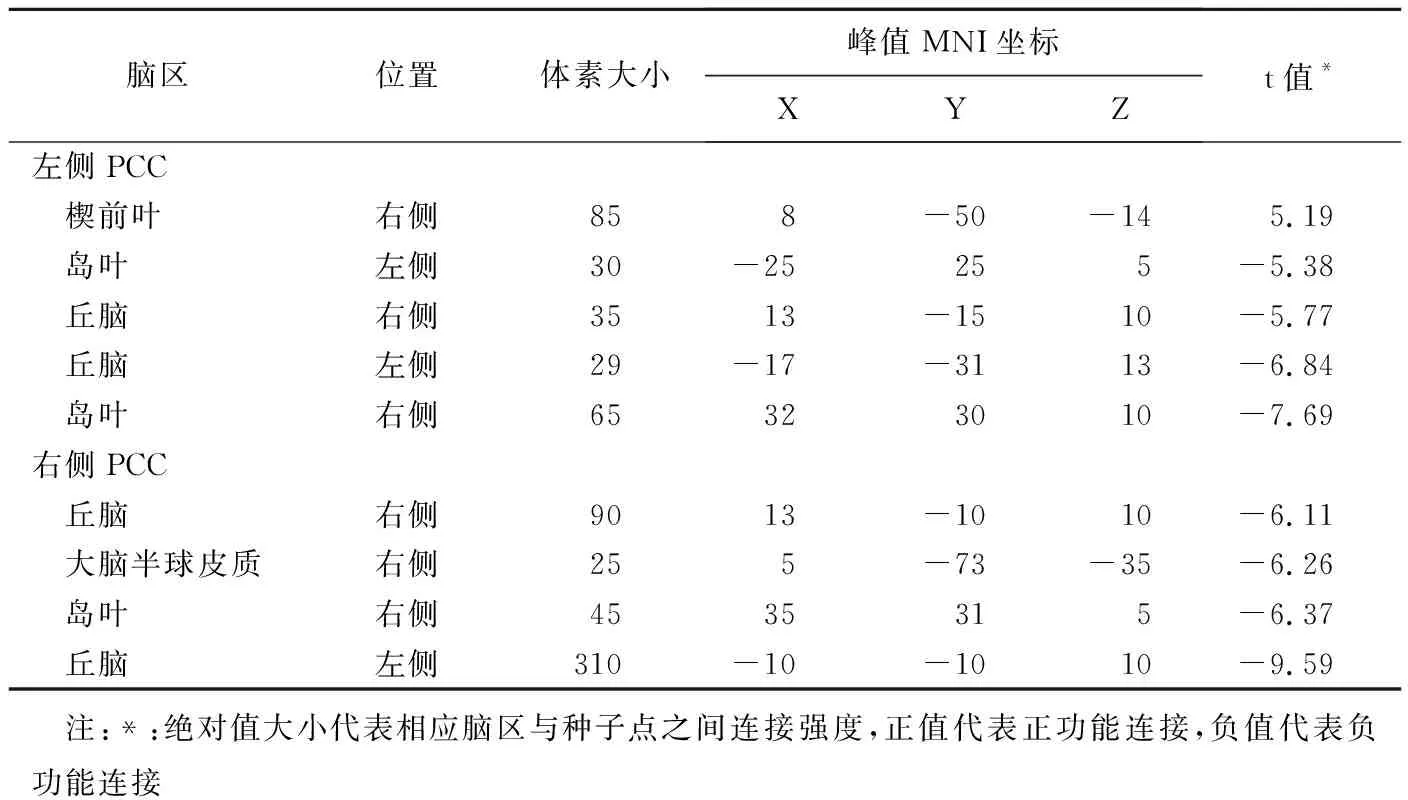
表2 真/假tDCS后双侧PCC种子点与全脑功能连接的差异
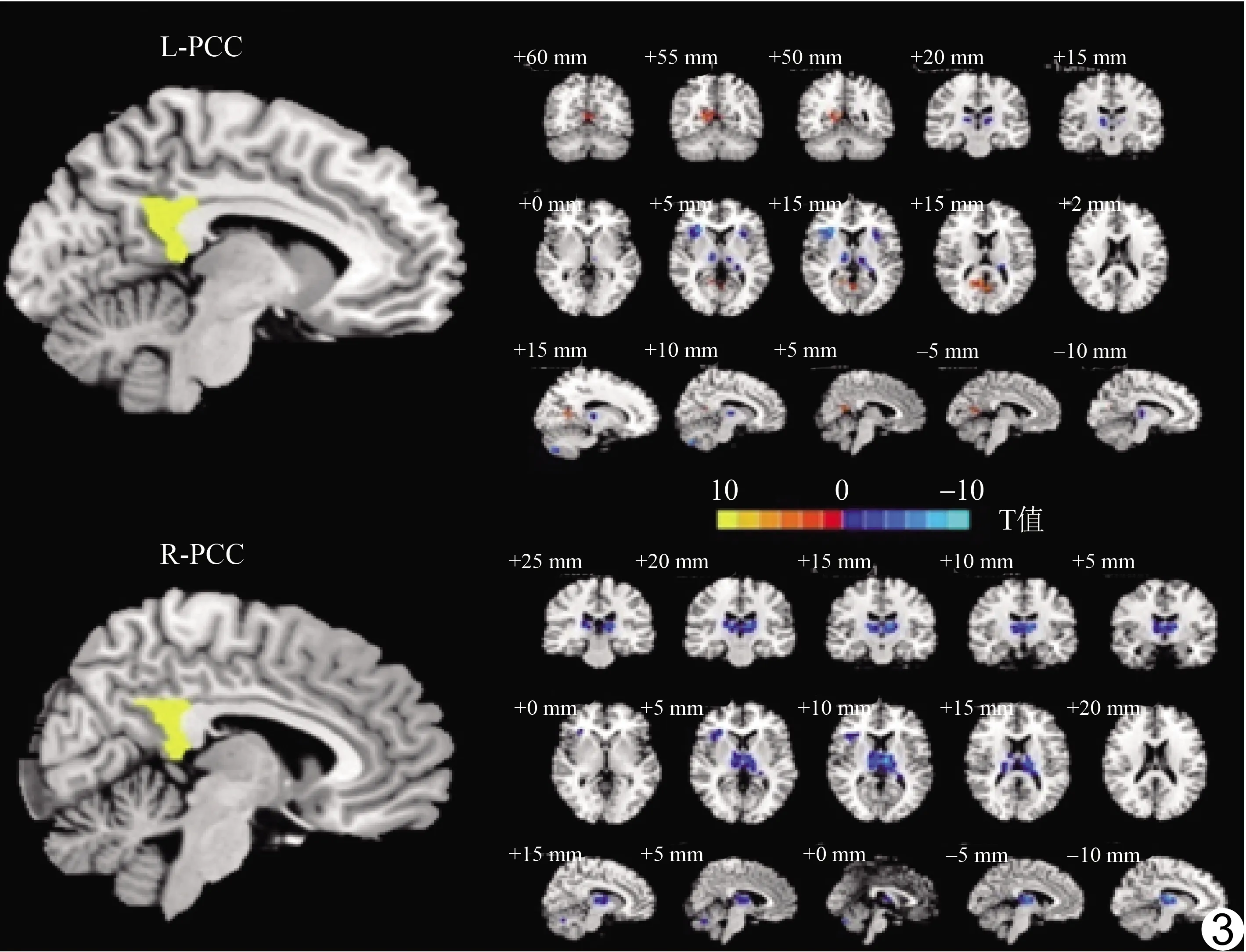
图3 真/假tDCS后双侧PCC与全脑功能连接模式差异图 (暖色调表示正功能连接,冷色调表示负功能连接;L:左侧;R:右侧)
3 讨论
睡眠为机体维持正常生命活动所必需的生理过程,昼夜节律的调节作用对睡眠状态、质量均具有显著影响,凌晨2—6点为机体的生理性低谷期[8]。为避开昼夜节律调整对试验结果的影响,本研究将MRI采集时间设定为早晨7点,同时检测受试者呼吸和心率并进行分析,以最大程度降低其影响。
DMN为维持机体静息状态下保持觉醒、执行部分高级功能的重要网络,主要包括内侧前额叶皮质、顶叶皮质及前、后扣带回皮质等,而PCC为DMN的重要节点,在觉醒调控与维持中发挥重要作用[9]。本研究发现24 h SD后MoCA平均得分为24.75±2.41,低于26分,表明SD导致受试者认知功能损害。rs-fMRI数据主要变化表现为与双侧丘脑间功能连接上升,而与楔前叶功能连接下降。ZHU等[10]认为丘脑是信息加工处理、中转等高级功能的中枢,其与不同脑功能区间的连接呈现动态变化;双侧PCC与丘脑功能连接增强反映机体在SD后需要更多的“信息流”,以维持机体的觉醒状态。另外,24 h SD后,双侧PCC与楔前叶功能连接下降。楔前叶位于顶上小叶,EIDELMAN-ROTHMAN等[11]认为楔前叶主要与学习、记忆等高级认知功能相关,本研究MoCA所得行为学结果与之相符。
施加tDCS干预后,双侧PCC与丘脑功能连接水平下降,但与楔前叶间功能连接增强;与此同时MoCA分值增高,提示tDCS可“改善”SD引起的功能紊乱,既往研究[12-13]认为上述现象可能与机体的代偿性调节机制有关。在SD后的静息状态,机体以维持自身觉醒状态为首要任务,高级认知功能则处于相对次要位置。楔前叶负责情景记忆、自我相关信息处理等高级认知功能的加工,故SD后出现代偿性功能连接下降[14]。施加tDCS可能减弱了上述代偿调节机制,从而干预或改善SD后所致脑网络紊乱而提高MoCA分值[15]。上述结果提示,tDCS可在一定程度上“对抗”SD,为未来治疗/干预睡眠障碍所致认知功能下降提供了新方法。
本研究存在不足:样本量小,年龄范围较局限,在一定程度上降低了结论的普适性;对rs-fMRI的监测缺乏客观依据,均有待进一步完善。
综上所述,24 h SD可引起PCC网络连接紊乱;tDCS对SD所致PCC功能连接紊乱具有一定干预作用。

