经皮穿刺抽取大鼠脑脊液方法的改良*
李家卉,张 敏,付子豪,李勇枝,王佳平,高 峰,董 玲△
(1. 中国人民解放军空军军医大学航空航天医学系, 陕西 西安 710032; 2. 中国航天员科研训练中心, 北京 100094)
脑脊液(cerebrospinal fluid,CSF)是一种循环于脑室、蛛网膜下腔和脊髓中央管内并包绕大脑和脊髓的复杂液体,其成分主要来源于脉络丛和脑间质液。因此,脑脊液经常被用作药效学和预后生物标志物的来源,以反映大脑内发生的生化变化[1]。在实验研究中,大鼠脑脊液采样点通常选择侧脑室、小脑延髓池(cisterna magna,CM)、蛛网膜下腔以及腰大池。但侧脑室取样需打开颅骨,且借助脑定位仪进行精密定位[2, 3]。并且蛛网膜下腔脑脊液收集量少,腰大池操作繁琐、耗时、损伤大,且穿刺成功率低于小脑延髓池穿刺法,故实验中仍常用小脑延髓池穿刺法[4, 5]。经小脑延髓池穿刺采集大鼠脑脊液通常有以下几种方法:(1)经皮穿刺取样法[6];(2)直视下经硬脊膜采样法[7-9];(3)立体定位仪辅助结合负压装置取样法[10-12];(4)置管法[13]。由于大鼠小脑延髓池内血管丰富,腔隙狭小,很容易刺破血管及延髓,导致血液混杂及动物死亡,无法进行重复采样。并且脑脊液采集多采用立体定位仪辅助进行穿刺抽取,需两人配合,且操作相对复杂、用时长。相比较而言,经皮穿刺抽取脑脊液技术具有所需器材简单、单人可操作完成,且创面小、不易感染、利于重复取样等优点。但存在经皮穿刺技术难度较高,不熟练时很容易刺破血管及脑组织导致出血及动物死亡等问题。同时,如实验需要间断重复采集脑脊液进行分析,因此寻找一种安全性高,方便快捷的脑脊液收集方法非常必要。在参考传统经皮穿刺取脑脊液方法基础上,我们进行实验技术的改良,建立一种适合单人操作、不需要特殊仪器、成功率高、重复采集动物存活率高的脑脊液收集技术。
1 材料与方法
1.1 实验动物
选取SPF级Sprague-Dawley (SD)大鼠90只,雄性,体重230~250 g,6周龄左右。由空军军医大学实验动物中心提供[SCXK(陕)2019-001]。动物实验在空军军医大学实验动物中心实验室内进行[SYXK(陕)2019-001]。实验所有操作遵循空军军医大学伦理道德委员会指导原则。
1.2 仪器和试剂
1 ml注射器(注射针规格: 0.45 mm×16 mm),橡皮筋,直剪,戊巴比妥钠,碘伏消毒液,无菌棉球,镊子,离心机(Eppendorf 5418R,德国)。
1.3 改良经皮穿刺抽取脑脊液法
将1 ml注射器针头剪断,保留针头约0.7 cm左右,打磨针头使其不至于过钝。将针管用直剪从中部剪断,在活塞柱上缠绕橡皮筋,调整橡皮筋位置位于实验者无名指和小拇指之间。用大拇指与食指固定前端针筒,剩余三指反复旋转抽动活塞使活塞在针筒内移动更加灵活,以尽量减少抽取脑脊液时移动活塞带来的瞬时负压。用2%戊巴比妥钠(0.3 ml/100 g 腹腔注射)麻醉大鼠,头项部毛剔除干净。操作者左手将大鼠头部固定,酒精或碘伏消毒,抬高至与躯干成135°[14],另一只手触及枕骨大孔,寻找并标记最佳进针点:在枕骨隆凸中下 0.6~0.7 cm, 第一颈椎上0.3~0.4 cm处,进针深度在0.8~1.2 cm范围内[6],右手手心向下横卧针筒,针头斜面朝下,大拇指和食指握住针筒近端顺大鼠头部平行稍向上角度小心控制缓慢进针。当感受到第2次突破感时(先刺破皮下再突破黄韧带,但大鼠组织较薄,有时只能感受到一次突破感,需注意控制进针深度)立即停止进针并缓慢抽取脑脊液,抽取脑脊液过程中缓慢抽动活塞,并小心调整进针深度不超过0.3~0.5 cm为宜。脑脊液抽取完毕,迅速拔针(图1)。观察脑脊液液体是否清亮,肉眼无血液混杂为成功采集标准[6,15]。采集后可向小脑延髓池内注射补充稍少量生理盐水。重复采集时,动物手术时使用加热垫保温,动物复苏后状态良好,观察3 d以上未见异常再进行下一次取样。最后一次取样24 h后,腹腔注射2%戊巴比妥钠麻醉,生理盐水灌注后迅速断头取出穿刺部位脑干组织,放置于4%多聚甲醛中固定24 h,按HE染色步骤进行染色观察损伤情况。
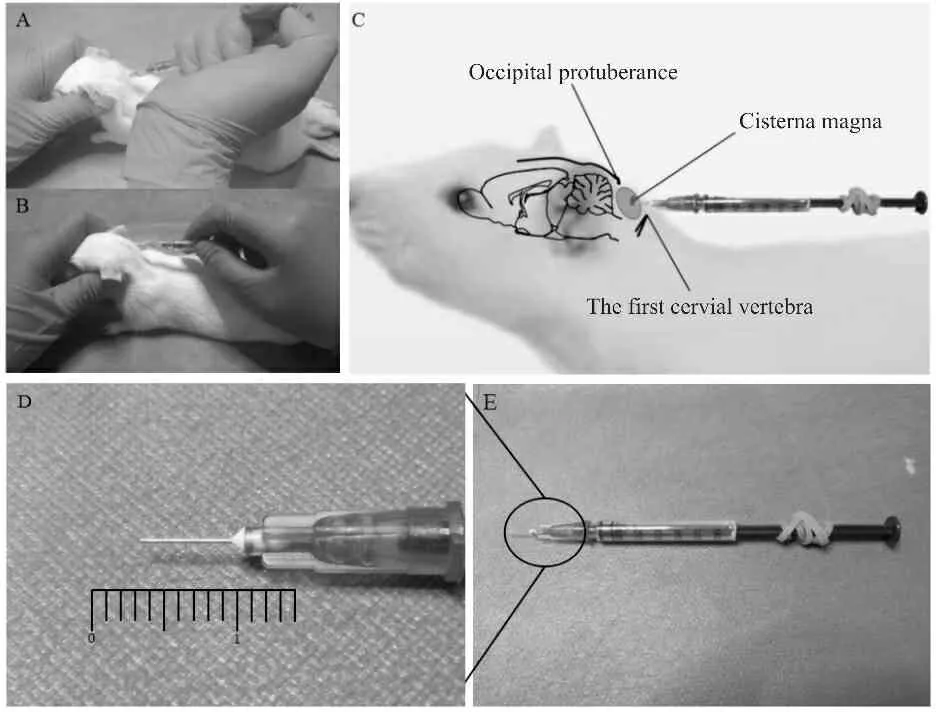
Fig. 1 The modified percutaneous cisterna magna puncture
A: Classical percutaneous cisterna magna puncture; B: Modified percutaneous cisterna magna puncture; C: The improved syringe and puncture site; D、E: The modified syringe
1.4 统计学处理
采用SPSS 23.0统计软件进行分析,动物存活率的比较采用2检验。
2 结果
2.1 大鼠体重、进食量结果
三次取样结束后,测量对照组、传统组、改良组大鼠体重。发现三组大鼠体质量无显著差异(P>0.05)。每次取样前一日测定大鼠日进食量,三组进食量无显著差异(P> 0.05,表1)。进食量和体重三组未见显著区别,提示经皮穿刺取脑脊液对于存活大鼠生长发育无显著影响。

Tab. 1 Body weight and feed intake of rats in three different
2.2 单次脑脊液采样实验结果
采用传统采集方法取样30只大鼠,其中19只大鼠成功采集合格脑脊液,其中6只采集到血性脑脊液,其中5只未采集出脑脊液,成功率为63.33%,脑脊液采集量为(83.53±41.39)μl。按照固定大鼠头部开始计时,平均采样用时为(114.07±11.19)s。应用改良经皮穿刺法取样30只大鼠,26只大鼠成功采集合格脑脊液,其中3只采集到血性脑脊液,其中1只未采集出脑脊液,成功率为86.67%,脑脊液采集量为(98,70±26.15)μl。按照固定大鼠头部开始计时,平均采样用时(116.97±12.46)s(与传统采集方法取样法比较,P均>0.05)。与传统法相比,改良法可提高采样成功率,而采样量与采样用时两组无显著差异。
2.3 脑脊液重复采样实验结果
第一次取样后传统组存活18只,改良组存活24只;第二次取样后,传统组存活10只,改良组存活18只;第三次取样后传统组剩余3只,改良组存活15只。三次取样存活率依次为10%和50%。二次重复采集累积存活率经过卡方检验(2= 4.286,P<0.05),三次重复采集存活率经卡方检验(2=11.429,P< 0.01,表2)。统计结果提示传统法和改良法在重复采集累积存活率上有显著差异,改良法可明显提高动物脑脊液重复采样累积存活率。
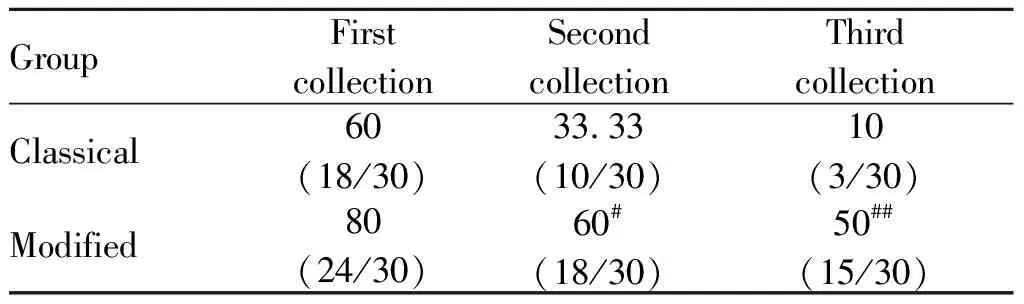
Tab. 2 Survival rates of rats in the two groups (%)
2.4 病理组织形态学观察
HE染色结果提示改良穿刺组和正常对照组均无任何损伤或神经退行性变。穿刺区域脑组织未见水肿,无坏死和胶质细胞增生。结果表明改良组穿刺手法安全,对动物的损伤小(图2)。

Fig. 2 Representative brain stem sections from the region of CM puncture(HE ×5)
3 讨论
脑脊液主要存在于脑室和蛛网膜下腔,环绕大脑和脊髓,主要由脉络丛上皮细胞分泌,经蛛网膜吸收入血循环。其主要成分为葡萄糖、微量蛋白质及少量淋巴细胞。因脑脊液成分的变化常反映脑组织内细胞代谢及病理指标变化,因此脑脊液分析是针对中枢系统研究的常用技术。但是,大鼠脑脊液量少。已有文献报道,体重为300 g左右大鼠其脑脊液体积约为580 μl[13],而能从小脑延髓池内单次采集获得的脑脊液仅为100 ~ 120 μl[13]。除此之外,采集过程通常还由于穿刺位置空间狭小,极易伤及血管及脑组织等困难[7, 11]。同时,很多实验需要重复采样,因此寻找一个可靠便捷、动物存活率高的采集方法非常必要[16]。
经皮穿刺法选取小脑延髓池处进行穿刺,该部位骨性结构明显,寻找穿刺点较为简单。但由于穿刺部位紧邻延髓、小脑、下丘脑等处,是神经中枢聚集地,具有重要的神经调节及神经分泌功能[17],如操作不当极易导致动物死亡。传统经皮穿刺法技术难度较高,需多次反复练习才能把握好穿刺角度、穿刺位置以及进针力度。其中,穿刺力度由于单手反握更难以控制,容易因穿透时力度控制不到位或角度偏移导致针尖刺入过深,伤及小脑、延髓导致动物存活率低及脑功能损伤,或刺破血管导致脑脊液污染,重复取样困难大。我们在实验中发现经皮穿刺小脑延髓池取样法相较于其他方法最为方便、快捷。具有对设备要求低,方便单人操作,动物创面小,反复取样动物存活率高的优点。
本文经过对传统经皮穿刺抽取脑脊液方法进行改良,将“反握法”调整为“正握法”,且进一步对穿刺针筒进行改进,增大了手部对进针深度的控制力度,有效减少突破黄韧带时刺入过深导致出血和伤及延髓的情况。需注意的要点:(1)穿刺角度与进针力度:大鼠头部抬高至135°,左手固定时注意将皮肤向下拉扯固定,防止皮肤肌肉组织滑动,进针时可与桌面保持平行进针,进针力度不可过大,需感到有穿刺感后再小心突破黄韧带;(2)针尖移动:刺入黄韧带后立即停止进针,右手中指无名指小指控制活塞施加微小负压,仔细观察针尖是否有清亮液体进入,若无,保持针筒内活塞位置,根据实际进针角度略微向后或上下移动针头(向前极易伤及脑组织);(3)脑脊液收集:抽取脑脊液时负压不可过高,且缓慢小心抽取,看到有清亮液体进入针头后,保持针管内负压直至液体不再流入时缓慢移动活塞进行吸引,吸引量不宜超过100 μl,否则出血风险大,造成操作失败;(4)血液混杂处理:若收集末观察有少许血液进入针头,立即拔针,弃掉针头,收集针管内剩余液体;若对样品纯度要求稍低,也可根据实验目的对混有微量血液的样品进行4℃ 1 000 r/min 10 min离心处理;(5)反复采样:需反复采样时,单次采样不宜过多,采样后可向小脑延髓池内注射等量生理盐水。同时,采样间隔不宜过短。为提高动物存活率及观察采样后动物存活情况,本文研究时重复采样均间隔3 d以上;(6)动物麻醉方式:为提高脑脊液采集成功率及动物远期存活率,本文选择2%戊巴比妥钠(0.3 ml/100 g 腹腔注射)麻醉方式,该方法经文献报道心血管反应小、远期不良反应少、动物存活率高,因此利于重复采样[18, 19]。(7)存在缺陷:不可否认本文所提供方法仍存在一定局限性。实验发现,本文所述方法因操作力度较为温和不适合体型稍大动物,其黄韧带过硬则较难穿刺。但该方法与立体定位仪固定法相比优势,操作更为简单,用时短,且设备需求低,同时避免微量进样器采样时交叉污染的风险。同时经皮穿刺能最大限度保留原有肌肉结构,减少直视下经硬脊膜穿刺时肌肉出血导致的样品污染,肌肉组织在退针后的自然封闭可以有效避免脑脊液外漏,减少伤口感染,能更加有效保证动物存活与恢复,利于重复采样。综上所述,本文建立的改良经皮穿刺抽取脑脊液技术成功率高,方便快速,重复采样研究动物存活率高,是一种简便易行的适合单人操作的脑脊液收集技术。

