PM2.5鼻腔滴注致小鼠海马组织损伤的炎性机制*
方 振,胡西厚,李 康,韩 洁,3,田 蕾,闫 峻,张 伟,来文庆,林本成,刘晓华,3△,袭著革△
(1. 滨州医学院公共卫生与管理学院,山东 烟台 264000; 2. 军事科学院军事医学研究院环境医学与作业医学研究所,天津 300050;3. 天津体育学院,天津 301617)
随着我国经济和人口快速增长以及工业和交通快速发展,我国的大气环境污染日益严重化,其中雾霾污染的范围、持续时间和危害日益增加,颗粒物污染已经成为社会关注的热点。细颗粒物(fine particulate matter, PM2.5)是雾霾的主要成分之一,是指空气动力学直径小于等于2.5 μm的颗粒物,具有粒径小,比表面积大,悬浮时间长,输送距离远且易于携带铅、多环芳烃等有毒有害物质的特性。PM2.5能够通过鼻腔、呼吸道进入肺泡乃至支气管,最后通过血气交换进入血液作用全身,PM2.5主要作用于呼吸系统和心血管系统,易引起哮喘等呼吸系统疾病和心肌梗死等心血管系统疾病[1-2],同时PM2.5也可通过血脑屏障,嗅神经进入脑部导致脑损伤以及神经系统损害[3]。
目前针对小鼠的PM2.5染毒方法主要有雾化吸入法、鼻腔滴注法、暴露式气管滴注法、非暴露式气管滴注法等[4]。PM2.5鼻腔滴注染毒可以通过嗅神经进入嗅球,最后进入大脑其它组织,称为嗅脑通路。目前关于嗅脑通路的研究较少,而嗅脑通路在PM2.5致神经毒性的作用机制研究也相对较少,因此本研究通过对小鼠鼻腔滴注PM2.5进行染毒暴露,后续观察小鼠肺组织和海马组织病理学改变,测定小鼠血清中的肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)、白介素-1β(interleukin-1β, IL-1β)和白介素-6(interleukin-6,IL-6)水平以及通过抗体芯片技术测定海马组织炎性因子水平的变化来探讨鼻腔滴注PM2.5致小鼠海马组织损伤的炎性机制。
1 材料与方法
1.1 仪器与试剂
2030型中流量智能TSP采样器(青岛崂应,中国),玻璃纤维滤膜(青岛崂应,中国),超声波清洗器KQ-500E(昆山超声仪器,中国),离心机(Eppendorf,德国),真空冷冻干燥仪(Martin Christ,德国),-80℃冰箱(Thermo,美国),酶标仪(Molecular Devices,美国)。TNF-α、IL-1β、IL-6 ELISA试剂盒(武汉伊莱瑞特,中国)、小鼠炎性因子抗体芯片 (Raybiotech,美国)。
1.2 PM2.5采集、表征和处理
于2015年选择雾霾天气严重,颗粒物(particulate matter, PM)较为丰富的1月至3月,在位于天津市中心城区的环境医学与作业医学研究所5楼阳台,利用2030型中流量智能TSP采样器采集PM2.5,采样流量为100 L/min,每天24 h连续采样。将采集的PM2.5通过气相色谱-质谱网络系统分析16种多环芳烃(polycyclic aromatic hydrocarbons, PAHs),通过电感耦合等离子体发射光谱仪测量9种元素,PM2.5成分分析的结果见文献[5]。
将采集有PM2.5的滤膜剪成1 cm2大小的碎片,置于干净的烧杯中,加超纯水浸泡,超声震荡15 min,重复3次,工作频率500 W。用1200目分样筛过滤,将滤出液置于-80℃冰箱冷冻过夜,之后在真空冷冻干燥机中冻干,称重后-80℃避光保存。称取适量PM2.5干粉,经紫外照射30 min,然后在超净台中加入生理盐水配制成1 mg/ml的PM2.5悬液,以备动物染毒使用。
1.3 实验动物分组及PM2.5鼻腔滴注染毒
将30只小鼠随机分为3组(n=10):对照组(Control)、低剂量组(Low dose)、高剂量组(High dose)。实验组染毒剂量分别为1.5 mg/kg BW PM2.5和 7.5 mg/kg BW PM2.5,对照组给予等体积的生理盐水,隔天染毒一次,共12次。动物染毒前超声处理PM2.5悬液20 min,待充分混匀后开始染毒。称取并记录小鼠体重后,用微量移液器分别吸取相应剂量的震荡摇均后的PM2.5悬液,缓慢匀速滴入小鼠鼻腔进行染毒。
1.4 肺组织和海马组织形态学观察
取各组肺组织和大脑海马组织,经4%多聚甲醛固定,梯度乙醇脱水,二甲苯透明,石蜡包埋,制成3 μm切片行HE染色,显微镜下观察肺组织形态改变。
取各组海马组织经1%锇酸固定液固定,用0.1 mol/L磷酸漂洗液漂洗,经梯度乙醇、1∶1的90%乙醇和90%丙酮和梯度丙酮脱水处理,纯丙酮加包埋液包埋后固化,LKB-1型超薄切片机切片50~60 nm后3%醋酸铀-枸橼酸铅双染色,日本电子JEM-1011透射电镜观察海马超微结构变化。
1.5 ELISA法检测血清中炎性因子水平
各组小鼠全血样品于室温放置2 h后于1628 r/min离心20 min,取上清。在96孔板中,每孔加入100 μl上清液,严格按照TNF-α、IL-1β、IL-6 ELISA试剂盒说明书进行操作,检测血清中炎性因子变化。
1.6 蛋白芯片检测海马组织炎性因子表达变化
利用Raybiotech公司生产的小鼠炎性因子抗体芯片G1检测海马组织中40种炎性因子的表达变化。各组小鼠处死后,取250~500 mg海马组织,加1 ml含蛋白酶抑制剂的总蛋白抽提试剂,匀浆后抽提总蛋白。按照蛋白质定量试剂盒操作说明,测定样品浓度。抗体芯片在封闭缓冲液中封闭30 min,然后与蛋白样品室温孵育1~2 h,抗体芯片经洗涤缓冲液清洗,加入生物素标记的抗体,室温孵育1~2 h。抗体芯片经洗涤缓冲液清洗,加入荧光素耦合的链霉亲和素,荧光信号直接使用Axon扫描仪扫描。蛋白信号强度通过荧光扫描值定量获得原始信号值,通过减去Axon扫描仪测得的背景值做修正,并用中值做标准化。通过标准化数值的组间比较,比值≥1.50或≤0.66为差异表达的蛋白。
1.7 统计学处理
2 结果
2.1 PM2.5染毒对小鼠血清中炎性因子的影响
与对照组相比,低剂量组和高剂量组小鼠血清中炎症因子TNF-α、IL-1β、IL-6水平均无显著差异(表1,P>0.05)。结果表明,鼻腔滴注PM2.5未诱导小鼠发生系统性炎症反应。
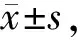
Tab. 1 Changes of serum TNF-α, IL-1β, IL-6 in mice exposed to different concentrations of PM2.5 (pg/ml, n=10)
2.2 PM2.5染毒对小鼠肺组织形态的影响
对照组小鼠肺组织整体结构正常,肺泡结构清晰,肺泡壁无明显增厚(图1A);低剂量组和高剂量组小鼠肺组织结构与对照组相比未见显著差异,肺泡壁无明显增厚,无明显炎性细胞浸润(图1B、C)。结果表明,鼻腔滴注PM2.5没有诱导肺组织出现比较明显的病理性损伤(图1,见彩图页Ⅳ)。
2.3 PM2.5染毒对小鼠海马组织形态的影响
海马组织经HE染色后,对照组小鼠海马CA3区结构正常,神经元排列整齐,无炎性细胞浸润(图2A);低剂量组小鼠海马CA3区出现神经元轻度排列紊乱(图2B);高剂量组小鼠海马CA3区神经元排列明显紊乱(图2C,图2见彩图页Ⅳ)。
海马组织超微结构观察,发现对照组小鼠海马区结构基本完整,神经元细胞分布比较密集,高倍镜下可见结构良好的突触小体,小血管内衬完整内皮细胞,外侧有完整基底膜结构(图3A);低剂量组神经元细胞周围的突触数量较少,部分突触小体水肿,小血管周围水肿,形成水肿裂隙,周围神经髓鞘变性(图3B);高剂量组小鼠海马区神经元细胞凋亡比较常见,神经元细胞周围的突触数量较少,少数有水肿变性,小血管周围水肿(图3C)。以上结果表明:鼻腔滴注PM2.5可以诱导小鼠海马组织发生以神经元细胞损伤和小血管周围水肿为主的病理性损伤。
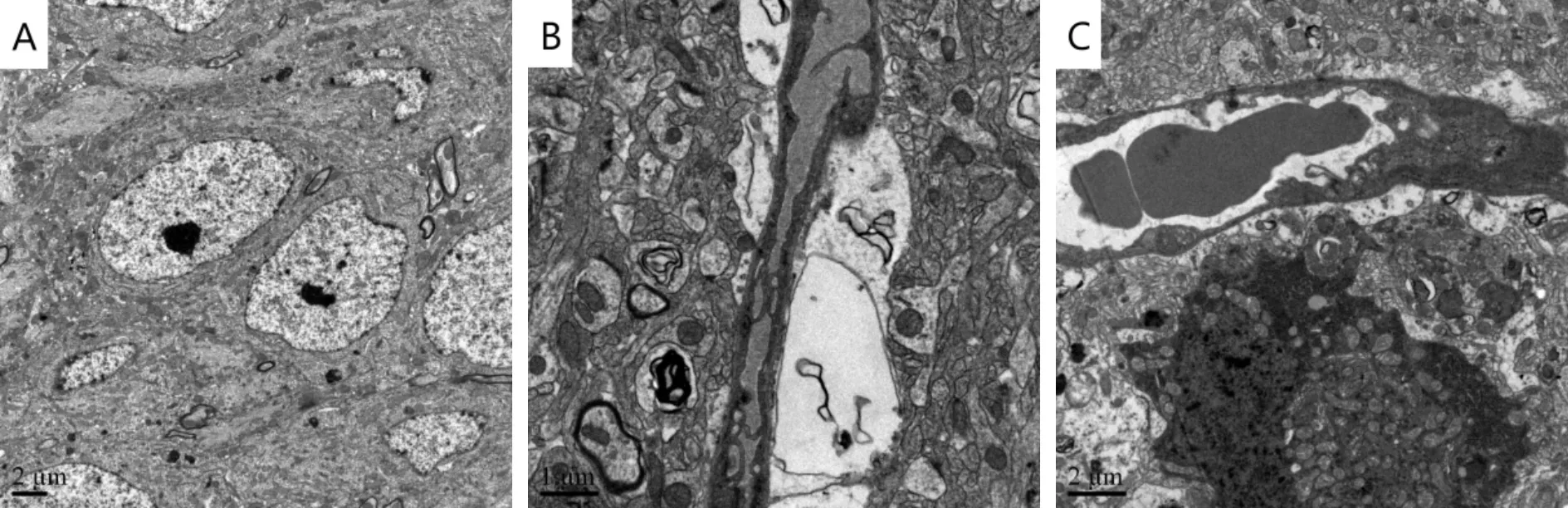
Fig. 3 Representative photographs of hippocampus of mice from various groups on the 12th exposure after nasal instillation (3% uranyl acetate-lead lead citrate double staining,A,C ×5 000,B ×10 000)
A: Control group; B: Low dose PM2.5group; C: High dose PM2.5group
2.4 PM2.5染毒对小鼠海马组织炎性因子的表达的影响
利用抗体芯片检测海马组织中20种炎性因子的表达变化,发现PM2.5暴露后差异表达炎性因子的聚类图见图4,表达量统计结果见表2(图4见彩图页Ⅳ)。结果显示,与对照组比较,PM2.5暴露使低剂量组海马组织中的炎性因子CX3CL1、CSF2、IFN-γ、IL-2、IL-17A、CSF1、SDF-1、TECK、TNF-α、IL-10、IL-6、IL-12p70、MCP1和TCA-3显著升高(P<0.05),MIG和sTNFR1显著降低(P<0.05);高剂量组海马组织中的炎性因子CX3CL1、CSF2、IFN-γ、IL-2、IL-17A、CSF1、SDF-1、TNF-α、IL-10、IL-6、IL-12p70和MCP1显著升高(P<0.05),Leptin、MIG、FASLG、MIP-1、sTNFR1和CD30LG显著降低(P<0.05)。
通过分析发现,PM2.5暴露可诱导白细胞介素(IL-2、IL-10、IL-6、IL-12p70和IL-17A)、TNF-α、IFN-γ、集落刺激因子(CSF1和CSF2),趋化因子(CX3CL1, SDF-1、MCP1)显著升高(P<0.05);趋化因子(MIG和sTNFR1)显著降低(P<0.05),它们的变化与暴露剂量不相关。另外,趋化因子TECK仅在低剂量组显著升高(P<0.05),趋化因子TCA-3仅在高剂量组显著升高(P<0.05),而趋化因子(MIP-1,FASLG,CD30LG和Leptin)仅在高剂量组显著降低(P<0.05)。以上结果表明,海马组织中的TNF-α、IL-6等促炎因子的显著升高和sTNFR1 、FASLG等炎性疾病标志物的显著降低,这可能为鼻腔滴注PM2.5诱导海马组织损伤的炎性机制。
Tab. 2 Changes of inflammatory cytokines in mice hippocampus after exposed with different concentrations of PM2.5(ng/ml, n=10)
3 讨论
流行病学发现PM2.5暴露与神经系统疾病有很强的相关性,长期接触PM2.5会增加痴呆、阿尔茨海默病、自闭症谱系障碍、帕金森病等的患病风险[6]。体外实验认为PM2.5具有神经细胞毒性,其与中枢神经系统疾病密切相关[7]。PM2.5可以通过神经炎症、氧化应激、神经元死亡等途径致中枢神经系统损伤。其中海马组织对学习和记忆至关重要,而海马组织的损伤与痴呆,认知障碍等神经系统疾病等密切相关[8]。因此本研究通过对小鼠肺组织和海马组织进行形态学观察和抗体芯片技术检测小鼠海马组织炎性因子的表达变化来初步探讨PM2.5的神经细胞毒性。
一般认为PM2.5进入大脑主要有三条途径,一是PM2.5通过呼吸系统进入肺后,通过血气交换进入血液,最后通过血脑屏障进入大脑;二是PM2.5可以通过嗅神经进入嗅球,最后进入大脑其它组织;三是PM2.5通过神经周围的细胞外间隙进入脑脊液,最终进入大脑[9]。本研究通过鼻腔滴注PM2.5来验证PM2.5是否可以引起海马组织损伤。因本实验未对PM2.5进行相关标记,故PM2.5转归路径无法确定。通过海马组织的显微结构和超微结构研究结果证实通过鼻腔滴注PM2.5可以致海马组织出现明显的损伤。通过血清中炎性因子TNF-α、IL-1β和IL-6水平和肺组织的显微结构的研究结果发现鼻腔滴注PM2.5并没有诱导肺组织出现比较明显的病理性损伤,表明可能鼻腔滴注PM2.5通过呼吸系统以及血气交换这条途径进入海马组织的PM2.5较少,而大部分PM2.5可能通过嗅脑通路进入海马组织。因此PM2.5鼻腔滴注致海马组织损伤的主要作用途径可能为嗅脑通路。
许多研究通过对大鼠进行PM2.5染毒发现,可引起大鼠肺部的炎性损伤,而在本研究中肺组织并没有出现比较明显的病理性损伤,其原因可能有其它研究多为气管滴注,而本研究为鼻腔滴注。例如田程远等采用气管滴注法对雄性SD大鼠进行PM2.5染毒发现可引起大鼠肺部的炎性损伤[10];罗斌等采用气管滴注法对雄性Wistar大鼠进行PM2.5染毒发现其不仅引起大鼠心肌组织氧化损伤和抗氧化功能的抑制,还引起心脏的炎症反应[11]。以上研究表明通过气管滴注适量浓度的PM2.5可以引起大鼠肺部和心脏的炎性损伤;另外可能与本研究浓度相对较低有关。
PM2.5主要作用于呼吸系统和心血管系统,本研究通过抗体芯片检测海马组织炎性因子的表达变化,发现差异表达的炎性因子可分为8类炎性因子。其中与对照组比较,低剂量组和高剂量组海马组织中都显著升高的炎性因子在炎症反应中发挥重要作用,可以作为炎症反应的生物标志物有IL-2、IL-10、IL-6、IL-12p70和IL-17A等白细胞介素类和肿瘤坏死因子TNF-α[12];有主要由活化的T细胞和NK细胞分泌,在免疫调节中发挥重要作用的干扰素IFN-γ[12];有作为炎症调节因子具有良好的抗细胞凋亡和较强的抗炎作用的菌落刺激因子CSF1和CSF2[13];有与中枢炎症有着密切的联系,可以诱导炎症反应发生或作为促炎趋化因子的CX3CL1, SDF-1、MCP1等趋化因子[14-16];与对照组比较低剂量组和高剂量组海马组织中都显著降低的炎性因子有诱导活化T细胞的趋化因子MIG,诊断炎症性疾病重要标志物的肿瘤坏死因子TNF受体sTNFR1[17-18]。与对照组比较只在低剂量组显著升高的炎性因子有参与炎症反应、免疫反应、白细胞调节的趋化因子TECK[19],没有只在低剂量组显著降低的炎性因子;与对照组比较只在高剂量组显著升高的炎性因子有来源自活化的T淋巴细胞,作为巨噬细胞和白细胞的重要趋化因子TCA-3[15],而只在高剂量组显著降低的炎性因子有发挥激活及趋化单核细胞的作用,进而引起炎症等机体反应的趋化因子MIP-1[20],参与全身炎症因子调节作用,属于肿瘤坏死因子TNF超家族的配体FASLG[21]和CD30LG[22],广泛调节各种免疫细胞的分化、 成熟、迁移、细胞因子分泌的瘦素Leptin[23]。
综上所述,鼻腔滴注PM2.5可诱导小鼠海马损伤,作用途径可能为嗅脑通路,炎性机制可能与海马组织中的TNF-α、IL-6等促炎因子的显著升高和sTNFR1 、FASLG等炎性疾病标志物的显著降低有关。

