同轴穿刺植入125I粒子治疗局部晚期胰腺头颈部癌的安全性及有效性
杜 鹏,卢 伟,蒋富强,杨 剑
(中国人民解放军总医院第六医学中心介入医学科,北京 100048)
胰腺癌是消化系统常见恶性肿瘤之一,起病隐匿,恶性度高,发展快,发现时常已无法手术切除,患者1年生存率约10%,5年生存率仅1%~3%[1]。由于胰腺癌本身的生物学特性及解剖部位特点,传统放射治疗(简称放疗)及化学治疗(简称化疗)效果差,且毒副作用较大。近年来,影像引导下微创介入治疗发展迅速,用于治疗胰腺癌已取得良好疗效[2-3],放射性125I粒子植入术是其中一种。植入125I粒子的传统方法是经多针或单针穿刺,胰腺癌位置深在,周围毗邻关系复杂,常需要反复穿刺,导致并发症增加。本研究者观察基于同轴套管针穿刺植入125I粒子治疗局部晚期胰腺头颈部癌的安全性及有效性。
1 资料与方法
1.1 一般资料 回顾性分析2016年10月—2019年1月中国人民解放军总医院第六医学中心收治的21例局部晚期(Ⅲ期)胰腺头颈部癌患者,男15例,女6例,年龄43~69岁,平均(52±6)岁;肿瘤最大径2.32~4.56 cm,平均(3.51±1.10)cm。纳入标准:①术前病理确诊为胰腺导管细胞癌,且肿瘤局限于胰腺内,位于胰腺头颈部或钩突,侵犯腹部主要血管;②无法行根治性外科切除;③近1个月内未接受化疗及其他药物治疗,近6个月内未接受放疗;④卡式功能状态评分(Karnofsky performance status scale,KPS)≥60分。排除标准:①胰腺外重要脏器转移;②血小板及凝血功能差,经治疗无法恢复正常;③一般状况差,无法耐受手术;④恶性腹腔积液。
1.2 仪器与方法 采用Philips 16层大孔径螺旋CT机,管电压120 kVp,管电流220 mAs,层厚5 mm(必要时3 mm)。中国核工业部生产125I,直径0.80 mm,长度4.50 mm,活度0.70~0.80 mCi。同轴穿刺套管直径17G,长度7或11 cm;粒子植入针直径18G,长度15或20 cm。
于术前1周行胰腺CT增强扫描,并将图像导入治疗计划系统(treatment planning system,TPS)。根据肿瘤位置及毗邻关系,尽量避开腹腔脏器、血管及胰胆管设计穿刺套管针穿刺路径。勾画肿瘤临床靶体积(clinical target volume,CTV)及计划靶体积(planning target volume,PTV),根据肿瘤毗邻脏器照射剂量耐受程度,PTV为CTV外扩0~1 cm。采用TPS自带扇形布源系统对拟穿刺层面计划布针,若涉及多层面布针,则模拟每个穿刺层面的扇形植入计划,使粒子在肿瘤内形成近似锥形分布,计算肿瘤周边匹配剂量(match peripheral dose,MPD)。术前3天口服肠道抗生素,术前1天禁食,给予抑酸及抑制胰液分泌药物,必要时口服少量无菌对比剂显示胃肠道。
使患者体位与TPS计划时相同,行CT扫描评估TPS计划的可行性。皮肤局部麻醉后,在CT间断扫描下将17G套管针步进式穿刺至肿瘤内约0.50 cm,确定针尖位置后退出针芯,观察有无出血及胰液或胆汁溢出。将18G粒子植入针从套管针鞘穿进肿瘤内(图1、2),根据术前TPS计划进行同平面扇形穿刺布针,使粒子植入间距0.5~1.0 cm,远端粒子较近端粒子排列密集。同平面植入完毕后,通过杠杆原理变化套管针鞘方向,进行头尾侧穿刺并植入粒子。植入完毕后保留套管针鞘位置,将术后CT图像导入TPS进行质量验证,若存在粒子剂量冷区则适时进行粒子补种。术后禁食1天,予抑酸及抑制胰腺分泌药物3天。

图1 18G粒子植入针从17G外套管针鞘中穿行,外套管针鞘尖端为钝头 图2 患者男,52岁,胰头癌 A.穿刺路径受胃体阻挡;B.轻捻外套管针鞘,使穿刺针划过胃壁进入肿瘤
1.3 疗效评价 术后2、4及6个月行胰腺增强CT扫描,由2名放射科副主任医师(工作年限分别为15、20年)判读肿瘤大小、密度及强化程度。根据实体瘤疗效评价标准(response evaluation criteria in solid tumor,RECIST)1.1评价治疗效果。完全缓解(complete response,CR):已知肿瘤病灶完全消失,维持至少4周;部分缓解(partial response,PR):目标病灶最长径之和减少>30%,维持至少4周;疾病进展(progressive disease,PD):目标病灶最长径之和增加>20%;疾病稳定(stable of disease,SD):介于PR与PD之间。治疗有效率为(CR+PR)/总例数×100%,局部控制率为(CR+PR+SD)/总例数×100%。
1.4 安全性评价 观察并记录患者术中反应及手术相关并发症,统计术后并发症及放射性损伤。根据放射肿瘤协作组(Radiation Therapy Oncology Group,RTOG)放射性损伤分级标准评估放射性损伤。
2 结果
所有患者均顺利完成粒子植入(图3),每例植入粒子为21~45颗,平均(32±12)颗。MPD为110~145 Gy,中位数为120 Gy。
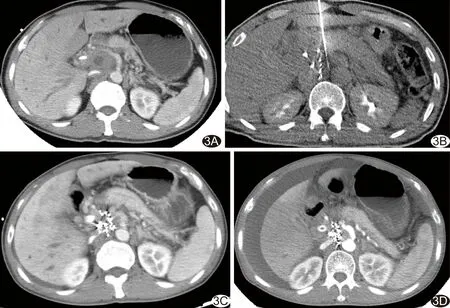
图3 患者男,55岁,胰腺构突部癌 A.术前腹部增强CT示胰头钩突区恶性肿瘤,毗邻肝脏、十二指肠、腹腔干、主动脉及下腔静脉;B.术中采用同轴外套管针经皮经肝穿刺植入粒子;C.术后4个月复查腹部增强CT,肿瘤内粒子呈近似扇形分布,肿瘤较术前缩小;D.术后6个月复查腹部增强CT,肿瘤进一步缩小,粒子聚集
术后2个月治疗有效率及局部控制率分别为38.10%(8/21)、95.24%(20/21),术后4个月分别为47.62%(10/21)、80.95%(17/21),术后6个月分别为52.38%(11/21)、80.95%(17/21)。见表1。
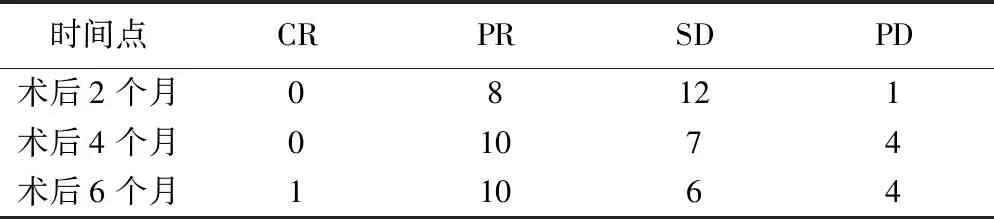
表1 125I粒子植入治疗局部晚期胰腺头颈部癌疗效(例,n=21)
10例术中出现腹部疼痛,10例腹胀,2例恶心;术中手术相关并发症主要为局部腹腔出血2例,皮下软组织血肿2例,误穿胰管1例。术后10例出现发热,3例食欲下降,未见胰腺炎、胃肠道穿孔、胃排空障碍、胰瘘、胆瘘及肠梗阻等严重并发症。21例中,18例发生0级、3例Ⅰ级急性放射性肠炎,无Ⅱ级以上急性放射性损伤。
3 讨论
胰腺癌恶性度高,症状隐匿,侵袭性强,往往出现临床症状时才被发现。局部晚期胰腺癌指肿瘤局限于胰腺内,但侵犯腹部主要血管,无法行根治性手术切除。尽管近年来胰腺外科技术不断提高,但仍仅不足20%患者具有手术机会,且手术创伤大,并发症发生率高,患者对术后生存质量不满意[4-5]。
胰腺癌对于放化疗均不敏感,传统放化疗效果相对较差,且不良反应大。近年来,影像学引导下微创介入治疗多种实体肿瘤中取得良好疗效[6-8],其用于局部治疗胰腺癌的临床效果亦较好。胰腺头颈部癌解剖部位深在,周围毗邻肝、胃、肠道、血管等重要结构,即使有先进的引导及监测技术,穿刺及治疗也具有较高风险。传统微创物理消融损毁组织不具备选择性,因胰腺毗邻解剖结构复杂,消融时无法达到治疗边界,只能行姑息治疗。纳米刀消融具有选择性,近年用于治疗胰腺癌[9-10],但技术复杂,治疗要求高,费用昂贵,许多医院无法常规开展。放射性125I粒子植入术属于近距离放疗,通过微创介入技术将粒子植入肿瘤内部,不间断释放γ射线以杀伤肿瘤细胞,其辐射半径短,具有瘤内剂量高、瘤外剂量低、高度适形等优势,且植入粒子时可不必过度追求治疗边界。传统粒子植入术多采用多针同时穿刺或单针反复穿刺,增加治疗风险。本研究采用同轴套管针穿刺技术治疗局部晚期胰腺头颈部癌,在进一步降低穿刺风险的同时取得良好的临床效果。
本组手术相关并发症主要为局部腹腔出血2例、皮下软组织血肿2例、误穿胰管1例,无严重并发症出现,与传统植入方式相比安全性较好。既往研究[11]表明,上述严重并发症均与穿刺损伤消化道及胰胆管相关。本研究所用同轴套管针的外鞘管为钝头,当穿刺路径上存在无法避开的胃或肠管时,可将套管针内芯回撤至外鞘管内,旋转外鞘管前进,利用外鞘管钝头缓慢划过胃壁及肠壁(图2),可明显减少对胃肠道的机械性损伤。利用此项技术还可减少穿刺血管损伤。本组术后出现发热10例、食欲下降3例,发热为肿瘤吸收热,食欲下降考虑与轻度放射性胃肠炎相关,经对症处理后均短期内好转。术后2个月治疗有效率及局部控制率分别为38.09%(8/21)、95.24%(20/21),术后4个月分别为47.62%(10/21)、80.95%(17/21),术后6个月分别为52.38%(11/21)、80.95%(17/21),与其他文献[12-13]报道的治疗效果相当,表明基于同轴穿刺粒子植入技术可以达到传统粒子植入术的临床疗效。术中根据TPS同平面扇形布针计划穿刺,多层面穿刺时利用杠杆原理撬动套管针外鞘调整方向,最终植入粒子以套管针针尖为顶点向远端成锥形分布,远端较近端密集,在保证疗效的同时尽量减少近端胃肠道放射性损伤的可能性。但由于缺乏真正匹配的TPS锥形布针计划系统,且术者同轴穿刺技术水平不一,可能使粒子瘤内分布不均,导致剂量学误差而影响治疗效果。
总之,采用同轴穿刺技术植入125I治疗局部晚期胰腺头颈部癌的安全性及有效性均较好,但有待大样本、多中心随机对照研究验证。

