老年性白内障患者外周血环状RNA差异表达谱研究
杜红飞 庞雪利 阳燕 周晓萍 许颖
白内障是我国乃至全世界常见的高致盲性眼病[1-2]。眼部受损、老龄化、糖尿病、紫外线照射、药物及其他眼部疾病等多种因素皆可导致晶状体蛋白变性、混浊,增加白内障的发病率[3]。近年来,由于人口老龄化的增加,老年性白内障发生率逐年升高,极大地降低了该病患者的生活质量。因此,我们迫切需要探究老年性白内障发生发展的病理机制,寻找更有效生物标志物,早期检测和诊断白内障,从而减轻白内障的危害。
环状 RNA(circular RNAs,circRNAs)是一种新类型的非编码RNA,由外显子或内含子反向剪接构成[4-5]。目前研究发现,circRNAs广泛存在于真核细胞胞质中,能够在转录和转录后调节基因的表达。与传统线型RNA不同,circRNAs没有5’端帽子和 3’末端poly(A)尾巴结构,不易被核酸外切酶降解,因此比线性RNA更具稳定性和高度保守性,可作为生物标志物和潜在临床治疗靶标[6-7]。另外大量研究证实,circRNAs的异常与人类疾病具有密切的关系,如癌症[8-9]、心血管疾病[10]和阿尔茨海默病[11]等。然而,对于circRNAs在老年性白内障中的研究目前尚未见报道。因此,本研究拟采用circRNAs芯片技术检测老年性白内障患者外周血中circRNAs表达,研究其circRNAs表达谱特征,为老年性白内障的预防、早期诊断、靶向药物的开发及临床治疗进一步提供理论基础。
1 资料与方法
1.1 一般资料选取2019年1月1日至2019年3月31日成都医学院第一附属医院初次确诊为皮质型老年性白内障且不合并其他任何疾病的3例患者作为试验组,依据晶状体混浊分类系统LOCSII,试验组晶状体皮质混浊为C3,晶状体核透明,均为男性,皆在临床干预治疗前静脉抽取患者EDTA抗凝的全血标本。另选取同时间段于本院体检部体检正常的3名健康者作为对照组,均为男性,抽取患者EDTA抗凝的外周血标本,全血标本均冻存于-80 ℃冰箱保存。所有研究对象均排除其他眼科疾病和重要器官系统疾病,如糖尿病、高血压、自身免疫性疾病、肿瘤等,且研究对象均知情并同意参加本项试验。该研究过程经医院伦理委员会审查批准。
1.2 主要试剂和材料Trizol试剂 (Invitrogen life technologies,美国),荧光标记cRNA的Arraystar Super RNA Labeling试剂盒、circRNAs芯片(Arraystar,美国)。
1.3 方法
1.3.1 提取样本总RNA用于circRNAs芯片检测的试验组和对照组样本分别由3例老年性白内障患者全血RNA混合和3名健康体检者全血RNA样本混合组成,每个样本1 mL,每组3个样本,各提取核酸后按照11的体积混合,采用Trizol法分别提取老年性白内障患者和健康体检者外周血的总RNA,利用NanoDrop ND-1000及琼脂糖凝胶电泳法评价总RNA的浓度、完整性及纯度。
1.3.2 circRNAs微阵列芯片利用NanoDrop ND-1000对提取的总RNA进行浓度和纯度检测。采用Arraystar标准方案制备样本并进行芯片杂交:先用Rnase R(Epicentre,Inc.美国)消化总RNA用以去除线性RNA并富集circRNAs,然后采用随机引物的方法(Arraystar Super RNA Labeling Kit;Arraystar,美国)扩增富集的circRNAs并转录成带荧光标记的cRNA。再利用RNeasy Mini Kit(Qiagen,德国)对cRNA进行纯化并使用NanoDrop ND-1000检测cRNA浓度和活性。最后将标记荧光的cRNA与Arraystar Human circRNA Array V2 (Arraystar,美国)杂交。Agilent清洗液试剂盒清洗芯片后用Agilent G2505C扫描。
1.3.3 circRNAs芯片数据采集与分析将扫描获得的芯片图,用Agilent Feature Extraction(11.0.1.1版)进行解析获得原始数据,然后利用R语言中的limma对数据进行归一化和后续的数据处理。计算每个circRNAs分子在组间的fold change值,并将|fold change|≥ 2.0的circRNAs认为在组间有明显差异。明显差异的circRNAs绘制成散点图,并利用Arraystar基于TargetScan和miRanda数据库独立开发的微小RNA(miRNA)靶向结合位点预测软件预测circRNAs可能吸附的miRNA。针对miRNA对应的靶基因做GO与KEGG分析,查看富集的生物学过程。
2 结果
2.1 RNA的质量试验组和对照组对应样本的光密度比值(D260/D280)均大于1.8,在2.0左右(1.8~2.1)(见表1)。琼脂糖凝胶电泳结果显示,两组各样本RNA的5 S、18 S和28 S电泳条带清晰,可进一步进行circRNAs芯片检测(见图1)。
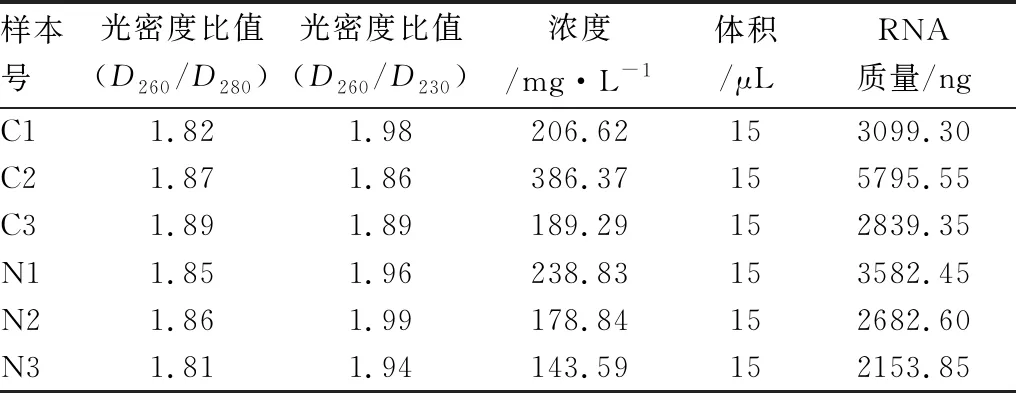
表1 试验组和对照组总RNA浓度和质量

图1 总RNA凝胶电泳图 C1~C3为试验组,N1~N3为对照组
2.2 差异表达circRNAs的散点图利用生物信息学工具,将试验组和对照组分析获得的差异circRNAs绘制成散点图(见图2)。结果显示,与对照组比较,试验组外周血中异常表达的circRNAs共有242个(fold change绝对值≥2.0),其中上调的有100个(fold change≥2.0),差异倍数>3的有9个;下调的有142个 (fold change≤-2.0),差异倍数>3的有13个(见表2与表3)。

图2 差异circRNAs表达谱图上方(fold change≥2.0)示上调的circRNAs,下方(fold change ≤-2.0)示下调的circRNAs
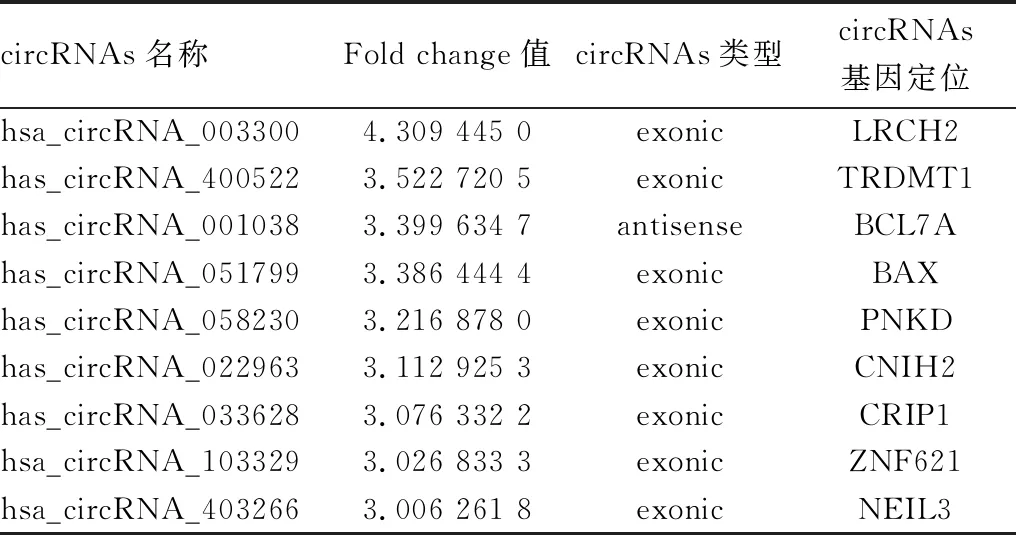
表2 试验组相对于对照组表达上调的circRNAs
2.3 差异表达的circRNAs与miRNA结合位点预测利用在线数据库TargetScan和miRanda预测每个差异circRNAs的5个miRNA结合位点,发现hsa_circRNA_100049与白内障晶状体上皮细胞凋亡相关miR-15a-3p 有结合位点;hsa_circRNA_102534、hsa_circRNA_101911和hsa_circRNA_101892与白内障晶状体衰老相关miR-34a-5p有结合位点,具有miRNA海绵作用(见表4)。
2.4 差异circRNAs的功能分析对筛选出的差异circRNAs所涉及的基因进行GO和KEGG分析。GO分析发现,差异表达在调节细胞代谢过程、发育及RNA转录等方面有功能富集表现(见图3A、3B)。同时,KEGG分析显示,差异circRNAs下游主要涉及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、肿瘤坏死因子(tumor necrosis factor,TNF)、磷脂酰肌醇3-激酶(phosphatidylinositol-3-kinases,PI3K)/蛋白质丝氨酸苏氨酸激酶(protein-serine-threonine kinase,Akt)等信号通路(见图3C、3D)。
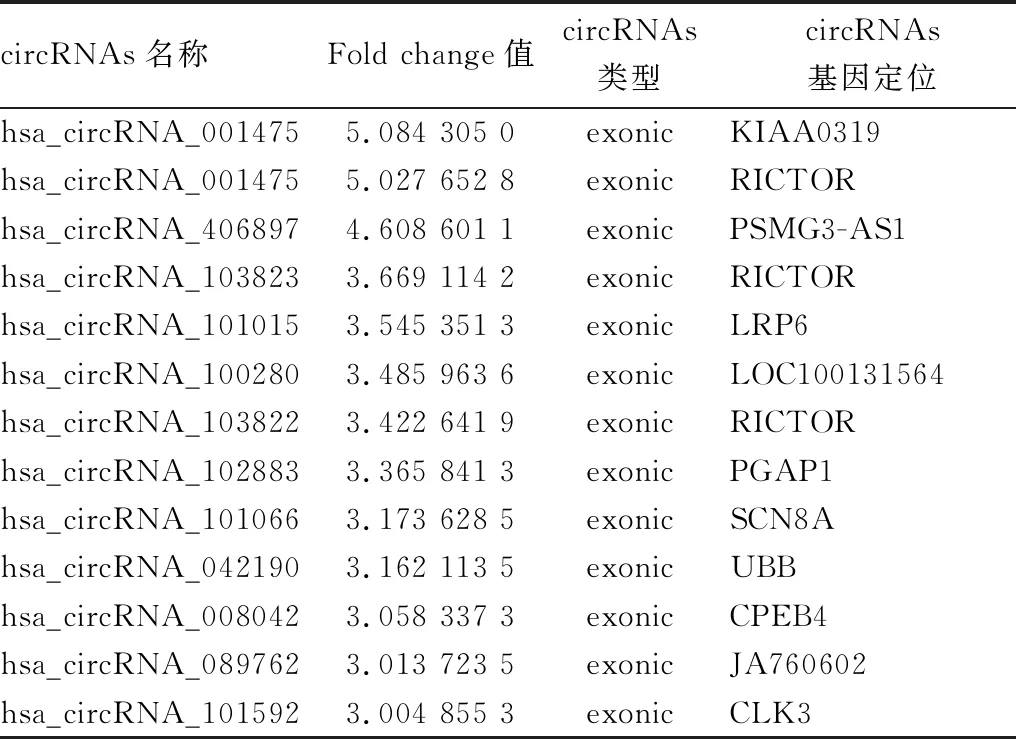
表3 试验组相对于对照组表达下调的circRNAs

表4 差异表达的circRNAs与下游靶向吸附 miRNA的预测结果
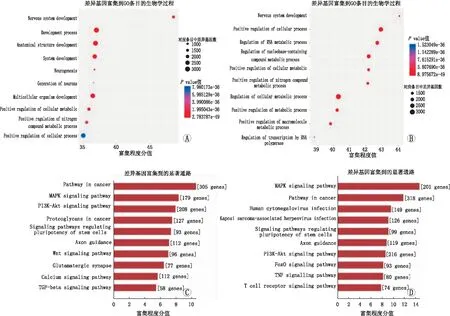
图3 上调与下调差异circRNAs的GO富集分析及KEGG富集分析A:上调差异circRNAs的GO富集分析;B:下调差异circRNAs的GO富集分析;C:上调差异circRNAs的KEGG富集分析;D:下调差异circRNAs的KEGG富集分析
3 讨论
circRNAs首次在植物病毒中被发现,然后大量的研究证实circRNAs也存在于人体组织细胞内。随着人们对circRNAs的结构和功能的深入研究,发现circRNAs序列表达具有进化保守性、组织及发育阶段的特异性[12],且可通过多种方式参与蛋白质的翻译,调控基因表达与线性RNA的生成,如竞争内源RNA能结合miRNA调节miRNA的表达水平;海绵作用吸附miRNA能解除miRNA对一些mRNA的去阻遏[13];同时,circRNAs还可以通过与其他蛋白或因子相互结合形成复合物发挥调控作用[14]。另外,近年来大量研究证实,circRNAs在人类多种疾病如糖尿病[15]、动脉粥样硬化[10]等的发展进程中发挥重要作用。Lukiw等[11]发现,ciRS-7在阿尔茨海默病患者的海马区表达下调,导致ciRS-7的海绵效应缺失,下游的miR-7表达上调及其靶mRNA的表达变化影响了该疾病的进展。同时,Jeck等[16]揭示circMbl与肌强直性营养不良的发生发展密切相关;Burd等[17]证实动脉硬化性疾病与circRNA ANRIL的表达存在密切相关性;Li等[18]发现 Cir-ITCH可通过吸附miR-7、miR-17、miR-124从而上调ITCH抑制Wnt信号通路,在食管鳞状细胞癌中发挥抑癌作用;在结直肠癌中存在circRNAs的表达与细胞增殖呈负相关。进一步研究揭示,结肠癌患者与健康人群的血清外泌体中存在circRNAs的表达差异,可作为结肠癌的血清标志物等[19]。由此可见,circRNAs可能成为未来多种疾病诊断的新型标志物或治疗靶点。
然而,目前circRNAs在老年性白内障患者外周血中的表达研究尚处于空白。因此,本研究首先运用circRNAs芯片技术检测老年性白内障和健康体检者外周血circRNAs的表达谱。结果显示,白内障患者外周血中存在差异表达的circRNAs共有242个,其中上调的100个,差异倍数>3的9个;下调的142个,差异倍数>3的13个,这提示circRNAs可能与老年性白内障的发生发展具有一定的相关性。进一步运用生物信息学分析发现,差异circRNAs表达主要参与调节细胞代谢过程、发育及RNA转录等过程。与此同时,利用在线数据库预测了circRNAs的5个靶向 miRNA结合位点,并查阅相关文献,发现miR-34a-5p与白内障晶状体衰老相关,miR-15a-3p与白内障晶状体上皮细胞凋亡相关,而hsa_circRNA_100049、hsa_circRNA_102534、hsa_circRNA_101911以及hsa_circRNA_101892与这些miRNA存在结合位点,据此推测,这些circRNAs可能通过靶向吸附miR-34a-5p、miR-15a-3p调控老年性白内障的发生和发展。以上研究结果将在后期的临床标本及细胞水平的实验中进行验证,以期为老年性白内障的早期预测、诊断和治疗提供更多数据基础。
总之,上述circRNAs在老年性白内障中的表达差异揭示了circRNAs可能与老年性白内障的发病具有密切相关性。差异表达的circRNAs有待进一步在大样本中得到验证,相关的分子作用机制需深入探究。以上研究结果为进一步探究老年性白内障的发生发展提供了试验基础,为未来circRNA应用于老年性白内障临床早期预测、诊断和靶向治疗的研究提供了理论依据。另外,老年性白内障的发病存在复杂的分子调控机制,我们后期将重点研究差异circRNAs表达与miRNA相关的蛋白质或基因表达调控网络。最后,由于该研究仅做了1次3组混样的芯片检测,数据较少,但有文献研究表明,混样实验结果对于疾病研究具有一定的价值,能够减少单一样品对于整组样品造成的数据偏差风险,且更加突出所有样本的共有数据[20]。

