外源性硫化氢调节视神经萎缩相关蛋白1(OPA1)表达对视网膜缺血-再灌注损伤的保护作用△
白雪 罗艳 刘太祥 罗鑫
视网膜缺血-再灌注损伤(retinal ischemia-reperfusion injury,RIRI)是临床常见眼病,与神经元的丢失、视网膜形态变异、视网膜功能丧失等有关,且最终可导致视力丧失[1]。有证据表明,RIRI在急性青光眼、糖尿病视网膜病变等多种眼部疾病的病理过程中发挥重要作用,常因缺乏有效的治疗方法而造成视力损害和失明[2-4]。线粒体是调控细胞凋亡的核心细胞器,其能够分裂、破碎及激活细胞凋亡[5-6]。其中视神经萎缩相关蛋白1(optic atrophy 1,OPA1)是调控线粒体分裂和融合的关键分子[7]。OPA1位于线粒体内膜间隙、附着于线粒体嵴并参与嵴形态的调控[8]。有研究显示,直接下调OPA1或OPA1从线粒体内膜间隙丢失会导致线粒体嵴破坏、线粒体破碎,使线粒体外膜去极化并引起CytC释放、减少细胞呼吸,最终导致细胞凋亡[9-10]。硫化氢(H2S)被揭示是一种新型的生物分子,除了一氧化氮和一氧化碳外,也可作为一种内源性气体递质[11-13]。最近一项研究表明,H2S 快速预处理可介导抗凋亡作用,从而保护大鼠视网膜免受RIRI[14]。H2S对细胞的保护作用及抑制线粒体CytC释放与氧化应激相关,但是 H2S保护线粒体的结构与功能以及抑制CytC的释放是否与调控OPA1的分布和表达有关尚无明确定论。因此,本实验拟通过建立大鼠急性高眼压模型,探讨外源性H2S通过调控OPA1表达与分布对大鼠RIRI的保护作用。
1 材料与方法
1.1 实验动物、试剂及仪器52只健康无眼疾的10周龄SD雄性大鼠,体质量300~350 g,SPF级,长沙市天勤生物技术有限公司提供[SCXK(湘)2014-0011]。SD大鼠统一由室温 20~25 ℃、相对湿度 50%~65%、满足光照要求的遵义医科大学SPF 级动物中心喂养。实验动物的使用均遵循实验动物医学伦理条例及国家实验动物管理保护条例。一抗:OPA1(兔来源,美国Abcam公司);二抗:羊抗兔IgG(美国Sigma公司);内参一抗:GAPDH、COX IV(美国Abcam公司);硫氢化钠(NaHS,美国Sigma公司);TUNEL试剂盒(瑞士Roche公司)。显微手术器械(美国Alcon 公司),切片机(RM2235)(德国Leica公司),透射电镜H-7650(日本Hitachi公司),实时荧光定量PCR(qPCR)仪(加拿大Funglyn Biotech公司)。
1.2 动物模型的建立参照文献[15-16],用前房加压法制作大鼠急性高眼压模型。将SD雄性大鼠称体质量后,将100 g·L-1水合氯醛按照3 mL·kg-1体质量腹腔内注射麻醉。随机取每只大鼠任意一眼造模,用4号半头皮针(连接有500 mL生理盐水输液瓶)沿大鼠颞侧的角巩膜缘穿刺入前房。输液瓶高度与实验眼的垂直距离为176.6 cm,此时眼压为120 mmHg(1 kPa=7.5 mmHg),可以看见球结膜、虹膜迅速变白,瞳孔区橘红色反光转为苍白,视网膜苍白,说明已将视网膜中央动脉的供血完全阻断。高眼压状态持续1 h后,缓慢将输液瓶高度降低至眼球水平,眼压也同时逐渐降低,拔出针头,球结膜和虹膜颜色快速恢复正常,可见暗红色瞳孔区的反光,眼底镜检查见视网膜呈现橘红色,受阻的血管得以重新开放,提示大鼠RIRI模型造模成功。术毕实验眼结膜囊涂妥布霉素眼膏。
1.3 实验动物分组及NaHS干预用数字表法将所有大鼠随机分为对照组(4只)、RIRI组(24只)及NaHS干预组(24只)。后两组再各自分为造模后 1 h、6 h、12 h、24 h、48 h、72 h 6个时间点(n=4)。所用NaHS剂量和给药方法根据文献[17-18]设定。NaHS干预组分别按大鼠不同体质量腹腔内注射NaHS液(50 μmol·kg-1,每次使用前均新鲜配制),连续 5 d,造模前15 min再次给药;正常对照组和RIRI组同方法同时给予生理盐水1 mL·kg-1。随机取一眼作为实验眼。
1.4 TUNEL法测定细胞凋亡分别取对照组、RIRI组和NaHS组造模后不同时间点大鼠各1只,常规方法在相应时间摘除大鼠眼球并固定,沿视神经长轴经视神经做纵切面石蜡切片。视网膜切片常规脱蜡水化,PBS漂洗,蛋白酶K 21~37 ℃孵育15~30 min,PBS漂洗2次后,检测样本和阳性对照样本,加入适量凋亡反应混合物(50 μL);阴性对照样本加入标记溶液,37 ℃湿盒避光孵育60 min,PBS漂洗3次,DAPI染核,PBS漂洗,封片荧光显微镜观察,激发波长450~500 nm(488 nm)。每个视网膜切片选取10个视野进行细胞凋亡计数分析。
1.5 qPCR检测视网膜中OPA1 mRNA表达分别取各组大鼠,每组及相应时间点各1只。RNAiso Plus提取各组大鼠视网膜总RNA,经纯度鉴定和浓度测定后取1 μg总RNA,两步法RT反应合成cDNA(30 ℃ 10 min,42 ℃ 60 min,85 ℃ 10 min)。按说明书进行qPCR(20 μL体系:95 ℃ 2 min,95 ℃ 15 s,60 ℃ 32 s,共40个循环)。以β-actin为内参,以2-△△Ct计算目的基因相对表达量。每个标本设置3管重复,取3次的平均值计算各组大鼠视网膜中OPA1 mRNA的相对表达。
1.6 Western blot检测各组大鼠视网膜中细胞质以及线粒体中OPA1、CytC蛋白的表达摘取各组相应时间点大鼠眼球各1只,完整分离视网膜组织,匀浆后离心,沉淀为细胞线粒体,再次离心上清液后取出,即为去除线粒体的细胞质蛋白。分别进行SDS-PAGE蛋白电泳;转膜,漂洗,封闭,漂洗,孵育,漂洗。电化学发光法显色发光、胶片曝光。应用图像分析软件Image J对蛋白条带进行灰度值分析,分别以GAPDH、COX IV为内参,分别计算各组大鼠视网膜细胞的线粒体和细胞质中OPA1、CytC蛋白与内参的灰度比值。
1.7 透射电镜观察线粒体形态分别取对照组及RIRI组和NaHS干预组各时间点大鼠各1只,深度麻醉,经左心室快速灌注 4 ℃ 预冷的生理盐水,随即灌入体积分数2.5%戊二醛快速滴注至大鼠四肢抽搐,待抽搐停止后,缓慢滴注20 min后取视网膜组织块,置于体积分数2.5%戊二醛中固定2 h,漂洗,10 g·L-1锇酸4 ℃固定2 h,脱水,浸透,包埋,聚合,超薄切片厚60 nm,染色,透射电镜下观察、拍照。每例标本检测10个视野。
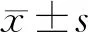
2 结果
2.1 TUNEL法检测细胞凋亡结果与对照组相比,NaHS干预组造模后1 h细胞凋亡未见明显增多,荧光无明显增强,RIRI组各个时间点、NaHS干预组余时间点细胞凋亡增多,荧光明显增强,NaHS干预组细胞凋亡趋势同RIRI组,但各个时间点凋亡指数均较RIRI组显著降低,差异均有统计学意义(均为P<0.05)(见表1)。
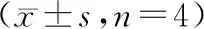
表1 各组造模后不同时间点视网膜细胞凋亡指数
2.2 qPCR检测视网膜中OPA1 mRNA表达NaHS干预组和RIRI组各个时间点OPA1 mRNA表达均较对照组有所下降,差异均有统计学意义(均为P<0.05)。与RIRI组同一时间点比较,NaHS干预组除造模后1 h时OPA1 mRNA 表达低于RIRI组外,余时间点OPA1 mRNA表达均高于RIRI组,差异均有统计学意义(均为P<0.05)(见表2)。
2.3 OPA1和CytC的蛋白表达量RIRI组各个时间点线粒体内OPA1和CytC的蛋白表达与对照组相比,呈逐渐下降的趋势,差异均有统计学意义(均为P<0.05);NaHS干预组各个时间点线粒体内OPA1和CytC的蛋白表达与对照组相比,呈现造模后1 h大幅度降低,随后缓慢回升的趋势,其差异均有统计学意义(均为P<0.05);NaHS干预组与RIRI组同一时间点比较,从造模后24 h开始NaHS干预组OPA1和CytC蛋白表达均高于RIRI组,除造模后12 h差异均无统计学意义外(P=0.091、0.074),其余各个时间点的差异均有统计学意义(均为P<0.05)。在细胞质内,两组各个时间点和对照组相比,均呈逐渐增加的趋势,差异均有统计学意义(均为P<0.05)。与RIRI组同一时间点对比,NaHS干预组OPA1和CytC蛋白表达均较低,差异均有统计学意义(均为P<0.05)(见图1和图2)。
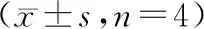
表2 造模后不同时间点各组大鼠视网膜中OPA1 mRNA 相对表达量
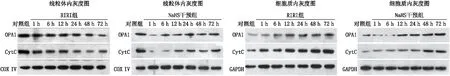
图1 OPA1和CytC蛋白在线粒体和胞质内表达灰度图

图2 OPA1和CytC蛋白在线粒体和细胞质内相对表达量 注:与对照组比较,*P<0.05;与RIRI组同一时间点比较,#P<0.05
2.4 透射电镜观察线粒体形态与对照组(线粒体嵴清晰)比较,RIRI组随时间延长线粒体损伤加重,线粒体肿胀,可见细胞质空泡及自噬小体(造模后24 h最为明显);NaHS干预组随时间延长线粒体损伤加重,线粒体肿胀,可见细胞质空泡及自噬小体;NaHS干预组与RIRI组比较,各时间点线粒体损伤减轻(见图3至图5)。

图3 对照组线粒体嵴形态(×40 000) 红色箭头表示线粒体
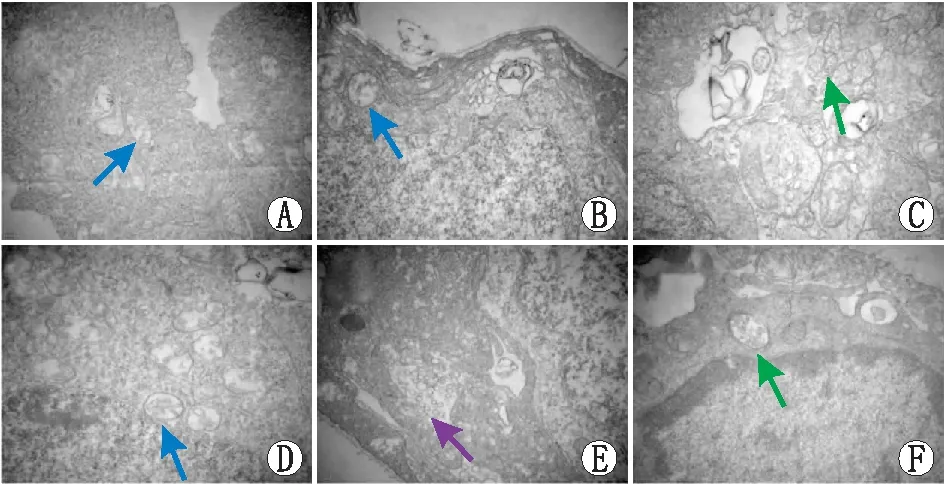
图4 RIRI组各时间点线粒体损伤情况(×40 000) A:RIRI组造模后1 h:大量由线粒体和(或)内质网肿胀形成的细胞质空泡;B:RIRI组造模后6 h:线粒体嵴消失,成空泡;C:RIRI组造模后12 h:细胞质空泡化明显,自噬小体形成; D:RIRI组造模后24 h:大量由线粒体和(或)内质网肿胀形成的细胞质空泡; E:RIRI组造模后48 h:吞噬泡形成,线粒体渐近性肿胀;F:RIRI组造模后72 h:自噬小体形成。蓝色箭头表示细胞质空泡,绿色箭头表示自噬小体,紫色箭头表示吞噬泡

图5 NaHS干预组各时间点线粒体损伤(×40 000) A:NaHS组干预1 h后:线粒体轻肿胀,结构尚完整 ;B:NaHS组干预6 h后:线粒体渐进性肿胀,线粒体嵴出现扩张;C:NaHS组干预12 h后:线粒体渐进性肿胀,线粒体嵴出现扩张; D:NaHS组干预24 h后:线粒体嵴模糊、扩张; E:NaHS组干预48 h后:自噬体形成;F:NaHS组干预72 h后:线粒体和(或)内质网肿胀形成的细胞质空泡。红色箭头表示线粒体,蓝色箭头表示细胞质空泡,绿色箭头表示自噬小体
3 讨论
RIRI是指当视网膜组织缺血、缺氧,而恢复血液供氧后,反而加重视网膜的损伤,是一种公认的视网膜血管阻塞性疾病[19]。RIRI的形成机制仍不明确,可能与线粒体功能障碍、视网膜缺血、氧化应激、神经胶质细胞活化等有关[20-25],RIRI可能通过诱导细胞凋亡或坏死而最终导致神经元死亡[26]。H2S 在神经元细胞、微胶质细胞和星形胶质细胞的病理生理过程的调节中发挥重要作用[27-29],给予NaHS(H2S供体)干预后,可能通过抑制氧化应激、炎症反应等途径改善线粒体功能,从而进一步改善神经退行性病变[30-31]。有实验研究结果表明,RIRI前通过H2S预处理可经过抗凋亡反应触发神经元保护作用[14]。而本实验结果也显示在RIRI组中视网膜细胞凋亡随时间变化逐渐增多,同时经过NaHS的预处理,在NaHS干预组中细胞凋亡与RIRI组比较均明显降低,说明外源性的H2S可以改善视网膜神经细胞凋亡,提高细胞的存活能力,这与以往的研究结果相符合[32]。但H2S是通过什么途径保护视网膜神经细胞的凋亡目前仍不得而知。
线粒体释放CytC是细胞凋亡发生的关键,而与其有重要关系的一类蛋白被称为线粒体塑形蛋白家族,该家族的重要成员之一是OPA1,其位于线粒体的内膜及膜间隙,介导线粒体融合,是控制CytC释放的重要环节。OPA1在细胞中表达增加,其可以通过稳定线粒体嵴、阻止CytC释放而减轻细胞凋亡[33]。本研究结果显示,OPA1在RIRI组表达逐渐降低,经过NaHS预处理后可增加OPA1表达。而在Western blot测定OPA1及CytC的蛋白表达时,我们同样也发现随着时间的延长,与RIRI组比较,NaHS干预组线粒体内OPA1及CytC蛋白表达是逐渐增加的,而在细胞质内,NaHS干预组与RIRI组同一时间点比较,OPA1及CytC蛋白表达是降低的,远不如RIRI组增加明显,同时这些研究结果也说明,NaHS预处理后可以增加RIRI后总的OPA1表达水平以及线粒体内OPA1和CytC的表达,减少视网膜的细胞凋亡,从而保护视网膜的神经损伤。
线粒体是调控细胞凋亡的核心细胞器,线粒体分裂、破碎激活细胞凋亡[6-7]。本课题组前期体外实验也提示NaHS预处理后线粒体的肿胀明显减轻[34]。本研究从透射电镜观察线粒体形态发现,各个时间点比较,RIRI组随时间延长线粒体肿胀明显、线粒体破裂,在造模后24 h最为严重,加入NaHS以后前24 h线粒体肿胀仍明显,然后随时间延长损伤减轻,但任何时间点都比RIRI组的损伤轻。说明H2S对RIRI引起的视网膜神经细胞线粒体损伤有保护作用。
本实验结果表明,在NaHS的干预下,RIRI后细胞内OPA1表达增加、OPA1在线粒体内外分布与对照组接近,使线粒体的损伤减轻,细胞凋亡减少,从而减轻了视网膜的神经损伤。但是,在本实验中也发现,NaHS干预后早期可以减少细胞凋亡,而OPA1表达却下降(尤其是造模后1 h),考虑可能为造模后早期外源性H2S抑制细胞凋亡并非通过调节OPA1的表达与分布,而是通过另外的途径发挥作用;同时造模后早期细胞内H2S浓度较高,可能抑制了线粒体呼吸作用,产生细胞毒性[35],从而可能影响了OPA1在线粒体内外的分布和表达。
综上所述,本研究结果显示,H2S可能通过调控OPA1的表达与分布抑制RIRI,且发挥保护作用的时间是在造模后24 h。本研究结果为H2S的视网膜细胞保护作用提供了新的实验依据,为H2S的药物剂型及给药时间提供了一定的参考,具有重要的理论意义和临床实用价值。
致谢:感谢贵州细胞工程重点实验室,贵州麻醉与器官保护研究中心和遵义医科大学实验动物中心的支持和帮助!

