Shh在糖尿病肾病患者肾组织中的表达及对肾小管上皮细胞凋亡的影响
戴黎 周祖莲 姜安雅
(重庆市黔江中心医院肾内科,重庆 409000)
糖尿病肾病早期发病无任何症状,且病程进展较慢。引发糖尿病肾病的主要因素与微血管发生病变、糖代谢紊乱及生长因子失衡相关,从而造成糖尿病合并肾小球硬化的发生〔1,2〕。研究糖尿病肾病的发病机制是目前研究的热点。音猥因子(Shh)参与多种组织器官的发育,广泛存在于哺乳动物体内〔3〕。研究发现,在糖尿病肾病中Shh基因表达可降低肾小管上皮细胞凋亡,Shh可直接参与细胞分化,起到了调控和降低诱导细胞凋亡的作用〔4〕。Shh基因表达在糖尿病肾病组织中经RNA干扰后可起到降低基因表法的作用。本研究拟探讨糖尿病肾病患者肾组织中Shh的表达水平及其对肾小管上皮细胞凋亡的影响。
1 材料与方法
1.1材料 2016年5月至2018年10月经肾活检确诊为2型糖尿病肾病的患者28例为对照组,其中男15例,女13例,年龄32~68岁,平均(54.2±5.4)岁;纳入并提取的肾组织标本均符合世界卫生组织的诊断标准。同期纳入已行肾癌切除的患者15例为实验组,其中男10例,女5例,年龄47~81岁,平均(55.3±2.6)岁;同期病理诊断确诊为无肾癌表达者16例为正常组,男7例,女9例,年龄47~63岁,平均(50±2.7)岁。人肾小管上皮细胞HK-2 ATCC均购自上海名劲生物科技有限公司。
1.2主要仪器及试剂 采用Proteintech公司的辣根过氧化物酶(HRP)标记抗体、甘油醛-3-磷酸脱氢酶(GAPDH)、c-Jun氨基末端激酶(JNK)、磷酸化(p)-JNK、兔抗人单克隆抗体B淋巴细胞瘤(Bcl)-2、Bcl-2相关X蛋白(Bax)等标记物;上样缓冲液、蛋白抽提试剂、聚偏氟乙烯(PVDF)膜、lipofectamine2000均购自美国Milipore公司;Annexin-V细胞凋亡检测试剂盒与碘化丙锭(PI)均采用上海翊圣生物科技有限公司;采用Sigma公司提供的胰蛋白酶、胎牛血清及DMEM培养基;流式细胞仪与CO2培养箱均由THermo公司提供。
1.3Western 印迹检测组织中Shh表达水平 将采集后的组织使用医用剪,剪碎加入苯甲基磺酰氟化物(PMSF)进行预冷并提取蛋白试剂(每250 mg组织中加入1 ml),摇匀后取裂解液,4℃ r/min离心20 min,蛋白上清液转移至EP管中,蛋白浓度采用二喹啉甲酸(BCA)检测试剂盒进行提取检测,蛋白样品根据3∶1比例进行混合,放入煮沸水中变性后加入到十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)中进行电压电泳分析蛋白表达。
1.4细胞培养 将冷冻的肾小管上皮细胞取出进行融化,放置离心管中并加入5.8 mmol/L葡萄糖进行培养,1 000 r/min离心10 min后加入10%胎牛血清培养低糖细胞,培养结束放入37℃培养箱中;当细胞融合度达到90%时弃细胞液,并加入0.25%胰蛋白酶进行离心。细胞转染:取肾小管上皮细胞,以每孔2×105接种到细胞培养板中培养过夜,将Shh空核表达载体与不含血清的培养基混合静置5 min,将脂质体2000转染试剂与不含血清培养基混合,两种液体加入细胞中培养6 h,更换为低糖血清进行培养,转染后48 h,检测细胞中Shh表达水平。
1.5流式细胞术检测细胞凋亡 培养至48 h取出,消化后,1 000 r/min,离心10 min,弃酶消化液加入细胞培养液,并将细胞浓度调整至106个/ml细胞以1 000 r/min离心10 min,离心结束后使用磷酸盐缓冲液(PBS)冲洗并加入结合缓冲液200 μl 重悬细胞,常温下反应30 min后采用流式细胞仪检测细胞凋亡。
1.6JNK抑制剂对肾小管上皮细胞凋亡的检查 JNK信号通路抑制剂SP600125,剂量为20 μmol/L,应用在肾小管上皮细胞中48 h,采用流式细胞仪检测凋亡情况;取对照组和实验组肾组织细胞并培养48 h后提取细胞中Bcl-2蛋白、JNK及p-JNK,采用Western 印迹法检测,检测方法同1.3。
1.7统计学方法 采用SPSS22.0软件进行t检验、单因素方差分析。
2 结 果
2.1Shh基因在肾组织中的表达 实验组Shh表达水平(0.87±0.07)明显高于对照组和正常组(0.43±0.07、0.44±0.08,P<0.05),但正常组Shh水平与对照组比较差异无统计学意义(P>0.05)。见图1。
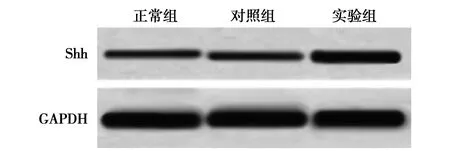
图1 Western印迹检测3组Shh表达水平
2.2细胞凋亡检测结果 实验组肾小管上皮细胞凋亡率显著高于正常组(P<0.01)。对照组Bcl-2、Bax蛋白水平显著低于实验组和正常组(P<0.01)。见表1,图2。
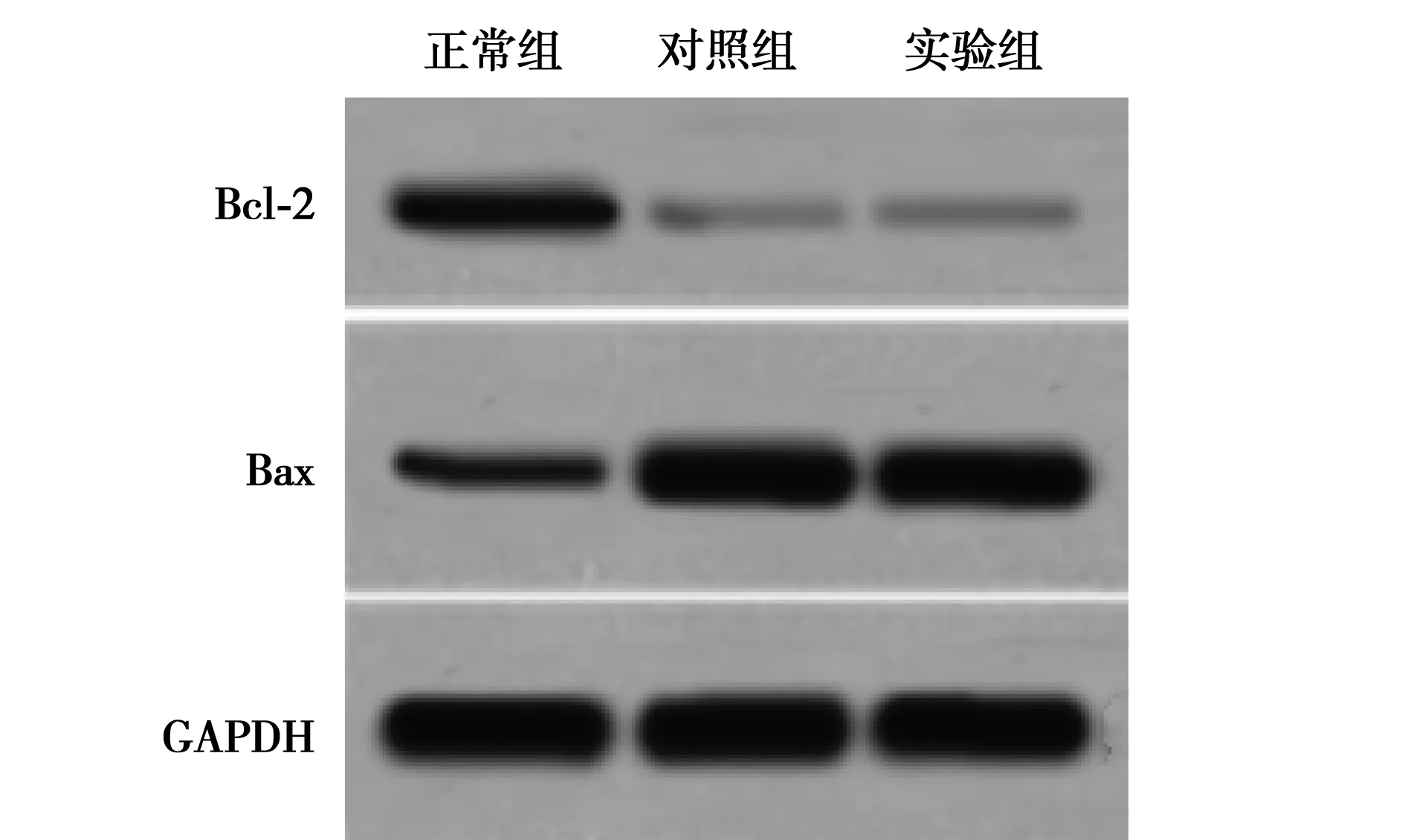
图2 Shh对肾小管上皮细胞凋亡相关蛋白的影响

表1 3组肾小管上皮细胞凋亡及相关蛋白表达比较
2.3细胞中JNK、p-JNK表达结果 细胞转染后3组肾小管上皮细胞中的JNK表达差异无统计学意义(P>0.05),但正常组和实验组p-JNK表达明显高于对照组(P<0.01)。见图3,表2。
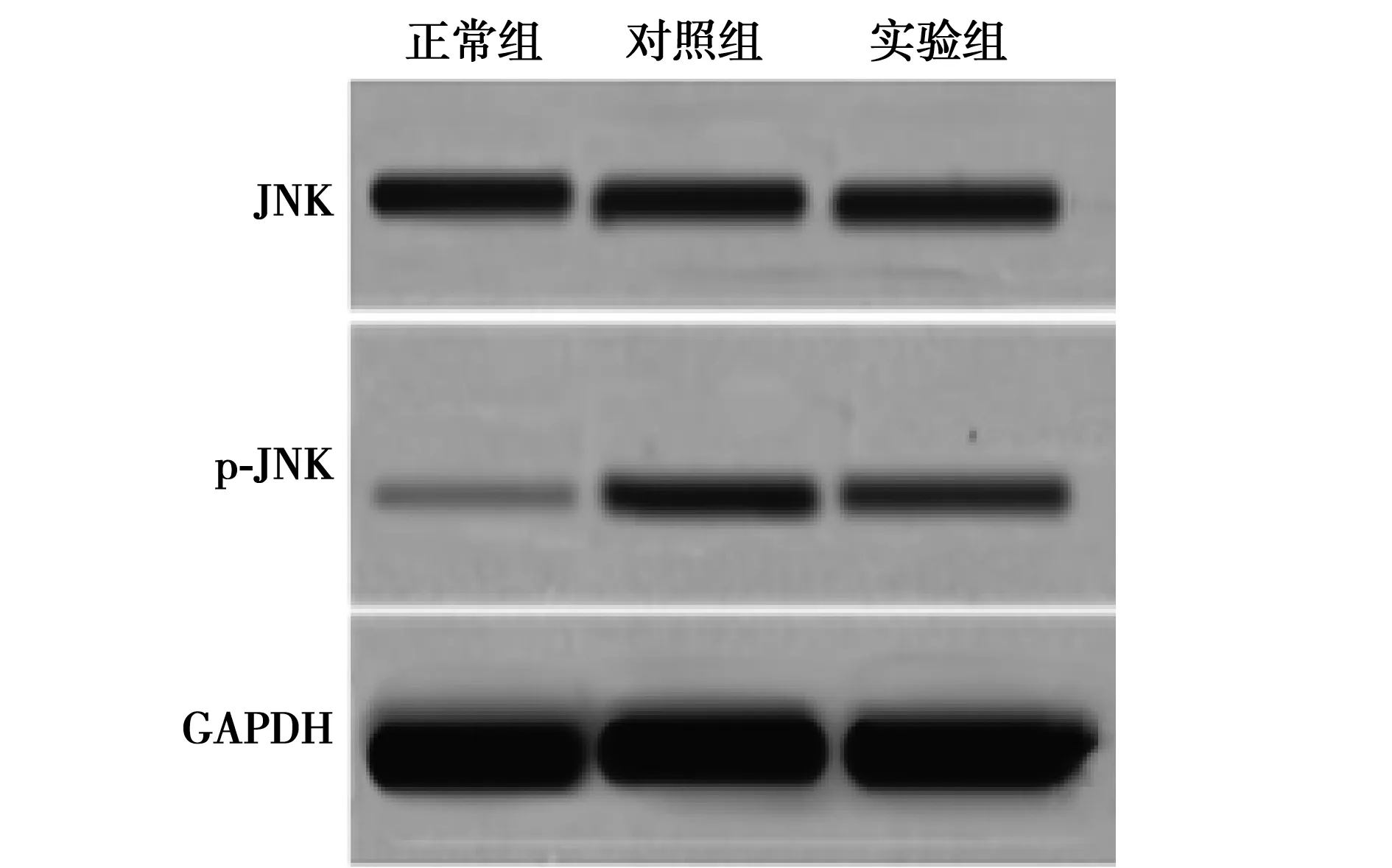
图3 Shh对肾小管上皮细胞JNK、p-JNK表达的影响

表2 3组肾小管上皮细胞JNK、p-JNK表达比较
2.4JNK抑制剂对细胞凋亡的影响 对照组与实验组肾小管上皮细胞中JNK的水平差异无统计学意义(P>0.05)。但对照组凋亡率、p-JNK明显高于实验组(均P<0.01)。见表3,图4。

表3 两组肾小管上皮细胞的凋亡情况比较
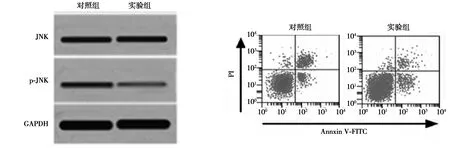
图4 肾小管上皮细胞在JNK作用细胞相关蛋白表达及凋亡的影响
3 讨 论
Shh基因最早发现于果蝇中,参与果蝇的眼、脑及翅膀的发育形成,随后研究发现,Shh基因在胚胎发育过程中发挥关键信号因子的作用〔5,6〕。人Shh基因属于染色体7q36且与背腹轴神经管的形成、消化道及头面部等发育存在密切关联。研究表明,Shh基因具备调控甲状腺畸形及肾脏等疾病,其病理过程对肿瘤形成也起到了相关调控〔7〕。Shh发生缺氧后会造成肾周围细胞转化为肌成纤维和引发肾小管上皮细胞凋亡。有研究显示,肾小管上皮细胞凋亡的主要原因与高糖因素呈正相关,而通过干扰Shh基因可有效降低高糖,从而改善肾小管上皮细胞凋亡〔8〕。
近年来,糖尿病的发病率呈逐年上升的趋势,已是全球面临的重要公共健康问题。糖代谢影响因素也成为研究的热点,各研究机构对血清尿酸和糖尿病及代谢因子的关系持有不同的意见〔9〕。近期有研究〔10〕表明糖代谢与Shh基因有一定关系,但因医疗技术的局限性,这种说法还备受争议。美国大样本研究〔11〕指出Shh基因水平与糖尿病的发生是呈负相关的,与此同时,有数据显示Shh基因的水平与胰岛素的分泌呈正相关〔12〕。糖尿病患者比正常人群具有更高的Shh基因水平低。Shh基因浓度过高与糖尿病的血管病有关,若妊娠期孕妇Shh基因水平过高,可能导致出现妊娠糖尿病。心肌细胞与肿瘤细胞等相关细胞的凋亡过程中,JNK及MAPK蛋白均参与了其中,JNK属于MAPK家族的成员之一,但JNK信号通路是否可促进细胞或抑制细胞凋亡的研究尚未有实验表明。有实验表明,高糖促进了小鼠肾小管上皮细胞凋亡,在凋亡过程中发现JNK表达明显升高〔13〕。有研究显示,高糖导致的肾小管上皮细胞凋亡采用西格列汀后可有效抑制JNK信号的表达,西格列汀属于DPP-4抑制剂是治疗2型糖尿病的主要药物,此药物安全性高且服药后患者因体重造成的不良反应率明显降低〔14,15〕。本研究表明,JNK信号通路抑制后肾小管上皮细胞凋亡明显降低,提示Shh抑制JNK信号通路可降低高糖诱导肾小管上皮细胞的凋亡。
综上,通过Shh抑制高糖对肾小管上皮细胞的诱导,其主要作用机制与JNK相关,且糖尿病肾病患者肾组织中的Shh明显下调。

