加速试验法考察人凝血酶原复合物与内包材的相容性
张安山 韩祥东 刘晓 陈桂珍 雷晨瑶 郭广兆
兰州兰生血液制品有限公司,甘肃 兰州730046
药品包装材料是指直接接触药品的包装材料和容器,主要包括各种材料制作的瓶、袋、内塞等包装容器,以及触及药品的充填物、衬垫等物质[1]。进行包装材料与药物相容性试验的目的是为了评价包装材料对药物物理稳定性和化学稳定性的影响,以评价在药物的长期贮存过程中,在不同的环境条件下(如温度、湿度、光线等),在运输和使用过程中(如与药物接触反应,对药物的吸附等),药包材与药物之间是否会发生相互的或单方面的迁移,进而影响药品质量[2,3]。
人凝血酶原复合物(human prothrombin complex,PCC)系由健康人血浆,经两步离子交换层析法分离纯化,并经有机溶剂/去污剂(solvent/detergent,S/D)处理法和80℃、72 小时干热法处理,制备获得的富含人凝血因子Ⅱ、Ⅶ、Ⅸ和Ⅹ的冻干制剂。临床上,本品主要用于治疗先天性和获得性凝血因子Ⅱ、Ⅶ、Ⅸ和Ⅹ缺乏症,血友病B、维生素K 缺乏症,因肝脏疾病导致的凝血机制紊乱,肝脏疾病导致的出血患者需要纠正凝血功能障碍等。注射剂瓶的浸出物,胶塞与药品相容性试验的结果可以提供胶塞是否引起药物主成分的迁移、吸附甚至发生化学反应,使药物失效,甚至产生严重毒副作用的信息反馈,可以确保药物的安全性、有效性和均一性。本研究主要通过加速试验进行PCC 与内包材的相容性研究,以评价药品与直接包装材料,即内包材,包括注射剂瓶和胶塞的相互作用是否对药品的质量产生影响。
1 材料与方法
1.1 材料 PCC 由兰州兰生血液制品有限公司研制,规格:300IU/15mL/瓶。包装容器:中硼硅玻璃模制注射剂瓶(以下称“注射剂瓶”),购自山东省药用玻璃股份有限公司,规格50mL,批号A、B、C;冷冻干燥用溴化丁基橡胶瓶塞(以下称“胶塞”),购自APTAR STELMI SAS公司,规格20mm,批号a、b、c。原子吸收分光光度计,SHIMADZU,型号:AA-6800。气相色谱仪,Agilent 公司。紫外分光光度计,日本岛津。pH 标准液(4.01、7.00、9.21)和pH 计,梅特勒-托利多。ACL-7000 全自动凝血分析仪及其配套试剂,Pacific 公司)。
1.2 试验方法 根据《原料药物与制剂稳定性试验指导原则》[4]《药品包装材料与药物相容性实验指导原则》[5]和《化学药品注射剂与药用玻璃包装容器相容性研究技术指导原则》[6]的要求,开展了包装系统相容性试验,对相关金属元素、有机物等相关迁移物和产品质量进行检定分析,考察包装系统对PCC 产品质量的影响。通过加速试验进行PCC 与内包材的相容性研究,所有样品均采用与拟上市产品相同的内包装材料进行包装。3 批注射剂瓶(批号A、B、C)和胶塞(批号a、b、c)对应一批产品,即批号分别为201901-A-a、201901-Bb、201901-C-c,在温度(25±2)℃条件下放置6 个月,在试验期间,于第3 个月、6 个月末分别取样一次,按加速稳定性重点考察项目进行检测,并与0月结果进行比较。
1.3 检测方法
1.3.1 金属离子、有机物等相关迁移物。根据厂家提供的注射剂瓶配方和生产工艺,注射剂瓶的浸出物主要为铝、砷、铅、锑、镉、锌、钡有毒重金属离子。胶塞中可能浸出物包括:溴化物、硅油、十六烷酸、十八烷酸、邻苯二甲酸二异丁酯、邻苯二甲酸二异辛酯、邻苯二甲酸二丁酯、2,6-二叔丁基甲苯酚、铝等。以上金属离子(砷、锑、铅、镉、铝、锌、钡)和有机物(十六烷酸、十八烷酸、邻苯二甲酸二异丁酯、邻苯二甲酸二异辛酯、邻苯二甲酸二丁酯、2,6-二叔丁基甲苯酚、溴化物、硅油)等相关迁移物,主要采用电感耦合等离子体质谱仪和气相色谱仪进行检测。
1.3.2 其他指标。注射剂瓶和胶塞浸出的物质释放的物质可能影响药品pH、渗透压,可能产生微粒或脱片,包装系统形变以及外观变化。基于风险评估结果,主要对PCC 的关键生化指标,包括效价、外观、水分、真空度、pH、渗透压、钠离子、可见异物,按照《中国药典》(2015 年版三部)[7]“人凝血酶原复合物”各通则要求进行检测。
1.4 统计学方法 采用SPSS19.0 软件对数据进行配对t检验分析,检验水准α=0.05。
2 结果
2.1 金属离子检测结果 制品在(25±2)℃条件下存放6 个月后,于第3 个月、6 个月末分别取样检测金属离子,并与0月结果进行比较。结果显示:均未检出相关金属离子,质量均符合标准。见表1。
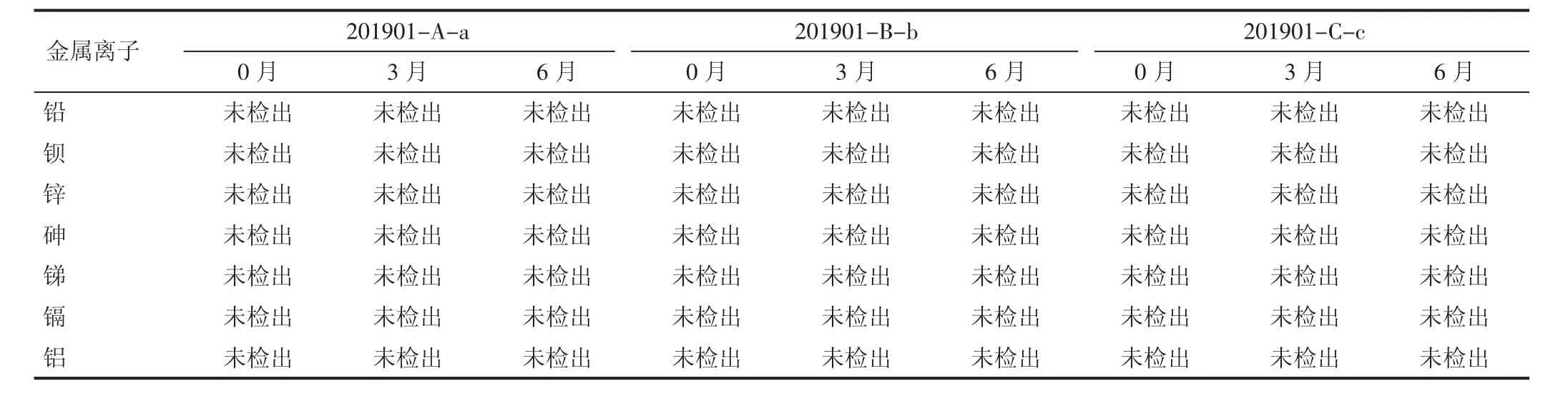
表1 不同批号金属离子检测结果
2.2 有机物检测结果 制品在(25±2)℃条件下存放6个月后,于第3 个月、6 个月末分别取样检测有机物等相关迁移物,并与0月结果进行比较。结果显示,均未检出有机物等相关迁移物,检测合格,质量均符合标准。见表2。
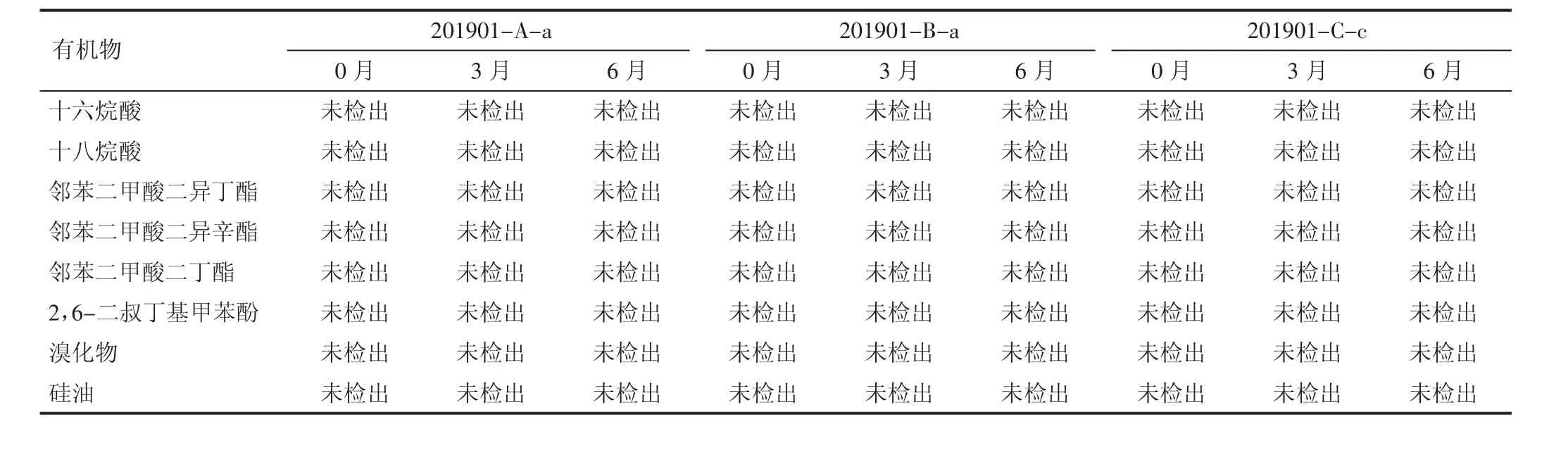
表2 不同批号有机物检测结果
2.3 生化指标检测结果 制品在(25±2)℃条件下存放6 个月后,于第3 个月、6 个月末分别取样检测水分、pH、效价、钠离子、外观、真空度、可见异物、渗透压摩尔浓度,并与0月结果进行比较。结果显示,各检测指标结果符合《中国药典》(2015 年版三部)[7]要求,检测合格,质量稳定,各指标检测结果变化无显著性差异(P>0.05)。但随着放置时间的延长,各批次水分有上升趋势。检测结果分别见表3,见图1(批号201901-A-a)、图2(201901-B-b)、图3(201901-C-c)。
3 讨论
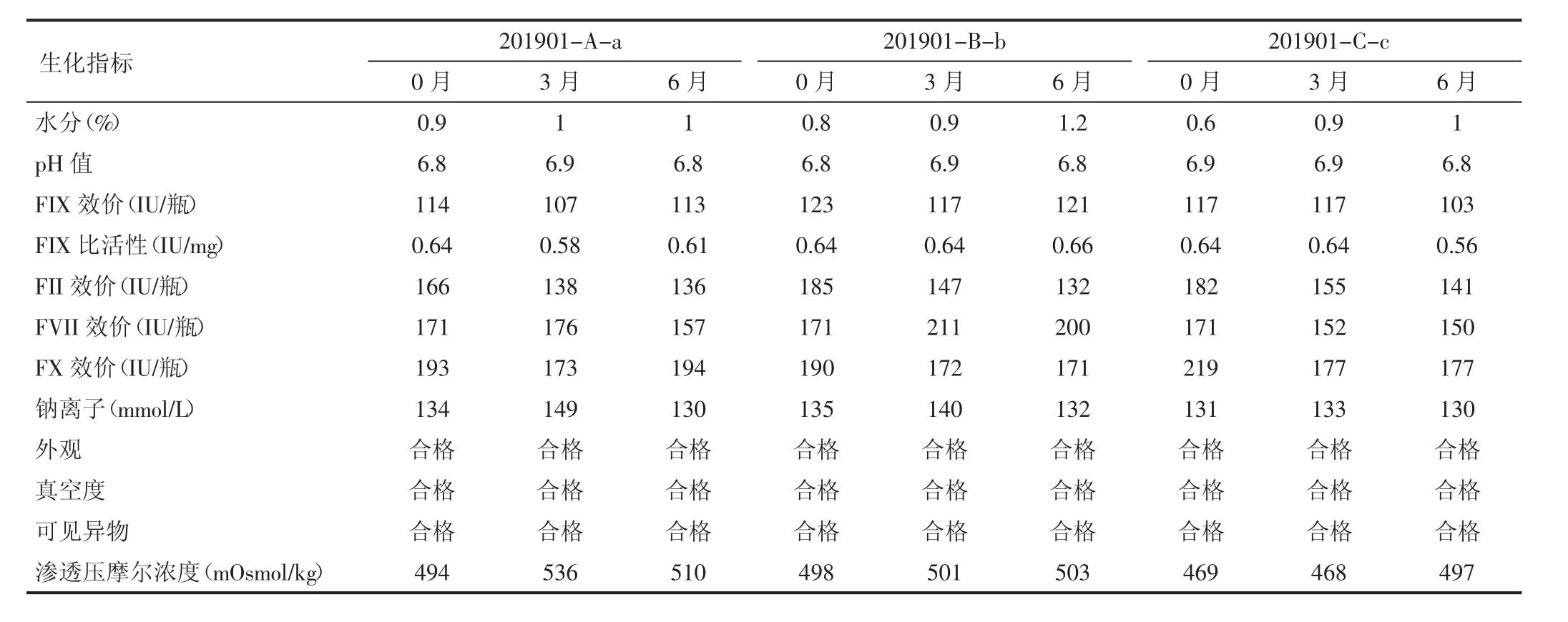
表3 不同批号生化指标检测结果

图1 批号201901-A-a 生化指标检测结果
图2 批号201901-B-b 生化指标检测结果

图3 批号201901-C-c 生化指标检测结果
玻璃容器作为注射剂、输液、口服液和外用制剂最为常用的与药品长期直接接触的包装材料,其碱性离子的释放可能导致药液pH 值的改变,蛋白质和多肽药物可能被玻璃吸收,光线可能会通过玻璃使药物分解,玻璃脱片可能会改变药物的澄明度等[8]。胶塞应该具有良好的化学稳定性、气密性、耐老化性和低析出性。胶塞成分相对比较复杂,本体内残存一些未被化学键合的反应剩余物、不参与反应的物质、热分解的产物以及硫化生成物。这些物质有可能会通过吸附、吸收、渗透和抽提等方式与药物发生相互反应,从而影响和污染药物,引起药物质量改变[2]。注射剂瓶和胶塞浸出的物质主要有金属离子和有机物等。铝离子可损害脑细胞,在人体中可蓄积,且其浓度变化可预示玻璃可能产生脱片;砷、铅、锑、镉、锌、钡为有毒的类金属离子,十六烷酸、十八烷酸、邻苯二甲酸二异丁酯、溴化物、硅油等有机物可能造成人体免疫机能下降、致癌,影响生育能力,过量十六烷酸、十八烷酸进入血液后还可引起脂血。以上金属离子和有机物进入药品溶液后会对药品本身的质量产生影响,因此需对药品进行部分指标的检测。
进行玻璃容器、胶塞与药物相容性试验的目的是为了评价内包材对药物物理稳定性和化学稳定性的影响。并提供玻璃容器、胶塞是否引起药物主成分的迁移、吸附甚至发生化学反应,使药物失效,甚至产生严重毒副作用的信息反馈,确保药物的安全性、有效性和均一性。本文相容性研究加速试验检测结果表明,PCC在(25±2)℃条件下放置6 个月后,金属离子、有机物等相关迁移物均未检出,各关键质量指标符合要求,且无显著性变化(P>0.05),说明采用目前的包装材料(注射剂瓶和胶塞),制品在(25±2)℃条件下存放6 个月,相容性良好,且对制品的质量无影响,能够保持其使用的安全性和有效性。

