‘农大4号’欧李果实花色苷对D半乳糖致衰老小鼠保护作用研究
杜灵敏,付鸿博,2,杜俊杰,王鹏飞,穆霄鹏,张建成,*
(1.山西农业大学园艺学院,山西太谷 030801;2.黑龙江省农业科学院,乡村振兴科技研究所,黑龙江哈尔滨 150000)
人体中不断产生的自由基是人体进行新陈代谢产生的代谢产物[1]。正常生理情况下,自由基处于动态平衡,维持机体健康[2],但当自由基过量积累时,则会造成各种不可逆的氧化损伤[3],表现出疾病、衰老等状态。花色苷是目前研究较多的有强抗氧化活性的一类功能因子,具有抗衰老、抗癌、抑菌、心血管保护等功能[4-9]。
欧李主要分布于我国的黑龙江、吉林、辽宁、内蒙古、山西等13个省区[10]。其果实颜色丰富,具有黄色,红色、粉红色,紫色和紫黑等多种颜色类型,花色苷色素含量较高。在对红树莓、越橘、李[11-13]等的研究中发现,花色苷对衰老小鼠有较好的保护作用,但关于欧李果实花色苷对衰老小鼠保护作用的研究较少,因此本研究选用红底红肉型的‘农大4号’欧李果实为试验材料,D-半乳糖构建氧化损伤小鼠模型,以此探究欧李果实花色苷对衰老小鼠的保护作用,旨在为欧李果实花色苷在食药方面的开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
ICR雄性小鼠60只,体重18~22 g 购自山西医科大学,动物合格证:SCXK(晋)2015-001;‘农大4号’欧李果实 采于2018年9月山西省太谷县巨鑫试验基地;总抗氧化能力(total superoxide dismutase,T-AOC)试剂盒、过氧化氢酶(catalase,CAT)试剂盒、丙二醛(malondialdehyde,MDA)试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)试剂盒 购于南京建成生物工程研究所;蛋白浓度测定试剂盒、D-半乳糖、维生素E(VE) 购于Solarbio公司;无水乙醇(分析纯)≥99% 天津市天力化学试剂有限公司。
JJ224BC型电子天平 常熟市双杰测试仪器厂;SB25-12D超声波清洗机 宁波新芝生物科技有限公司;HC-2518R高速冷冻离心机 安徽中科中佳科学仪器有限公司;RE-2000B旋转蒸发器、SHZ-III型循环水真空泵 上海亚荣生化仪器厂;Infinite F50酶标仪 Tecan Austria Gmbh。
1.2 实验方法
1.2.1 花色苷制备 参考本团队前期采用制备‘农大4号’欧李果实花色苷的方法[14]。称取一定量‘农大4号’欧李果实,液氮研磨,按照料液比1∶5 (g/mL),加入体积分数为90%(pH=2.0)乙醇溶液,超声提取10 min,超声功率800 W,于10000×g下离心30 min,提取2次,合并上清液,得到粗提液,花色苷含量为24.21 mg/100 g。粗提液蒸发浓缩后通过AB-8大孔树脂吸附至饱和后先用蒸馏水洗至流出液为中性,再用体积分数为90%乙醇洗脱,当流出液为无色时洗脱完成,收集洗脱液。洗脱液在40 ℃条件下旋转蒸发后经冷冻干燥,得到欧李‘农大4号’精制花色苷。
1.2.2 试验设计 动物实验根据抗氧化功能评价方法进行设计[15]。
1.2.2.1 分组方法 进行一周适应性饲喂后,将60只小鼠按体重随机分为6组,每组10只,分别为空白组,模型组,维生素E(VE)组,花色苷高、中、低剂量组。
1.2.2.2 氧化损伤方法 除空白组外,其余各组按照500 mg·(kg·d)-1的剂量颈部皮下注射D-半乳糖,注射体积为0.01 mL·g-1,空白组注射等量的生理盐水,注射体积为0.01 mL·g-1,连续注射30 d。
1.2.2.3 给药方法 造模同时,花色苷高、中、低剂量组按500、250、125 mg·(kg·d)-1的剂量灌胃花色苷,VE组按20 mg·(kg·d)-1剂量灌胃VE,空白组和模型组灌胃生理盐水,灌胃体积为0.01 mL·g-1,连续灌胃30 d。试验期间,所有小鼠不限制进食和饮水。
1.2.3 样品的采集 末次灌胃后,所有小鼠禁食不禁水12 h,之后摘眼球取血,断颈处死,迅速解剖取出小鼠心脏、肝脏、脾脏、肺脏及肾脏等组织,随后用预冷生理盐水制备10%的组织匀浆,4 ℃,3500 r·min-1,离心10 min取上清液。血清及组织匀浆上清液于-20 ℃保存备用[16]。
1.2.4 指标测定 记录小鼠处死前体重为m0,小鼠断颈处死后,取出心脏、肝脏、脾脏、肺脏、肾脏,洗去浮血,称重,记为m1,根据公式算出小鼠各脏器指数;按试剂盒操作测定小鼠心脏、肝脏、脾脏、肾脏以及血清的MDA、T-AOC、SOD、CAT、GSH-Px。

1.3 数据处理

2 结果与分析
2.1 ‘农大4号’欧李果实花色苷对衰老小鼠脏器指数的影响
由表1可知,与空白组相比,模型组肝脏指数、脾脏指数和肾脏指数显著低于空白组(P<0.05)。与模型组相比,高剂量组的肝脏指数、脾脏指数和肾脏指数显著高于模型组(P<0.05),VE对照组、中剂量的肝脏指数、脾脏指数和肾脏指数高于模型组,但无显著差异(P>0.05)。各组的心脏指数和肺脏指数均无显著差异(P>0.05)。说明,花色苷高剂量组对小鼠脏器有较强的保护性。

表1 欧李‘农大4号’花色苷对小鼠脏器指数的影响(n=10)
2.2 ‘农大4号’欧李果实花色苷对衰老小鼠血清及脏器中MDA含量的影响
由表2可知,与空白组相比,模型组血清及各脏器MDA含量均显著升高(P<0.05)。与模型组相比,各组小鼠的MDA含量均有不同程度的下降,其中除低剂量组的心脏、肝脏、脾脏以及中剂量组的心脏、脾脏外,其余各组脏器的MDA含量及各组血清的MDA含量与模型组相比均有显著差异(P<0.05)。高剂量组与VE对照组血清及各脏器的MDA含量均无显著差异(P>0.05)。表明,花色苷高剂量组能显著降低衰老小鼠血清及各脏器组织中MDA含量。

表2 欧李‘农大4号’花色苷对小鼠血清及脏器组织中MDA含量的影响(n=10)
2.3 ‘农大4号’欧李果实花色苷对衰老小鼠血清及脏器中T-AOC含量的影响
由表3可知,模型组血清及各脏器T-AOC含量显著低于空白组(P<0.05)。与模型组相比,VE对照组和高剂量组血清及各脏器T-AOC含量以及中剂量组的肝脏和脾脏均显著高于模型组(P<0.05)。高剂量组肝脏的T-AOC含量显著高于VE对照组(P<0.05),血清、心脏、脾脏的T-AOC含量无显著差异(P>0.05),肾脏的T-AOC含量显著低于VE对照组(P<0.05)。表明,花色苷高剂量组能显著提高衰老小鼠血清及各脏器组织中的T-AOC含量。

表3 欧李‘农大4号’花色苷对小鼠血清及脏器中T-AOC含量的影响(n=10)
2.4 ‘农大4号’欧李果实花色苷对衰老小鼠血清及脏器中SOD活性的影响
由表4可知,与空白组相比,模型组血清及各脏器SOD活性均显著降低(P<0.05)。与模型组相比,VE对照组、高剂量组的血清和各脏器以及中剂量组的脾脏、肾脏,低剂量组的脾脏的SOD活性均显著高于模型组(P<0.05)。
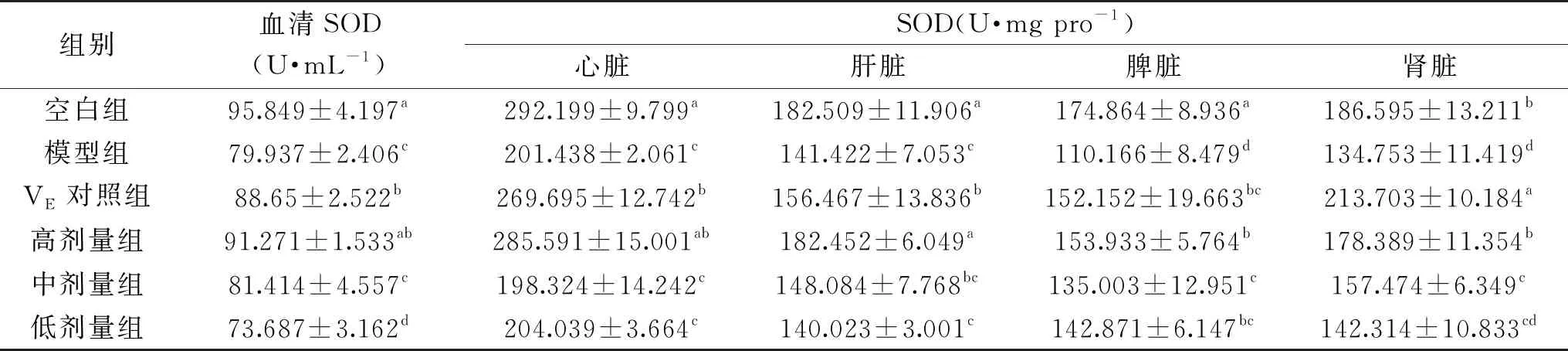
表4 欧李‘农大4号’花色苷对小鼠血清及脏器SOD活性的影响(n=10)
高剂量组肝脏的SOD活性显著高于VE对照组(P<0.05)。说明,花色苷高剂量组能显著提高衰老小鼠血清及各脏器组织中的SOD活性。
2.5 ‘农大4号’欧李果实花色苷对衰老小鼠血清及脏器中CAT活性的影响
由表5可知,与空白组相比,模型组血清及各脏器CAT活性均显著低于空白组(P<0.05)。与模型组相比,VE对照组和高剂量组血清和各脏器以及中剂量组血清、心脏、肾脏CAT活性显著高于模型组(P<0.05)。高剂量组心脏、肝脏CAT活性显著高于VE剂量组(P<0.05)。说明,花色苷高剂量组能显著提高衰老小鼠血清及各脏器组织中的CAT活性。
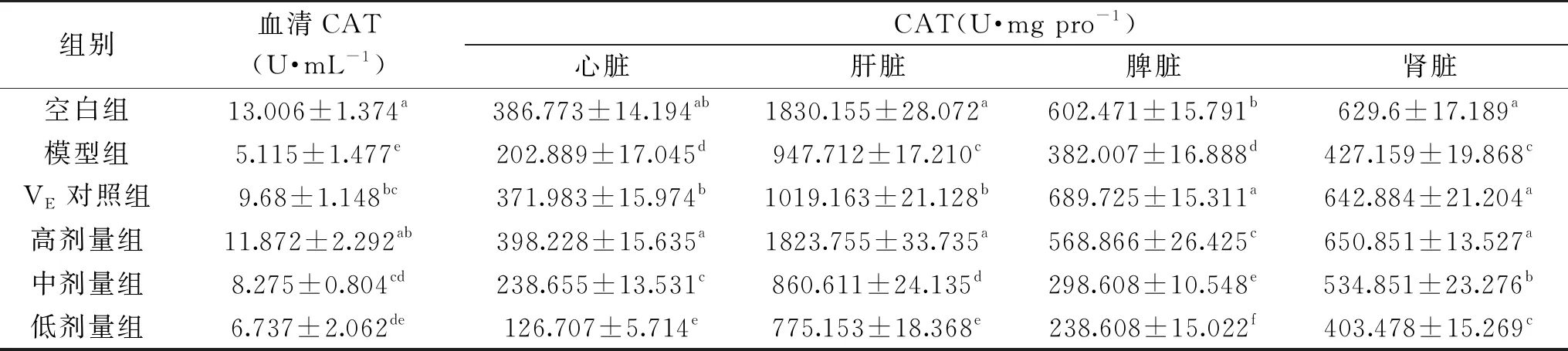
表5 欧李‘农大4号’花色苷对小鼠血清及脏器CAT活性的影响(n=10)
2.6 ‘农大4号’欧李果实花色苷对衰老小鼠血清及脏器中GSH-Px活性的影响
由表6可知,与空白组相比,模型组血清及各脏器GSH-Px活性均显著低于空白组(P<0.05)。与模型组相比,高剂量组和中剂量组血清和各脏器以及VE对照组的血清、心脏、肾脏GSH-Px活性显著高于模型组(P<0.05)。与VE对照组相比,高剂量组血清、肝脏、脾脏GSH-Px活性显著升高(P<0.05)。说明,花色苷高剂量组能显著提高衰老小鼠血清及各脏器组织中的GSH-Px活性。

表6 欧李‘农大4号’花色苷对小鼠血清及脏器GSH-Px活性的影响(n=10)
3 讨论
颈部皮下注射D-半乳糖是建造氧化损伤模型的经典方法[17],半乳糖在醛糖还原酶催化下,还原成半乳糖醇,堆积在细胞内,导致细胞肿胀,引起自由基堆积、抗氧化物质活性降低、机体免疫力降低等现象,最终导致衰老[18-19]。脾脏作为重要的免疫器官,肝脏、肾脏作为动物重要的代谢器官,若重量降低,可直接影响机体免疫和动物代谢能力[20]。本研究得出,与模型组相比,高剂量组脾脏、肝脏、肾脏指数都显著高于模型组(P<0.05),说明‘农大4号’欧李果实花色苷有延缓脏器萎缩,提高免疫力的作用。
MDA是脂质过氧化产物,被认为是衰老的指标,MDA含量随衰老而增加[20]。包晓玮等[21]在沙棘多糖对D-半乳糖致衰老小鼠的抗氧化作用的研究中,通过皮下注射D-半乳糖建造衰老模型,得出模型组与空白组相比,小鼠的肝脏、脑组织匀浆及血清中的MDA均增加,表明建模成功。罗磊等[16]研究表明,通过注射D-半乳糖,模型组小鼠血清和脏器的MDA显著高于空白组,表明抗衰老模型建造成功。本研究通过颈部注射D-半乳糖,最后得出模型组的血清及各脏器的MDA均显著高于空白组(P<0.05),表明抗衰老模型建立成功。也有研究表明[22-23],SOD的降低也可表示D-半乳糖衰老模型的建立成功。本研究中,空白组血清及各脏器SOD显著高于模型组(P<0.05),也可以说明衰老模型建造成功。
MDA是不饱和脂肪酸过氧化产物之一,其含量的高低可反映过氧化程度的强弱,降低MDA是抗氧化研究中的一个重要机制[24]。T-AOC代表体内酶类和非酶类抗氧化物质的综合[25]。SOD对超氧阴离子自由基具有清除作用,进而减少脂质过氧化反应[16,26]。GSH-Px可以催化GSH 还原过氧化物,终止自由基引起的脂质过氧化反应[27]。CAT可以使过氧化氢还原成水和分子氧,清除过氧化氢[28-29]。
本研究得出,与模型组相比,各组小鼠的MDA均有不同程度的下降,其中除低剂量组的心脏、肝脏、脾脏以及中剂量组的心脏、脾脏外,其余各组脏器的MDA及各组血清的MDA均具有统计学差异(P<0.05);VE对照组和高剂量组血清及各脏器T-AOC均显著高于模型组(P<0.05);VE对照组、高剂量组血清及各脏器SOD均显著高于模型组(P<0.05);高剂量组和中剂量组血清及各脏器GSH-Px显著高于模型组(P<0.05);VE对照组和高剂量组血清及各脏器和中剂量组血清、心脏、肾脏CAT显著高于模型组(P<0.05)。在以往研究中心,‘黑美人’土豆色素[30]、黑豆花色苷[31]、荔枝果皮花色苷[32]和红树莓花色苷[11]等作用于衰老小鼠,发现花色苷增加了小鼠血清及各脏器组织中SOD、CAT、GSH-Px活性,降低了MDA含量,这与本实验结果相似。花色苷作为多酚羟基的黄酮类化合物,可能一方面可以螯合作为自由基反应的催化剂的过渡金属元素如Fe、Cu等,抑制脂质过氧化,阻止脂质过氧化的链式反应[33],另一方面通过提高机体总抗氧化能力、提高过氧化酶活力等清除机体中有害物质,从而间接或直接的增强机体清除自由基和抗氧化能力[34-37],减缓小鼠衰老。
4 结论
本试验采用D-半乳糖构建小鼠氧化损伤模型的方法,进行‘农大4号’欧李果实花色苷对衰老小鼠保护作用研究中,得出‘农大4号’欧李果实花色苷可以降低小鼠体内的MDA的积累,提高组织的T-AOC,CAT、GSH-Px,SOD活性,减缓小鼠衰老,为后续欧李果实花色苷在功能农业,食药方面的开发利用提供数据和理论支持。

