基于适配体拉曼光谱技术快速检测肠炎沙门氏菌方法
邵 琳,王 玥,曲 晗,郝良玉,王洪利,田栢会,李志萍,李乾学,沈明浩,*
(1.吉林农业大学,吉林长春 130000;2.军事科学院军事医学研究院军事兽医研究所,吉林长春 130122;3.长春理工大学,吉林长春 130022)
沙门氏菌是引起食物中毒极为重要的食源性致病菌[1]。近些年,世界范围内的食品安全恶性事件频繁发生,防不胜防[2-3]。据世界卫生组织报道,全球每年感染沙门氏菌的人数过万[4]。据资料统计,每年由沙门氏菌造成的食物中毒事件占食物中毒事件总数的40%~60%[5],在我国,由沙门氏菌引起的食物中毒屡居首位[6]。沙门氏菌(Salmonella)隶属于肠杆菌科[7],它是寄生于生物肠道内,生化反应和抗原构造相似的革兰氏阴性杆菌的统称[8]。尤其以肠炎沙门氏菌(Salmonellaenteritidis)为代表的病原菌在食品卫生安全、疾病预防和环境监测[9-11]等方面形成了巨大的威胁,对人体的健康也造成了很大危害。目前应用于沙门氏菌的检测方法包括荧光PCR检测[12]、生物传感器检测[13]、ELISA检测[14]等,这些检测方法存在灵敏度低、耗时长,不适用于现场的快速检测等缺点,无法满足实际应用需求。近年来,适配体技术已经逐渐应用于食源性致病菌的检测领域。
适配体(Aptamer)是通过指数富集的配体系统进化技术(Systematic evolution of ligands by exponential enrichment,SELEX)筛选得到的一段短的单链DNA或RNA[15]。近年来,适配体检测技术在生化分析和食品安全等方面的应用得到了全面的发展。适配体几乎可与每一个目标分子进行化学修饰,并且它能够与相应的靶标分子例如金属离子、有机小分子药物、蛋白质乃至整个细胞进行高亲和力和强特异性的结合[16]。目前国内外已成功筛选出了与食源性致病菌特异性结合的适配体,此项研究具有发展成快速检测技术的潜力[17]。但所筛选出的适配体其特异性和亲和力不好,并且与其配套的检测设备检测信号不够灵敏,这对于实现现场快速检测形成了一定的困难。对于沙门氏菌这种高威胁性的病原菌[18],迫切需要开发出一种简易、快速、灵敏度高、低使用成本的检测技术。
近些年,拉曼光谱技术迅猛发展,应用领域也越来越多[19]。拉曼光谱可以通过透明材质容器对被检测样品进行定性分析[20];并且其谱峰与被检测样品浓度呈正比关系,因此拉曼光谱还可对被检测样品进行定量分析[21-22]。目前拉曼光谱应用于食品检测方面的相关研究还相对较少。本研究将适配体筛选技术及表面增强拉曼光谱技术结合,可实现对肠炎沙门氏菌的快速、高效检测,以期该方法在食品检测领域得到更广泛的应用。
1 材料与方法
1.1 材料与仪器
肠炎沙门氏菌(Salmonellaenteritidis,CICC:21482)、阪崎克罗诺杆菌(Enterobactersakazakii,CICC:21560)、福氏志贺氏菌(Shigellaflexneri,CICC:21534)、肺炎克雷伯氏菌(Klebsiellapneumoniae,CICC:10870)、大肠埃希菌O157∶H7(EscherichiacoliEHEC O157∶H7,CICC:21530) 中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC);PBS(Phosphate Buffered Solution) 美国HYclone公司;99.9999%硝酸银(AgNO3) 德国Sigma-Aldrich(Taufkirchen)公司;LB液体培养基(LB Broth) 上海生工生物工程股份有限公司;PrimeSTAR® Max DNA Polymerase 日本TAKARA公司;Lambde核酸外切酶 美国New England Biolabs公司;去离子水(DNaseRNase-Free Deionized Water) 北京天根生化科技有限公司;猪肉肉糜(Pork minced Pork) 购买于当地超市。
LabRAM HR Evolution拉曼光谱仪 HORIBA Xcientific;上海智城分析仪器制造有限公司;BSC-1300ⅡA2生物安全柜 苏州净化公司;ZXDP-A2080十段编程电热恒温培养箱 上海智城分析仪器制造有限公司;GXSI PCR仪 德国艾本德公司。
1.2 肠炎沙门氏菌特异性适配体whole-bacteria-SELEX筛选
1.2.1 构建随机文库 构建肠炎沙门氏菌随机单链DNA文库:
5′-GCGATCCAAGCTTCTTCAATT-N50-GATACT AGACTGCACATCT-3′;
上游引物:5′-GCGATCCAAGCTTCTTCA-3′;
下游引物:5′-AGATGTGCAGTCTAGTAT-3′。
(以上均由上海生工生物工程有限公司合成,下游引物5′端磷酸化)。
1.2.2 细菌培养 将本实验室保存的肠炎沙门氏菌20 μL加入5 mL LB液体培养基中,放入摇床200 r/min,37 ℃培养12 h。将菌液用PBS洗3次,每次3500 r/min离心5 min,4 ℃保存备用。
1.2.3 SELEX筛选肠炎沙门氏菌适配体
1.2.3.1 肠炎沙门氏菌与ssDNA随机文库的结合与分离 将合成的ssDNA随机文库120 μL金属浴95 ℃ 15 min,立刻置于冰上15 min备用。将折叠后的ssDNA随机文库240 μL与1 mL肠炎沙门氏菌混合,室温孵育2 h。将混合物3500 r/min洗涤5 min弃上清,用结合缓冲液洗3次,3500 r/min洗涤5 min。最后用200 μL去离子水溶解。将结合样品金属浴95 ℃ 15 min,立刻置于冰上15 min,12000 r/min离心5 min后收集上清,PCR扩增。剩余样品-20 ℃保存[23]。
1.2.3.2 筛选后的ssDNA产物PCR扩增 以上一轮筛选所得的ssDNA产物为模板进行PCR扩增。PCR扩增体系为:筛选后的适配体模板3 μL、2×Taq PCR Master Mix酶25 μL、上游引物0.5 μL、下游引物0.5 μL、去离子水21 μL,总体积为50 μL。PCR扩增条件为a.95 ℃ 5 min,b.95 ℃ 45 s,c.69 ℃ 45 s,d.72 ℃ 45 s,e.72 ℃ 5 min,f.4 ℃保存。扩增时,步骤b~d扩增25个循环。
1.2.3.3 各轮PCR扩增结果琼脂糖凝胶电泳鉴定 本实验采用2%琼脂糖凝胶电泳进行鉴定。将PCR产物中加入45 μL 3 mol/L乙酸钠、5 μL Dr.GenTLE Precipitation Carrier和1 mL的无水乙醇,放入-20 ℃冰箱中沉淀过夜。4 ℃,12000 r/min离心30 min,弃上清,用1 mL 70%乙醇重悬,12000 r/min离心15 min,弃上清,洗涤2次,晾干备用。取100 μL去离子水将核酸溶解,加入12 μL 10×λ酶切反应Buffer与8 μL λ外切酶,37 ℃ 40 min,75 ℃ 10 min。重复以上筛选至第九轮,从第十轮开始采用阪崎克罗诺杆菌、福氏志贺氏菌、肺炎克雷伯氏菌、大肠埃希菌O157∶H7进行扣除筛选至第十五轮。将PCR扩增第十五轮适配体筛选结果进行挑取单克隆测序。
1.3 ELISA评价适配体亲和力
将肠炎沙门氏菌用PBS洗涤3次,每次3500 r/min,离心5 min弃上清,用15 mL ELSA包被缓冲液溶解稀释细菌,每孔加入100 μL菌液,H行空白对照,4 ℃过夜。每孔用200 μL PBS洗涤3次。每个孔加5%胎牛血清200 μL,4 ℃封闭3 h,用0.5% PBST洗涤3次。将14条候选适配体分别稀释为500 nmol/L,95 ℃ 15 min、迅速冰上15 min、室温15 min折叠。每孔加入100 μL,37 ℃孵育2 h。再用200 μL 1×Binding Buffer洗涤3次,在每个孔里加100 μL链霉亲和素标记辣根过氧化物酶37 ℃ 45 min,200 μL Binding Buffer洗3次,TMB显色液每个孔加入100 μL,37 ℃箱孵育20 min,50 μL硫酸终止反应,使用酶标仪检测A450处OD值,以A450处OD值表示适配体亲和力的大小。
1.4 TEM样品制备
肠炎沙门氏菌-Aptamer-AgNPs TEM样品制备:分别将浓度为200、300、400、500 nmol/L的适配体与洗涤好的肠炎沙门氏菌均匀混合,室温孵育1.5 h,3500 r/min离心5 min,弃上清,加入1 mL Binding Buffer缓冲液重悬,3500 r/min离心5 min,弃上清,重复此操作洗涤3次,加入新鲜配制的AgNO3溶液100 μL,充分混合均匀,避光孵育5 min,再匀速加入新鲜配制的NaBH4溶液100 μL,混合均匀,2000 r/min离心20 s,弃上清,用100 μL去离子水重悬,4 ℃冰箱保存备用。漩涡振荡将样品混匀,将碳支持膜浸入样品中,5 s后取出,用滤纸去除多余液体,加热干燥5 s,固定,放置于透射电子显微镜中,观测并拍照。
纳米银(AgNPs)TEM样品制备:取0.017 g AgNO3溶解于10 mL去离子水中,AgNO3溶液浓度为0.1 mmol/L;将0.019 g NaBH4溶解于50 mL去离子水中,NaBH4溶液浓度为0.1 mmol/L。取100 μL AgNO3放入1.5 mL离心管中,匀速加入100 μL NaBH4,混匀。合成纳米银粒子为黄绿色胶体溶液,4 ℃避光保存备用。
1.5 表面增强拉曼技术快速检测肠炎沙门氏菌方法的建立
1.5.1 肠炎沙门氏菌-AgNPs样品制备 取1 mL肠炎沙门氏菌3500 r/min离心2 min,弃上清,用Binding Buffer,3500 r/min离心2 min,洗涤3次,弃上清;100 μL浓度为0.1 mmol/L的新鲜配制的AgNO3溶液重悬,避光孵育5 min,缓慢匀速加入100 μL浓度为0.1 mmol/L的新鲜配制的NaBH4溶液,混匀后顺离20 s,弃上清,用100 μL去离子水重悬,取10 μL滴到载玻片上,涂匀晾干备用。
1.5.2 肠炎沙门氏菌-Aptamer-AgNPs样品制备 取1.3中亲和力较高的适配体折叠后与肠炎沙门氏菌室温条件下结合孵育20 min,3500 r/min离心5 min,弃上清,用1 mL Binding Buffer洗涤3次,每次3500 r/min离心5 min,弃上清;沉淀用100 μL浓度为0.1 mmol/L的新鲜配制的AgNO3溶液重悬,避光孵育5 min,缓慢匀速加入100 μL浓度为0.1 mmol/L的新鲜配制的NaBH4溶液,混匀后2000 r/min离心20 s,弃上清,用100 μL去离子水重悬,取10 μL滴到载玻片上,涂匀晾干备用。此样品用于肠炎沙门氏菌特异性适配体SERS检测与肠炎沙门氏菌基于SERS技术重复性检测。
1.5.3 混合细菌样品制备 将肠炎沙门氏菌、阪崎克罗诺杆菌、福氏志贺氏菌、大肠埃希菌O157∶H7、肺炎克雷伯氏菌3500 r/min离心2 min,弃上清,1 mL Binding Buffeer洗涤2次,弃上清,用80 μL Binding Buffer重悬混合细菌,加入折叠好的适配体120 μL室温条件下孵育1.5 h,3500 r/min离心5 min,弃上清,用1 mL Binding Buffer洗涤2次,每次3500 r/min离心5 min,弃上清;沉淀用100 μL浓度为0.1 mmol/L的新鲜配制的AgNO3溶液重悬,避光孵育5 min,缓慢匀速加入100 μL浓度为0.1 mmol/L的新鲜配制的NaBH4溶液,混匀后2000 r/min离心20 s,弃上清,用100 μL去离子水重悬,取10 μL滴到载玻片上,涂匀晾干备用[24]。
1.5.4 拉曼检测 分别使用107、106、105、104、103、102和101CFU/mL 7个浓度洗涤好的肠炎沙门氏菌与300 nmol/L折叠后的肠炎沙门氏菌特异性适配体结合,在复合物表面原位还原纳米银壳,进行拉曼信号采集。
分别将等量的肠炎沙门氏菌、肺炎克雷伯氏菌、大肠埃希菌O157∶H7、福氏志贺氏菌、阪崎克罗诺杆菌与折叠后的肠炎沙门氏菌特异性适配体结合,在复合物表面原位还原纳米银。将等量混合五种细菌与肠炎沙门氏菌特异性适配体结合,在复合物表面原位还原纳米银,分别采集拉曼信号。
参数设置为:激发光源532 nm,强度14 mW,物镜50倍,积分时间5 s,积分次数2次,狭缝宽度100 μm,拉曼扫描范围500~2000 cm-1。
1.6 猪肉样品加标实验
取新鲜LB液体培养加入琼脂粉15 g,加入1 L去离子水同时搅拌混匀,调节pH至7.2±0.2,高压灭菌,倒入平板培养皿内冷却,4 ℃保存备用。将5 g肉糜样品浸泡在一定量的10 mL 10 mmol/L磷酸盐缓冲液中,在灭菌锅中进行灭菌处理。灭菌后的样品在10000 r/min条件下离心15 min,去除掉样品中的固形物杂质。上层清液分装在离心管内,利用本实验建立的检测方法进行检测,得到结果与传统平板计数法相比较,并计算其回收率[25]。
1.7 数据处理
数据处理使用Origin software 8.5和GraphPad Prism 7软件。
2 结果与分析
2.1 肠炎沙门氏菌特异性适配体whole-bacteria-SELEX筛选结果
共进行十五轮筛选,第一轮~第九轮为正向筛选,第十轮~第十五轮为扣除筛选,各轮筛选均有有效结果,其中第一轮、第八轮、第十五轮筛选电泳结果如图1所示,第一轮~第十五轮结合力逐渐增强,条带越来越清晰明亮,符合预期结果。
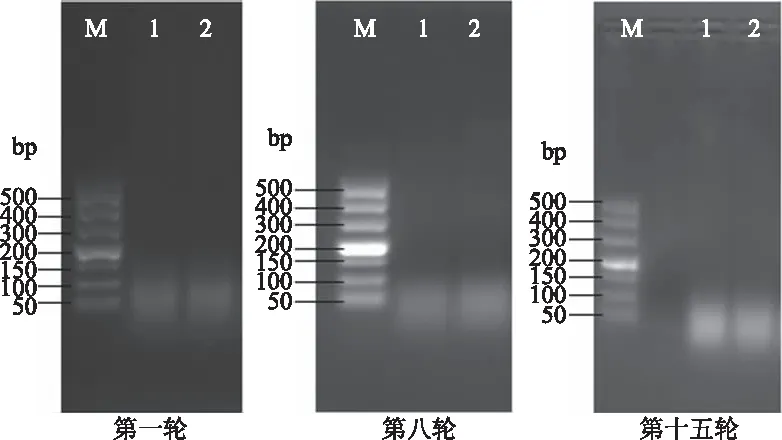
图1 肠炎沙门氏菌适配体筛选结果电泳图
2.2 肠炎沙门氏菌候选适配体ELISA亲和力评价
将筛选后的第十五轮核酸适配体文库进行PCR扩增、单克隆测序,将测序结果进行序列分析,绘制进化树。从中选取拷贝数较高的14条候选核酸适配体进行后续评价。
对14条适配体进行亲和力评价,结果如图2所示。可以明显看出4、10、12号候选核酸适配体OD值较高,因此,选择4、10、12号候选核酸适配体进行后续SERS评价。
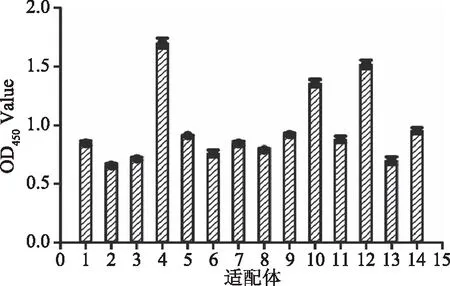
图2 十四条候选适配体亲和力评价
通过DNAMAN软件对所选择出的4、10、12号候选核酸适配体进行二级结构预测,所得结果如图3所示,由预测图可以看出含有凸环与茎环结构,在茎环的链接处分析可能是目标肠炎沙门氏菌的结合位点,通过碱基堆积、带电基团的静电作用、芳香化合物堆积与氢键相作用形成肠炎沙门氏菌稳定的结合位点。

图3 候选适配体二级结构预测图
2.3 表面增强拉曼光谱对肠炎沙门氏菌候选适配体亲和力评价
从图4可以看出,该光谱735 cm-1处有明显特征谱峰,并且735 cm-1处峰形尖锐,对拉曼增强扫描信号结果峰图进行归属峰分析表明,735 cm-1来自胞嘧啶与尿嘧啶的代谢产物。且肠炎沙门氏菌-Aptamer4-AgNPs的图谱明显高于肠炎沙门氏菌-Aptamer10-AgNPs与肠炎沙门氏菌-Aptamer12-AgNPs的图谱,由ELISA与SERS实验结果均表明4号适配体亲和力最高,特异性最好。肠炎沙门氏菌特异性核酸适配体序列Aptamer4为:TTTTTGCGATCCAAGCTTCTTCAAT TGGAGTGCTACCGAGATACATGGGTGGGCTCAAACAA TCGTGGGCTCGCTTGATACTAGACTGCACATCT。结果表明本研究方法能特异性增强肠炎沙门氏菌检测的信号,峰强高,峰形明显,直观可见。

图4 肠炎沙门氏菌SERS检测结果图
2.4 肠炎沙门氏菌电子显微镜表征
结果如图5所示,在一定的浓度范围内,适配体浓度增加,纳米银的吸附量也随之增加,因此SERS检测信号也得到了增强。
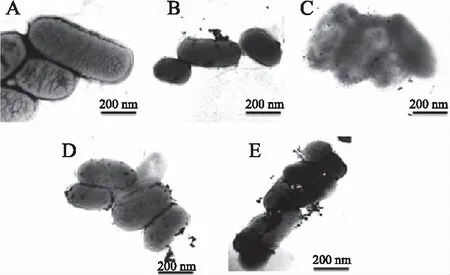
图5 肠炎沙门氏菌及肠炎沙门氏菌与不同浓度适配体结合后原位还原样品的TEM表征
将单独制作的纳米银粒子(AgNPs)样品取出,对其均一度进行透射电子显微镜表征,扫描结果如图6所示,纳米银粒子的均一度良好,粒子的直径在4~5 nm左右。

图6 AgNPs TEM表征
2.5 基于SERS适配体技术检测肠炎沙门氏菌
2.5.1 肠炎沙门氏菌基于SERS技术重复性检测 对肠炎沙门氏菌-Aptamer4-AgNPs样品进行5次随机拉曼光谱扫描,扫描结果如图7所示,拉曼扫描结果显示5次峰图重复性良好,峰强与峰形几乎没有偏差,吻合度高。

图7 肠炎沙门氏菌SERS重复性检测
2.5.2 不同浓度肠炎沙门氏菌SERS检测 如图8所示,随着细菌浓度升高,拉曼增强扫描光谱信号强度随之升高,当细菌浓度低至102CFU/mL时,仍能获得拉曼响应信号。这说明该方法检测限能够达到102CFU/mL细菌浓度。细菌浓度与拉曼信号强度成线性相关,线性方程为Y=0.05X-0.85,R2=0.95。

图8 肠炎沙门氏菌SERS检测灵敏度评价
2.5.3 肠炎沙门氏菌与其他菌混合样品SERS检测 如图9所示,五种混合细菌-Aptamer4-AgNPs与肠炎沙门氏菌-Aptamer4-AgNPs能检测出明显的峰。从这组数据看出此研究方法能够在混合细菌样品中准确地检测出目标细菌肠炎沙门氏菌。

图9 混合细菌样品中肠炎沙门氏菌检测结果
2.6 猪肉样品加标回收率测定
本研究的新检测方法与传统的平板计数方法所测得的结果相对照,结果如表1所示,肠炎沙门氏菌的检测回收率在93.37%~100.18%之间,所得回收率高。与传统平板计数法相比,本实验所建立的检测方法的一致性良好,可以应用于猪肉实际样品中肠炎沙门氏菌的检测。

表1 猪肉样品中肠炎沙门氏菌的检测回收率
3 讨论与结论
本文以肠炎沙门氏菌为研究目标,采用whole-bacteria-SELEX筛选技术进行筛选核酸适配体,与其他SELEX筛选方法相比,本实验仅需十五轮就筛选出亲和力高、特异性强的核酸适配体。与传统ELISA检测相比,本实验采用ELISA与表面增强拉曼光谱技术相结合的检测方法,该方法不仅延用了ELISA检测的优点,例如成本低、操作简单等,还结合表面增强拉曼光谱技术,使检测方便快捷,且具有高灵敏度、高选择性,能快速准确识别被测样品。本研究通过SERS技术快速检测肠炎沙门氏菌和筛选特异性适配体重复性良好,在五次随机检测中得到基本吻合的峰,与其他类似拉曼检测实验相比,本实验的重复性吻合度更好,峰强更高。
本实验通过SERS技术对筛选出的适配体进行特异性检测,采用类似文献中的实验方法,本实验也可从五种混合细菌中特异性检测出肠炎沙门氏菌,峰形明显,说明本实验筛选出的适配体具有高特异性。本实验还对SERS检测肠炎沙门氏菌的细菌浓度进行探究,发现细菌浓度在102~107CFU/mL与拉曼信号强度呈线性关系,且R2=0.95,与相类似实验的结果相近,最低检测限为102CFU/mL,也符合实验要求,本实验SERS检测全过程仅需45 min左右,比其他检测方法节省了许多时间,且根据拉曼光谱的特性,SERS检测的灵敏度高,准确性好。同时将此研究方法应用于市售猪肉样品中肠炎沙门氏菌的实际检测发现,所建立方法准确度好、灵敏度高,可适用于猪肉实际样品的在线监测[26]和快速预警[27],可有效避免由肠炎沙门氏菌感染等引发的食品安全问题[28],并有效提高食品安全水平。

