基于高通量技术分析龙门传统蜂蜜醋微生物多样性
邱楚茹,潘伟杰,林 捷,*,吴安萍,陈秋雯,唐倩彤,付章平
(1.华南农业大学食品学院,广东广州 510642;2.惠州市龙门县富润康食品有限公司,广东惠州 516800)
以蜂蜜为原料酿制保健醋,不仅具有很好的营养价值,同时为蜂蜜的深加工提供了一条新途径[1]。龙门蜂蜜醋是以中华蜂采集的荔枝蜜为原料,混合菌发酵后的产物,含有原蜂蜜的营养成分及微生物发酵产生的新营养物质,而且风味独特、香气醇厚、酸甜适宜,赢得人们喜爱和关注[2-4]。传统方法生产的龙门蜂蜜醋,微生物菌种源自多年来自然筛选富集,适合该生态环境下生长,是多菌种长期共生形成的有稳定菌群结构的混合菌种。近年来,随着信息技术和测序方法的快速发展,利用新一代测序技术(Next Generation Sequencing)研究物质的宏基因组学(Metagenomics),能快速准确的得到丰富的生物数据和大量的微生物研究信息,从而成为研究微生物多样性和群落特征的重要手段[5-6]。目前,国内用于蜂蜜醋发酵菌株常用Acetobacterpasteurianus、Acetobacterschutzenbachii、Acetobacterrancens、Acetobacteraceti、Lactobacillusacidophilus,且单一菌种或几种已知菌种复配,罗萍等[4]用菌膜扩培液进行发酵,但并未分析混合菌种的生物多样性。本实验采用宏基因组学(Metagenomics)对传统龙门蜂蜜醋进行分析,通过功能基因筛选和测序分析等研究手段[7],将比较快速且全面准确地掌握蜂蜜醋菌种的菌群组成及菌种比例,并研究优势菌种的主要代谢通路。通过Illumina PE150测序,对龙门地区的蜂蜜醋样品中微生物多样性进行分析,同时分析蜂蜜醋的有机酸、氨基酸等成分,以期为龙门地区传统蜂蜜醋中微生物菌种资源的发掘、利用提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
蜂蜜(荔枝蜜,70~75 Brix)和蜂蜜醋菌种(蜂蜜醋发酵液和菌膜1∶1混合物) 惠州市龙门县富润康食品有限公司提供,采样后置于无菌容器保藏于4 ℃冰箱备用;其他试剂均为分析纯。
HV-50灭菌锅 日本HIRAYAMA公司;SPX-300-GB生化培养箱 上海一恒科学仪器有限公司;SW-CJ-IFD超净工作台 苏州安泰空气技术有限公司;WYT手持糖度计 成都泰华光学有限公司;LRH-150F台式pH计 梅特勒-托利多仪器(上海)有限公司;L-8800型全自动氨基酸分析仪 日本日立公司。
1.2 实验方法
1.2.1 蜂蜜醋菌种培养 配制15 Brix蜂蜜水于已灭菌三角瓶中,80 ℃灭菌20 min后备用,在超净工作台接入5%种子液(蜂蜜醋发酵液和菌膜按质量比1∶1混合打碎备用),用六层无菌纱布封口,置于30 ℃恒温培养箱,静置培养7 d。
1.2.2 蜂蜜醋菌种宏基因组测序分析 蜂蜜醋菌种按照1.2.1活化后,用冰袋保存送样,委托诺禾致源公司测定。送样后,诺禾致源公司将检测合格的DNA样品,进行文库检测以及文库构建,检测合格的文库将采用 Illumina PE150 进行测序,测序得到的下机原始数据(Raw Data)用于后期信息分析。DNA样品检测:琼脂糖凝胶电泳(AGE)分析DNA的纯度和完整性[9];Qubit对DNA浓度进行精确定量。
文库构建及库检:检测合格的DNA样品用Covaris超声波破碎仪随机打断成长度约为350 bp的片段,经末端修复、加A尾、加测序接头、纯化、PCR扩增等步骤完成整个文库制备。使用Qubit2.0进行初步定量,稀释文库至2 ng/μL,随后使用Agilent 2100对文库的insert size进行检测,insert size符合预期后,使用Q-PCR方法对文库的有效浓度进行准确定量(文库有效浓度>3 nM),以保证文库质量。
1.2.3 蜂蜜醋发酵 按照1.2.1活化处理后置于30 ℃恒温培养箱,静置培养3个月。
1.2.4 蜂蜜醋pH测定方法 pH计测定。
1.2.5 蜂蜜醋总酸的测定 参考食品安全国家标准《GB/T 5009.41-2003》对酿造食醋的总酸进行测定。
1.2.6 非挥发酸的测定 参考食品安全国家标准《GB 18187-2000》对酿造食醋非挥发酸进行测定。
1.2.7 蜂蜜醋游离氨基酸测定 参考文献[8],样品测定条件:进样体积:0.05 mL;稀释度:2;色谱柱:LCA K07/Li;检测波长:570 nm+440 nm;流动相:柠檬酸锂A=pH2.90;B=pH4.20;C=pH8.00;温度:38~74 ℃梯度升温60 min;流速:洗脱泵0.45 mL/min+衍生泵0.25 mL/min。
2 结果与分析
2.1 蜂蜜醋菌种总DNA提取
蜂蜜醋样品总DNA琼脂糖凝胶电泳检测结果如图1所示,主带清晰且无500 bp以下集中带,DNA条带无明显拖尾现象,无杂带,说明DNA纯度较高。利用Qubit2.0 DNA检测试剂盒检测蜂蜜醋样品的总DNA浓度为12.8 ng/μL,表明不存在DNA的降解、凋亡、污染或残留等现象,其质量达到二代测序文库(Meta文库)有效浓度>3 nM的要求[10]。

图1 蜂蜜醋样品总DNA电泳检测结果
2.2 高通量测序数据统计分析
采用Illumina HiSeq测序平台测序,共获得7697.02 Mbp的下机原始数据(Raw Data),对下级数据中质量值较低的序列进行过滤,得到最终的有效数据结果见表1。经过质控得到7682.28 Mbp的有效数据(Clean Data),经过单样品组装及混合组装后,共得到14847804 bp的Scaftigs。采用MetaGeneMark软件对得到的Scaftigs进行基因预测,经过去冗余的(高度相似)基因后,共获得13490个翻译对象(ORFs),总长为12.08 Mbp,其中完整基因的个数为11975,所占比例为88.77%。非冗余基因集(Unigene)与MicroNR库进行blastp比对,运用LCA算法进行物种注释,注释到属和门的比例分别为68.27%、99.61%,12374(91.73%)个ORFs比对到KEGG数据库。

表1 蜂蜜醋菌种样品中数据产出统计信息
2.3 蜂蜜醋菌群组成及菌种比例分析
使用genes(非冗余的连续基因编码的核酸序列)与各功能数据库进行比对·DIAMOND软件[11]将Unigenes与从NCBI的NR(Version:2018.01)数据库中抽提出的细菌(Bacteria)、真菌(Fungi)、古菌(Archaea)和病毒(Viruses)序列进行比对(blastp,evalue≤1e-5)[12],共13490个Unigenes可以得到注释信息[9]。能够注释到NR数据库的翻译对象(ORFs)的数目为12865(95.37%),在能够注释到NR数据库的ORFs中,注释水平达到界的比例为99.84%,将蜂蜜醋菌种中的微生物归属于两大生物界中,大多数序列属于细菌界(97.1%),另外一小部分序列被分配到真菌界(0.01%),此外还有2.85%序列未匹配到以上任何生物界中,这意味着与当前生物信息数据库中已知的生物序列没有相关性或者亲缘关系非常远[13]。
从表2可知,蜂蜜醋菌种中大部分归属于变形杆菌门,占比为96.77%,酸杆菌门占比0.05%,剩余的序列占比较小,且在发酵过程中不被期望。从表2可知,蜂蜜醋菌种在Komagataeibacter、Acetobacter、Gluconacetobacter、Gluconobacter、Sphingomonadales、Rhizobiales等都有同源序列分布。从图2可知,其中Komagataeibacter菌属占蜂蜜醋菌种的Unigene共有57.86%,主要包括Komagataeibacterxylinus(4.22%)、Komagataeibacterkakiaceti(3.90%)、Komagataeibactereuropaeus(4.20%)、Komagataeibacterhansenii(3.31%)等,无法分类的Komagataeibacter有37.78%;与Gluconobacter属相似序列的Unigene占1.24%;与Acetobacteraceae属有相似序列包括无法识别的Acetobacteraceae的26.23%占总Unigene的31.57%;与Gluconacetobacter菌相似的有1.99%包括Gluconacetobacterdiazotrophicus(1.00%)、Gluconacetobactersp. SXCC-1(0.99%),与其他物种相似性较少。蜂蜜醋菌种与前人报道过的红茶菌菌种组成相似[14-16]。

表2 蜂蜜醋菌种主要门与属的分布及丰度
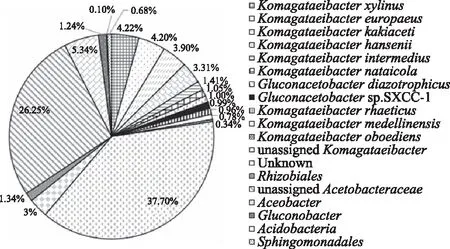
图2 蜂蜜醋菌种宏基因组Unigene在NR数据库中物种分布图
其中含量较少的产酸菌有归类于酸杆菌门,乳杆菌属的Granulicellamallensis。在红杆菌目包含了亲乳双歧杆菌(Gemmobacternectariphilus)与嗜中乳杆菌(Rubellimicrobiummesophilum)被发现姚栗等是芝麻香型白酒大曲发酵末期的优势菌种[17]。以及酸单胞菌属的单一菌种甲醇酸单胞菌(Acidomonasmethanolica),其在四川麸醋和红茶菌中,甲醇酸单胞菌能利用甲醇、乙醇产甲酸、乙酸,利用可发酵性糖产酸,提高食醋发酵过程中的产酸率[18-19]。
2.4 蜂蜜醋菌种主要代谢通路分析
如表3所示,在蜂蜜醋菌种中碳水化合物代谢主要包括丙酮酸代谢、戊糖磷酸途径、糖酵解/糖异生、淀粉和蔗糖代谢、氨基糖和核苷酸糖代谢等,这些途径的中间代谢产物为短链脂肪酸、乙酸乙酯的合成提供原料,同时前三种基础代谢途径产生大量的乙酸、丁酸、柠檬酸、葡萄糖酸等有机酸使发酵液pH逐渐降低,醋的风味逐渐丰富。从菌种参与度方面看,Komagataeibacter菌属是主要的碳水化合物代谢承担者,其中木醋杆菌参与每条碳水代谢途径,参与度依次是Komagataeibacterkakiaceti、Komagataeibacterhansenii、Komagataeibactereuropaeus,并且也是占蜂蜜醋菌种比例前五位的物种,值得注意的是Komagataeibacterrhaeticus菌种比例不高但参与三分之二的碳水代谢途径,另一方面,Acetobacter菌属与Gluconobacter菌属参与度低,推测原因:前者不是直接以糖产酸,后者在菌种比例含量低。Gluconacetobacter菌属中Gluconacetobactersp. SXCC-1参与度也较高,可能与其特殊代谢方式有关[20]。另外,蜂蜜醋发酵3 个月后,pH达到2.13,总酸含量为33.5 g/L,非挥发酸含量达到9.82 g/L,非挥发酸占总酸的比例不低,从主要功能菌种来分析,Komagataeibacter菌属通过多条碳水化合物代谢途径产生不挥发的较乙酸柔和的酸,例如:丁酸、丙酸、葡萄糖酸、丙酮酸、异柠檬酸等。依据宏基因组分析结果,选取6株菌的含量最高的菌种作为参与菌种,分析其碳水化合物代谢途径与产物,发现代谢产物含有丰富的非挥发酸,与蜂蜜醋化学分析结果吻合[21]。

表3 碳水化合物代谢途径
从表4得知,在氨基酸代谢途径中,有14种氨基酸代谢途径,承担氨基酸代谢功能的依旧是Komagataeibacter菌属,Komagataeibacterxylinus参与每条氨基酸代谢途径,参与度依次是Komagataeibactereuropaeus、Komagataeibacterrhaeticus、Komagataeibacterhansenii、Komagataeibacternataicola。由此,可知Komagataeibacter菌属是蜂蜜醋发酵过程中,主要功能微生物群,是蜂蜜醋风味产物的生产者。Komagataeibacter菌属主要功能是不完全氧化糖类、糖醇类和醇类生成相应的糖醇、酮和有机酸,氧化乙醇生成乙酸,合成纤维素膜抵御低pH等不良环境。Gluconacetobactersp. SXCC-1参与度也较高,推测与其直接利用糖产酸的发酵特性有关,氨基酸代谢途径产生其特征风味物质的前体,徐伟等[22]发现其为红茶菌的优势菌种。依据宏基因组分析结果,选取6株菌的含量最高的菌种作为参与菌种,分析其氨基酸代谢途径与产物,发现代谢产物与氨基酸自动分析仪结果吻合[21]。在氨基酸的生物合成中,柠檬酸循环、糖酵解等途径中的关键中间体是氨基酸碳骨架形成的主要前体。TCA循环中的α-酮戊二酸和草酰乙酸是生成谷氨酸族和天冬氨酸族氨基酸的主要合成前体;糖酵解中甘油酸-3-磷酸、丙酮酸和磷酸烯醇式丙酮酸是生成丝氨酸族、丙氨酸族和芳香族氨基酸族的氨基酸合成前体[23]。因此,参与TCA循环与糖酵解途径的菌种也参与氨基酸代谢途径。优势菌种木醋杆菌通过缬氨酸,亮氨酸和异亮氨酸的生物合成途径产生短链脂肪酸3-甲基-丁酸(异戊酸)及2-甲基-丙酸(异丁酸)的前体──异亮氨酸、亮氨酸,进一步合成短链脂肪酸,丰富了蜂蜜醋的风味。
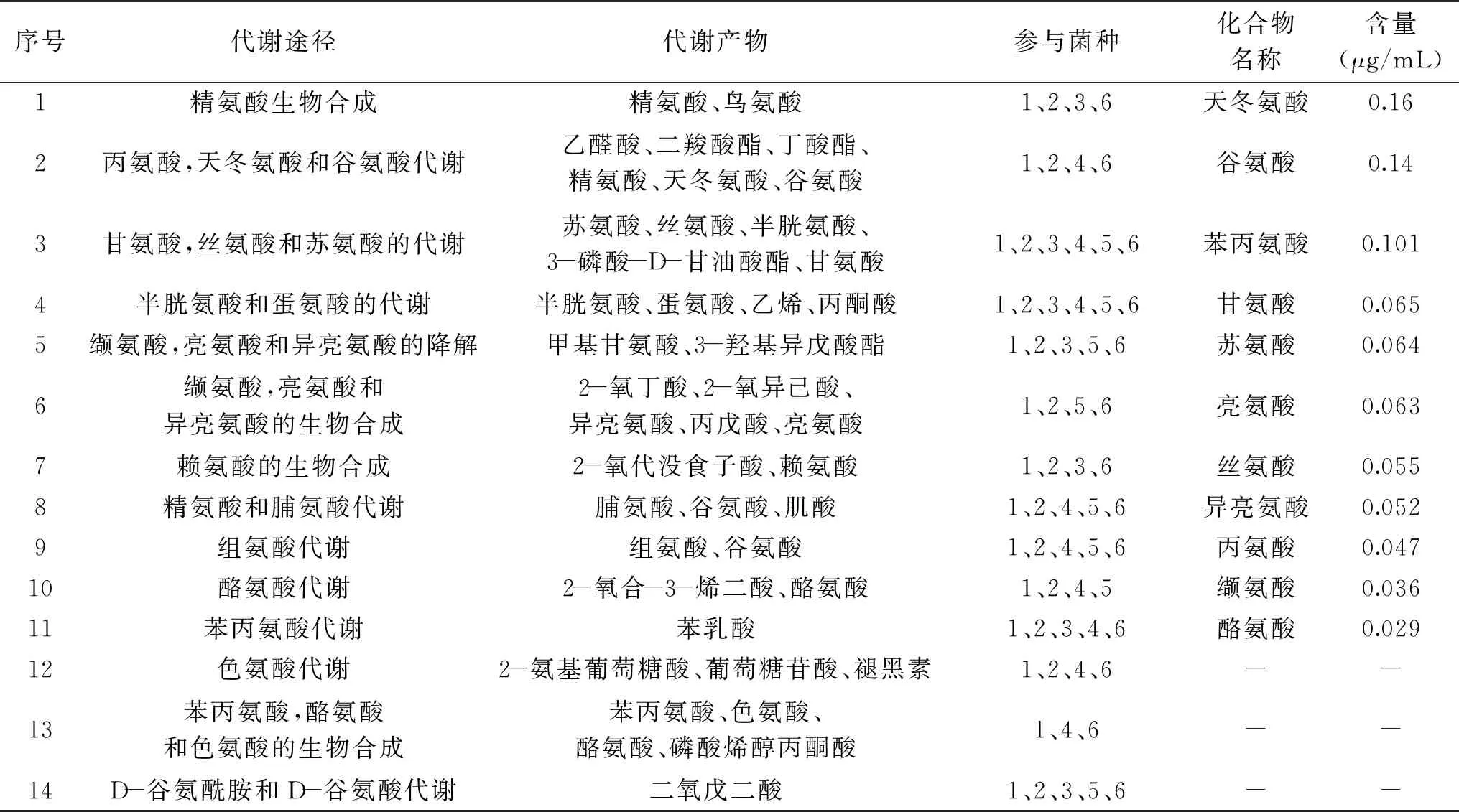
表4 氨基酸代谢途径与蜂蜜醋中氨基酸含量
酿造食醋的滋味与其所含的氨基酸种类和含量有着一定的联系,不同的氨基酸呈现不同的味觉效果,食醋中所检测出来的氨基酸种类一共可以分为四类。分别是涩味氨基酸、甜味氨基酸、苦味氨基酸和鲜味氨基酸[24]。其中苦味氨基酸包括亮氨酸、异亮氨酸、缬氨酸;鲜味氨基酸包括天冬氨酸、谷氨酸;甜味氨基酸包括甘氨酸、丙氨酸、苏氨酸等[25],总游离氨基酸含量为0.813 μg/mL,甜味、鲜味氨基酸含量为0.476 μg/mL,占总氨基酸含量约60%。虽然苯丙氨酸本身呈苦味,但其在浓度为0.5~5.0 mmol的范围内,对谷氨酸钠与氯化钠混合物的味觉有显著的改善作用[26]。因此蜂蜜醋中氨基酸主要贡献“鲜、甜”的滋味,且还含有5种人体必需氨基酸。
3 结论
本研究对蜂蜜醋菌种中的微生物群落、主要代谢途径及风味代谢产物进行初步的分析。结果表明:Komagataeibacter菌属及Gluconacetobacter菌属是产生风味物质的功能核心微生物,Komagataeibacter是蜂蜜醋微生态中的优势菌种。两个菌属通过碳水化合物代谢与氨基酸代谢产生乙酸、葡萄糖酸、丁酸、氨基酸、短链脂肪酸等特征风味物质。本研究有助于阐明蜂蜜醋微生物代谢物的形成机制,进一步提高生产效率,改善并稳定醋的品质。

