连续相变萃取灵芝多糖动力学球状模型的建立及其结构特征
张 军,段 杉,全丽金,张杏思,曹 庸
(华南农业大学食品学院,广东省功能食品活性物重点实验室,广东省天然活性物工程技术研究中心,广东广州 510642)
灵芝(Ganodermalucidum)是属于多孔菌科、灵芝属的大型真菌,李时珍在《本草纲目》中对灵芝进行了较为系统的阐述,它认为灵芝具有“补肝气”、“治胸中结”、“安神”等多种功效[1]。灵芝中化学成分主要有多糖类、三萜类化合物、蛋白质、多肽、氨基酸、甾醇类、生物碱类以及微量元素等[2]。其中灵芝多糖是灵芝重要的活性成分之一,具有抗氧化[3]、抗肿瘤[4]、抗衰老[5]、降血糖[6]以及免疫调节[7]等作用。
目前灵芝多糖的萃取方法多集中在通过优化工艺条件来提高多糖得率上,主要有热水浸提法、酶解法、超声辅助萃取法、微波辅助萃取法以及超临界萃取等。热水浸提法遵循中药的煎煮原则,利用了多糖微溶于冷水易溶于热水的特性,为最常见的多糖萃取方法,但萃取率较低[8]。酶解法中酶的活性受温度、pH、时间等因素影响较大,且酶制剂用量大成本高,难以规模化生产[9]。超声辅助萃取以及微波辅助萃取均是利用物理方法加速植物细胞壁的破坏从而溶出更多的多糖,但可能会对多糖结构造成破坏[10-11]。超临界萃取法其设备制造以及维护成本较高,且极高的压力限制了设备体积的放大[12]。同时这些方法均存在萃取后料液分离困难、萃取溶剂回收不便等问题。本研究采用的新型连续相变萃取技术[13],利用水、乙醇、丁烷等作为萃取溶剂,利用萃取溶剂反复相变特性,能高效、稳定地连续逆流萃取目标物,该方法相比于传统溶剂浸提法具有萃取率高、萃取时间短、溶剂回收方便、损失率低且粗提物无需过滤等优点,已应用于多种天然活性物的萃取、中试以及工业化生产中。Zhao等[14]以丁烷为萃取溶剂,利用连续相变萃取技术结合响应面法优化酱油渣中萃取油脂工艺,油脂产率达到28.43%。谭荣威等[15]以乙醇为萃取溶剂,从桉树叶中成功萃取出桉叶多酚,多酚产率达到11.58%。但将连续相变技术应用于多糖萃取过程中则未有文献报道。故本实验旨在使用连续相变萃取装置萃取灵芝多糖(GLP),以纯水作为萃取溶剂,探究萃取温度、萃取流速以及萃取时间对灵芝多糖萃取率的影响,同时基于Fick第二定律对灵芝多糖的萃取过程动力学以及热力学性质进行研究,并研究了灵芝多糖的分子量、红外光谱性质以及微观形态,以期完善灵芝多糖萃取动力学的基础研究,并对灵芝多糖的工业化生产、精深加工以及高附加值的开发提供一定的理论基础。
1 材料与方法
1.1 材料与仪器
灵芝 无限极(中国)有限公司;葡聚糖标准品 美国Sigma-Aldrich贸易有限公司;浓硫酸、苯酚、葡聚糖分析纯 广州市化学试剂厂。
LXXB-3型连续相变萃取设备 广东省天然活性物工程技术研究中心自主研发;119型中药粉碎机 浙江温岭市药材机械厂;RE-52 A型旋转蒸发仪 上海亚荣生化仪器厂;SHZ-D循环水式多用真空泵 巩义市英峪高科仪器厂;Vertex 70型傅里叶红外光谱仪 德国Bruker公司;AL 104型万分之一电子天平 梅特勒-托利多仪器(上海)有限公司;UV-1750型紫外可见分光光度计、LC-10 A型分析高效液相色谱系统 日本岛津公司;Evo 18型扫描电子显微镜 卡尔蔡司(上海)有限公司。
1.2 实验方法
1.2.1 灵芝多糖的制备 将灵芝子实体切片,在65 ℃烘箱干燥至恒重。粉碎过20目筛得到灵芝干粉,取灵芝干粉400.00 g,装入3 L 连续相变萃取釜中密封,设置恒定流速28 L/h不变,在不同温度(333.15、343.15、353.15、363.15、373.15 K)下进行GLP萃取实验,分别萃取10、30、50、70、90、110、130、150、170以及190 min后,将萃取液减压浓缩并定容至1000 mL,得到灵芝多糖溶液,密封冷藏。同样的切片、粉碎以及过筛方法,得到同样质量的灵芝干粉装入3 L 连续相变萃取釜中密封,设置恒定温度373.15 K不变,在不同流速(20、24、28、32、36 L/h)下进行GLP萃取实验。分别萃取10、30、50、70、90、110、130、150、170以及190 min后,将萃取液减压浓缩并定容至1000 mL,得到灵芝多糖溶液,密封冷藏。
1.2.2 标准曲线的绘制及样品多糖质量浓度测定 采用苯酚-硫酸法[16],分别精密吸取100 μg/mL葡萄糖标准品溶液0.0、0.2、0.4、0.6、0.8及1.0 mL,置于10 mL具塞比色管中,加蒸馏水补充至1.0 mL。加入5%苯酚溶液1.0 mL,混匀并加入5 mL浓硫酸后静置5 min,将试管置于30 ℃水浴中反应20 min,冷却至室温,使用紫外分光光度计于490 nm波长处测定吸光值,绘制葡萄糖标准曲线。得到葡萄糖标准曲线方程y=0.01044 x-0.00109(y为吸光值,x为葡萄糖质量浓度,g/mL),线性范围为20~100 μg/mL,决定系数R2=0.9998。精密量取1.0 mL灵芝多糖溶液,按葡萄糖标准品溶液测定方法测定灵芝多糖溶液吸光值,并根据标准曲线计算灵芝溶液多糖质量浓度。
1.2.3 连续相变萃取GLP过程动力学模型 连续相变萃取GLP的传质过程可大致分为三个阶段:一是溶剂经高压泵注入萃取釜中先浸润灵芝物料表面,再逐渐向灵芝物料内部渗透,GLP在溶剂中溶解;二是溶解了GLP的溶剂与灵芝物料外表面溶剂存在浓度差,GLP从灵芝物料内部向其外表面迁移;三是GLP穿透灵芝物料表面并向外表面溶液主体中扩散[17]。以上三个阶段并没有明确的界线,相互联系连续进行,又相互促进和制约,对于整个溶出过程来说,第二步进行的较慢,因此GLP从灵芝内部扩散到外表面主体溶液就是溶出过程的控制步骤,是影响萃取率的主要因素。
1.2.4 连续相变萃取GLP模型建立 将粉碎过20筛网后灵芝干粉假设为理想的球状颗粒,同时连续相变萃取GLP是非稳态扩散过程,颗粒中多糖扩散沿颗粒内部径向进行,且在任何时间内颗粒内多糖均匀分布;同一温度以及流速下多糖扩散系数恒定,无轴向扩散系数以及无颗粒表面传质阻力[18]。
因此,采用基于Fick第二扩散定律的一阶扩散模型来研究连续相变萃取GLP的动力学。
式(1)
式中:r为到球形颗粒中心的距离(m);C为在r和t(min)时GLP的有效扩散浓度(mg/mL);t为萃取持续时间(min);D为有效扩散系数(mm2/min)。
根据傅里叶变换法[19]求得:
式(2)
式中:C0和C∞分别为初始t时刻和溶出达到平衡时多糖有效扩散浓度(mg/mL);在初始时C0=0,浓度的高次项趋近于零可以忽略不计,因此n=1时,两边取对数得:
式(3)

式(3)即为连续相变萃取GLP的动力学模型方程,该模型不仅表征了灵芝颗粒大小、萃取温度、萃取流速以及萃取时间与多糖质量浓度之间的关系,还可通过求解相关动力学参数,验证实验数据与动力学模型计算值的吻合程度。
1.2.5 GLP分子量测定 采用岛津高效液相色谱仪配备示差折光检测器,凝胶色谱柱TSKgel G6000 PWxl与TSKgel G 3000PWxl串联,流动相为0.02 mol/L Na2SO4,流速为0.6 mL/min,检测时间为50 min,柱温为35 ℃,上样体积为20 μL。称取相对分子量为5×103、1.2×104、5×104、1.5×105、2.7×105、4.1×105、6.7×105以及1.5×106Da的葡聚糖标准品用流动相溶解后过0.45 μm滤膜进样,记录色谱图。得到葡聚糖分子量对数lg M与洗脱体积的曲线,并对曲线进行线性拟合,用于确定待测样品多糖分子量分布范围[20]。线性方程为y=-0.4726 x+12.70(x为洗脱体积,y为相对分子量对数lg M),线性决定系数R2=0.9921。在同等条件下测定GLP样品,并利用样品洗脱体积计算其分子量[21]。
1.2.6 傅里叶变换红外光谱分析 称取1 mg干燥的GLP与100 mg KBr 粉末于玛瑙研钵中研磨混合均匀,压成薄片,在波数4000~400 cm-1范围内利用红外光谱仪进行光谱扫描[22]。
1.2.7 扫描电镜分析 利用扫描电子显微镜法分析GLP形态结构。将冻干GLP裱在铜桩上面,置于离子溅射仪中,在10 mA电流的条件下喷镀铂金1.5 min,使材料表面上镀上一层铂膜,然后利用扫描电镜观察不同倍数(50×、2000×、5000×)下GLP形态特征[23]。
1.3 数据处理
所有试验均重复3 次,结果以平均值表示,且标准偏差不超过5%;采用GraphPad Prism 5.0对试验数据进行绘图。
2 结果与分析
2.1 动力学模型的建立
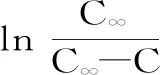
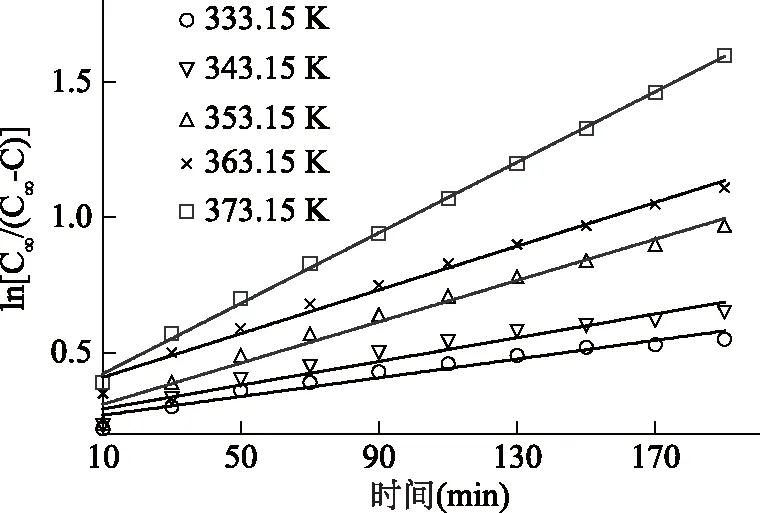
图1 不同温度下与时间的关系图
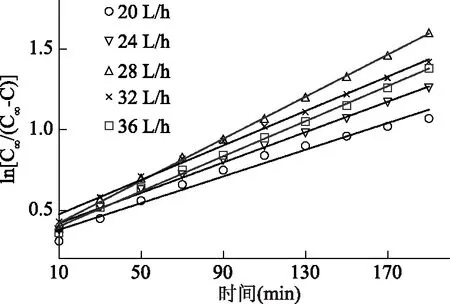
图2 不同流速下与时间的关系图

表1 不同温度下与时间的回归结果

表2 不同流速下与时间的回归结果
由表1以及表2可知,在不同温度以及不同流速下回归方程均显示出良好的决定系数(R2>0.94),说明实验数据与推导所得动力学模型式较符合。相同流速情况下,温度对萃取速率影响较大,表观速率常数k随温度升高而增大,表明升温能够加速GLP的溶出;相同温度情况下,随着流速的增加,速率常数k呈现先增加后减小的趋势,在流速低于28 L/h时,增加流速提高了灵芝干粉与溶剂间的接触面积,有利于多糖的溶出,而当流速继续增加到28 L/h以上时,k值减小,可能由于溶剂流速过大,难以在萃取容器出口端达到平衡条件,导致萃取速率放缓[24]。
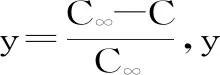
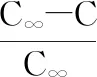
表3 不同温度下与时间的回归结果

图3 不同温度下与时间的关系图

表4 不同流速下与时间的回归结果
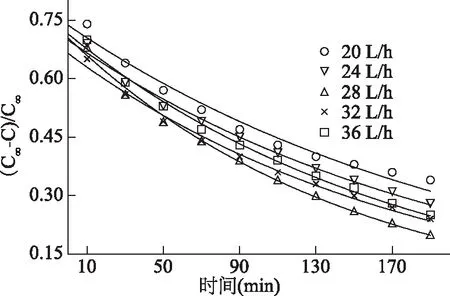
图4 不同流速下与时间的关系图
由图3、图4可得,随着萃取时间的增加,多糖相对萃余率呈指数趋势下降,因此延长萃取时间有利于多糖溶出。在相同流速情况下,随着温度升高,相对萃余率逐渐减小,表明温度越高越有利于多糖的溶出,在温度为373.15 K时曲线有最大斜率值,表明在该温度下萃取速率达到最快。在相同温度情况下,当流速低于28 L/h时,相对萃余率随着流速的增加而减小,表明增加物料与溶剂的接触面积有利于多糖的溶出,继续升高流速,相对萃取率则出现回升,表明物料与溶剂间存在最佳接触面积以及接触速率,过高或过低流速均不利于多糖的溶出。由表3、表4可以看出,在不同温度以及不同流速下,拟合方程决定系数R2均在0.93以上,表明萃取过程较符合指数模型且试验数据与方程吻合程度也较高。
2.1.3 半衰期求解 由半衰期t1/2=ln2/k对萃取温度作图,并进行拟合,方程为y=-7.440x+2864.4,R2=0.9337。由此可以计算出在最适萃取温度下,萃取出一半灵芝多糖所需的时间。半衰期可反应出萃取效率的高低,半衰期越小则萃取效率越高。由图5可以看出半衰期随着萃取温度的增加不断减小,表明升高温度有利于GLP萃取,能明显缩短萃取时间。
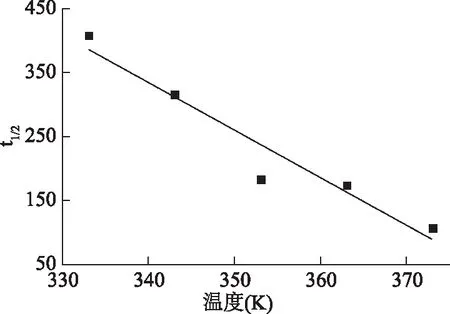
图5 t1/2与温度关系图
2.1.4 相关热力学性质 由Van’t Hoff方程lnk=-ΔHθ/RT+ΔSθ/R以及ΔGθ=ΔHθ-TΔSθ可分别计算出吉布斯自由能ΔGθ、焓变ΔHθ以及熵变ΔSθ。
由表5中可以看出,萃取过程中的焓变ΔHθ和熵变ΔSθ均为正值,表示连续相变萃取灵芝干粉是一个吸热过程,这个现象符合预期,因为多糖是从固相(灵芝干粉)中转移到液相溶剂(水)中。吉布斯自由能ΔGθ均为负值表明GLP的萃取过程是自发过程,自由能的变化趋势与温度的变化趋势相反,自由能的大小随着温度的增加而减小,温度越高自由能越小,萃取过程就越容易进行。

表5 GLP萃取过程中的各热力学参数
2.2 多糖结构分析
2.2.1 多糖分子量分布 图6为GLP的HPGPC检测图谱,按出峰时间将GLP分为不同的组分。分子量分别为2.26×107、5.56×105、2.67×103以及1.35×103Da。低分子量比高分子量显示了更大的峰面积,表明连续相变萃取GLP的主要组分为分子量<105Da的生物小分子[25]。
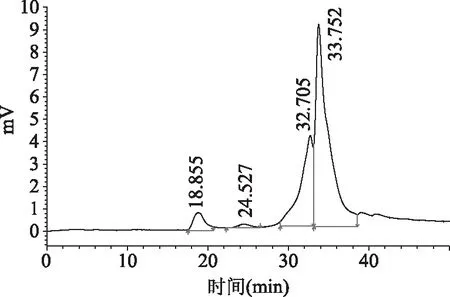
图6 GLP的HPGPC图谱
2.2.2 多糖红外光谱分析 如图7所示,红外光谱显示4000~400 cm-1呈多糖类物质的特征吸收峰,3363.70 cm-1附近的强吸收峰、2939.40、1625.92以及1151.45 cm-1是多糖物质的特征吸收峰表示为O-H伸缩振动、C-H伸缩振动、酰胺键的C=O吸收峰以及C-C骨架伸缩振动[26];1400~1200 cm-1存在两个吸收峰,为C-H的变角振动和C-O的弯曲振动[27];1080.09和1045.37 cm-1为吡喃糖苷的特征吸收峰[28];885.28 cm-1是β-吡喃环C-H的弯曲振动特征峰[29];765.70 cm-1是α-端基差向异构体的C-H变角振动[30];636.48、524.61 cm-1处弱的吸收峰可能是酰胺中的-NH2扭曲振动形成的[31];由此可知,GLP为β-吡喃型多糖。
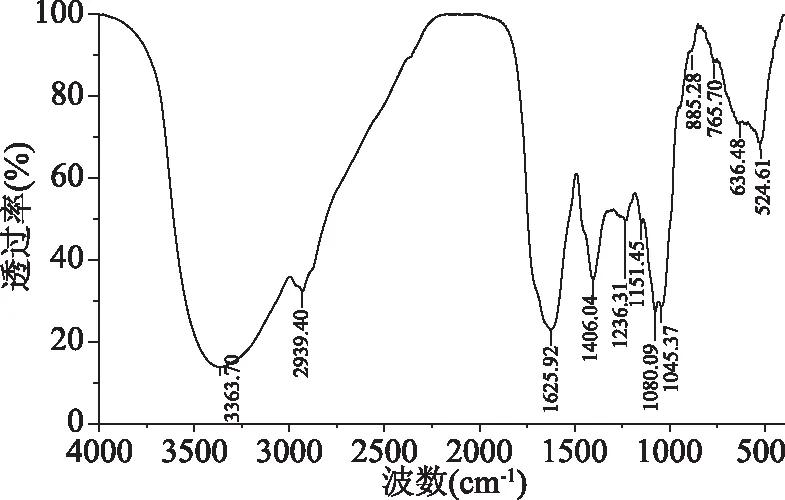
图7 GLP的红外光谱图
2.2.3 扫描电镜分析 图8(A)显示在低倍镜下可以看出多糖层叠到了一起、形状不规则且表面有较多褶皱;图8(B)可以看出其主要由碎片状聚集体所堆积组成,规整性不强,分布不均匀,并伴有少量丝带状连接结构;图8(C)则能看到GLP呈现大量小碎片状态并混有极少量的较大片层,碎片间联系紧密,间距较小,同时可以观察到表面平整光滑,这可能是由于许多不同结构或分子量的多糖在较强的分子间作用力下聚集成不定型结构,形成宏观状态下的结构和形貌特征[32]。

图8 GLP的SEM图
3 结论
以灵芝为原料,根据Fick第二定律建立起GLP的连续相变萃取一阶扩散模型,此模型在一定程度上可以反映灵芝颗粒半径、萃取温度、流速以及萃取时间与多糖萃取液质量浓度之间的关系。并求得了不同温度或不同流速下的速率常数、相对萃余率、半衰期等动力学参数,确立了萃取过程中的速率常数从333.15 K下的0.0017 min-1变化到373.15 K下的0.0065 min-1,相对萃余率符合中草药溶出指数方程模型,温度越高,半衰期越小,萃取效率越高。在温度373.15 K、流速28 L/h以及萃取时间190 min时有最大多糖得率2.04%。同时分析了热力学过程,结果显示GLP萃取是一个自发吸热的过程,萃取过程中吉布斯自由能随温度的增加而逐渐减小。试验求得的动力学参数以及热力学参数可为连续相变萃取灵芝多糖工业化生产提供数据参考和指导。本结果也可为天然活性物有效成分的生产工艺设计及操作条件的选择和优化提供有价值的依据。
高效凝胶渗透色谱法分析GLP分子量分布范围为1.35×103~2.26×107Da,分子量分布范围广,不同分子量组分在GLP中占比差异大。红外光谱表明GLP是一种β-吡喃型多糖,样品中有少量蛋白质或氨基酸分子基团。扫描电镜结果表明GLP呈褶皱状,由碎片状聚集体所组成,大小不均匀。因此,通过连续相变萃取得到的GLP可能具有较复杂的结构,而多糖具有的多种生物活性则与其较复杂的结构有密切联系,有必要进行进一步的生物活性评价如体外细胞抗氧化、抗衰老活性、体外细胞和动物体内的免疫调节、抗肿瘤活性等,从而为推广灵芝食用菌资源的高效利用和其活性成分的开发提供科学依据。

