胸腺肽α1联合阿帕替尼对原发性肝癌TACE术后患者免疫功能及疗效的影响*
段瑞芳,杨道坤,魏帅,陈宝鑫,司常云
(新乡医学院第一附属医院 感染科,河南 新乡 453000)
原发性肝癌(primary hepatic carcinoma, PHC)为全球发病率极高的肿瘤之一,其恶性程度高,患者预后极差[1-3]。因为PHC 的发生隐匿,进展迅速,所以被诊断时已错失手术切除机会,但患者可以接受经导管动脉栓塞化疗(transcatheter arterial chemoembolization,TACE)[4]。通过肝动脉化疗栓塞阻碍血液到肿瘤组织,引起组织坏死,是TACE 治疗的主要原理[5]。但是在肿瘤组织被阻断供血时,肿瘤血管再生及侧枝循环形成风险增加,这也是肿瘤易复发的主要原因[6]。而阿帕替尼能够与肿瘤血管生成密切相关的血管内皮细胞生长因子-2(vascular endothelial cell growth factor-2, VEGF-2)结合,抑制肿瘤血管形成,抗肿瘤效果显著[7-8]。但是很多PHC 患者在接受TACE 及阿帕替尼治疗后,仍有复发可能,这可能与患者肿瘤生物学特性、机体免疫功能低下等密切相关[9]。胸腺肽α1 能够激活免疫细胞,已被证明可刺激淋巴细胞的产生和调节免疫[10]。为达到综合治疗效果,本文主要研究胸腺肽α1 结合阿帕替尼对TACE 术后PHC 患者免疫功能和疗效的影响。
1 资料与方法
1.1 一般资料
选取2016年1月—2018年4月于新乡医学院第一附属医院就诊的84 例确诊为PHC 并接受TACE 治疗的患者。采用随机数字表法将患者分成对照组和实验组,每组42 例。随访1年后,实验组2 例患者病死,对照组9 例患者因疾病进展病死,故最后对照组和实验组分别为33 和40 例。对照组男性21 例,女性12 例;平均年龄(58.61±6.53)岁;平均病灶直径(3.80±0.55)cm;肝功能Child-pugh 分级B 级患者23 例,C 级10 例。实验组患者中男性32 例,女性8 例;平均年龄(57.03±6.82)岁,平均病灶直径(3.88±0.60)cm;肝功能Child-pugh 分级B 级患者27 例,C 级13 例。纳入标准: ①患者符合影像学(B 超或CT)及和/或穿刺活检的要求,并确诊为肝癌[11-12];②患者必须满足接受TACE 治疗的条件[12]: a.患者一般情况较差,综合评估后不能够耐受外科手术,或者小肝癌患者虽可接受手术治疗但不愿意进行手术和其他方式的局部治疗;b.肝功能Child-pugh 分级A 或B 级,C 级肝癌患者经积极治疗后达到A 或B 级;c.肿瘤占整个肝脏的比例需<70%;d.患者癌结节数量较多(≥3 个),外科手术治疗不是最佳选择;e.存在没有被完全阻塞的门静脉主干,或者是肝动脉和门静脉之间有代偿性侧支血管出现。排除标准: ①对阿帕替尼、胸腺肽α1 过敏;②严重心功能不全(3、4 级)、免疫缺陷和凝血功能严重减退,难以恢复治疗;③外周血白细胞和血小板严重减少,白细胞<3.0×109/L,血小板<60×109/L(不包括脾功能亢进所致);④肿瘤广泛转移,预计生存期<3 个月;⑤存在活动性的感染不能够同时接受治疗;⑥服药依从性差。
1.2 方法
两组均接受TACE 治疗,采用Seldinger 穿刺技术,将注射用顺铂60 mg 稀释后缓慢灌注,后将注射用表柔比星30 mg、罂粟乙碘油注射液3 ml 乳化后缓慢推注肿瘤供血动脉并形成血管栓塞。从术后第1 天开始,两组患者均口服阿帕替尼(艾坦),250 mg/d。实验组同时皮下注射胸腺肽α1 1.6 mg 治疗,2 次/周,间隔3 d,28 d 为1 个周期。
1.3 观察指标
①T 细胞亚群水平(CD3+、CD4+及CD8+)检测: 抽取患者接受TACE 前和治疗1、3 及6 个月后晨起空腹(未活动状态)外周静脉血2 ml,置于肝素抗凝管中,然后进行染色、洗涤及上机。1 500 r/min离心5 min,去除上清液,100μl PBS 重悬细胞,再加入100μl 萤光抗体PBS,遮光摇匀放置30 min,加入500μl PBS,混匀后5 000 r/min 离心5 min,除去上清液,再进行上述方法洗涤1 次,移入流式管后上机检测。所应用的仪器来自于美国BD 公司的六色流式细胞仪。②肝功能(ALT、AST 和TBIL)检测: 采集患者晨起空腹状态下TACE 术前及治疗1、3 和6 个月后静脉血,交由本院检验科检测。应用美国Beckman公司的全自动生化分析仪进行酶动力法检测。同时追踪Child-pugh 评分,记录1年后患者转归。③根据RECIST 1.1 制定的实体瘤疗效标准: 完全缓解(complete response, CR)、部 分 缓 解(partial response, PR)、疾病稳定(stable disease, SD)及疾病进展(progressive disease, PD)。疾病控制率=(CR+PR+SD)例数/总例数×100%[13]。④参照WHO抗癌药物不良反应分级[14]: 0、Ⅰ、Ⅱ、Ⅲ及Ⅳ级,研究进行期间密切观察两组患者所发生的不良反应,并及时给予适度干预。
1.4 统计学分析
数据分析采用SPSS 21.0 统计软件。计量资料以均数±标准差(±s)表示,比较用t检验或重复测量设计的方差分析;计数资料以率(%)或构成比表示,比较用χ2检验;等级资料以等级表示,比较用秩和检验,P<0.05 为差异有统计学意义。
2 结果
2.1 两组一般资料比较
两组一般资料比较,差异无统计学意义(P>0.05)(见表1)。实验组随访1年后病死率为4.76%,对照组为21.43%,经χ2检验,差异有统计学意义(χ2=5.126,P=0.024),对照组较实验组高。
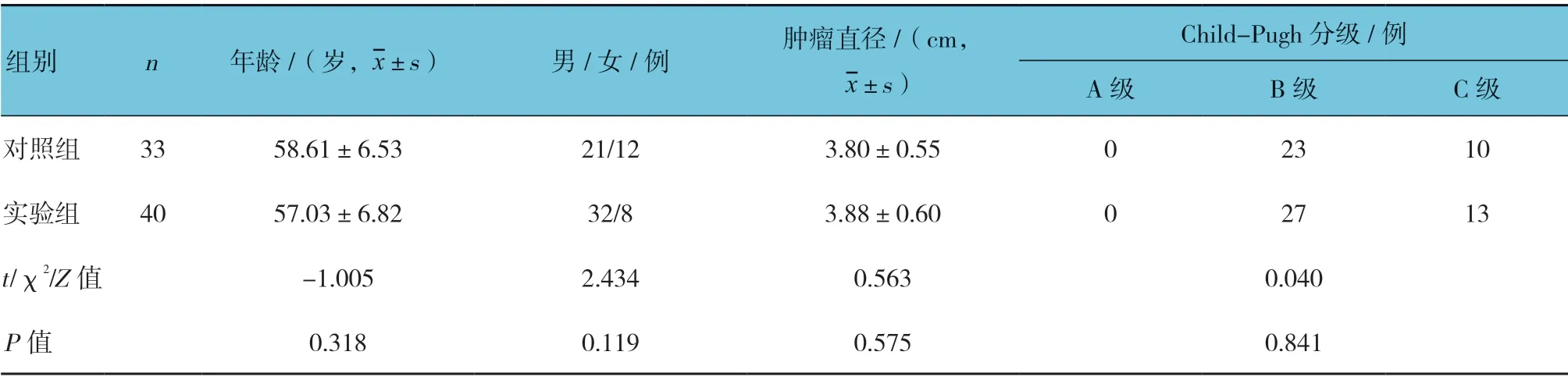
表1 两组基本资料比较
2.2 两组血清T 细胞亚群水平比较
对照组和实验组患者治疗前和治疗后1、3 及6 个月的CD3+、CD4+及CD8+水平比较,使用重复测量设计的方差分析,结果如下: ①不同时间点的CD3+、CD4+及CD8+水平比较,差异有统计学意义(F=43.995、177.042 和22.078,均P=0.000);②两组患者血清CD3+、CD4+水平比较,差异有统计学意义(F=9.474 和48.958,均P=0.000);③两组患者血清CD3+、CD4+及CD8+水平变化趋势比较,差异有统计学意义(F=25.572、204.667 和55.636,均P=0.000),随着治疗时间的延长,患者血清CD3+、CD4+水平呈升高趋势,血清CD8+水平呈下降趋势。见表2和图1~3。
表2 两组血清T 细胞亚群水平比较 (%,±s)
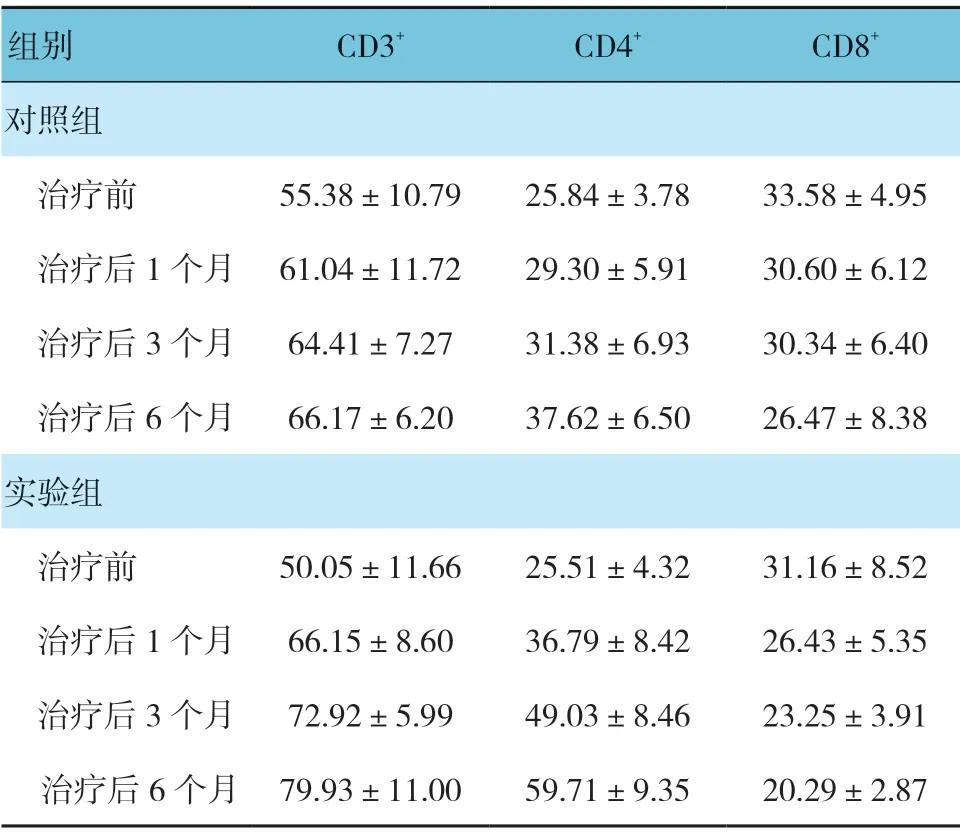
表2 两组血清T 细胞亚群水平比较 (%,±s)
组别 CD3+ CD4+ CD8+对照组治疗前 55.38±10.79 25.84±3.78 33.58±4.95治疗后1 个月 61.04±11.72 29.30±5.91 30.60±6.12治疗后3 个月 64.41±7.27 31.38±6.93 30.34±6.40治疗后6 个月 66.17±6.20 37.62±6.50 26.47±8.38实验组治疗前 50.05±11.66 25.51±4.32 31.16±8.52治疗后1 个月 66.15±8.60 36.79±8.42 26.43±5.35治疗后3 个月 72.92±5.99 49.03±8.46 23.25±3.91治疗后6 个月 79.93±11.00 59.71±9.35 20.29±2.87
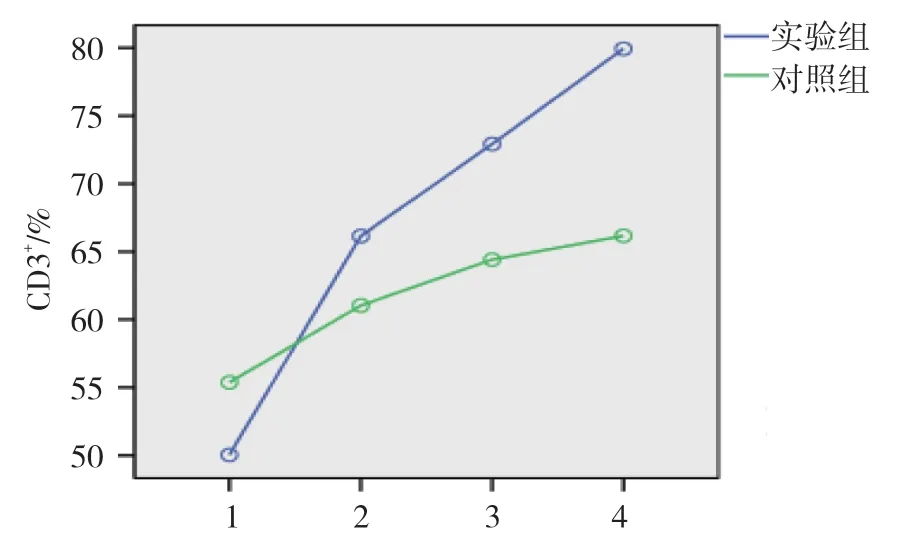
图1 两组血清CD3+水平变化趋势

图2 两组血清CD4+水平变化趋势
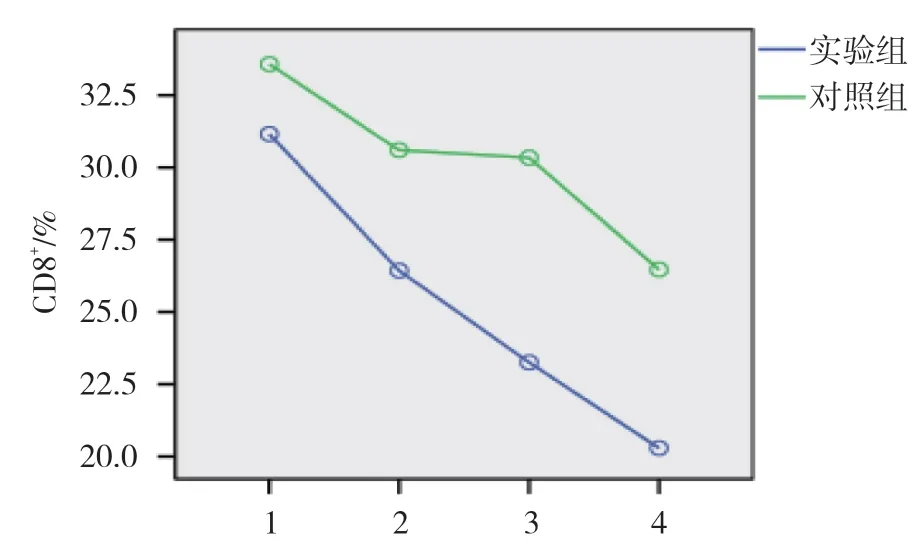
图3 两组血清CD8+水平变化趋势
2.3 两组肝功能及Child-pugh 分级比较
两组患者治疗前和治疗后1、3 及6 个月的ALT、AST 和TBIL 比较,经重复测量设计的方差分析,结果如下: ①不同时间点的ALT、AST 和TBIL 比较,差异有统计学意义(F=123.351、254.619 和77.229,均P=0.000)。②两组ALT 和AST 比较,差异有统计学意义(F=9.474 和7.704,P=0.004 和0.000);而两组TBIL 比较,差异有统计学意义(F=1.731,P=0.169)。③两组AST、TBIL 变化趋势比较,差异有统计学意义(F=26.035 和21.312,均P=0.000);而两组ALT 比较,差异无统计学意义(F=0.447,P=0.506),随着治疗时间的延长,两组AST 和TBIL 呈降低趋势。两组治疗后Child-pugh 分级比较,经秩和检验,差异有统计学意义(Z=-2.163,P=0.031)。见表3、4 和图4~6。
表3 两组治疗前后肝功能比较 (±s)
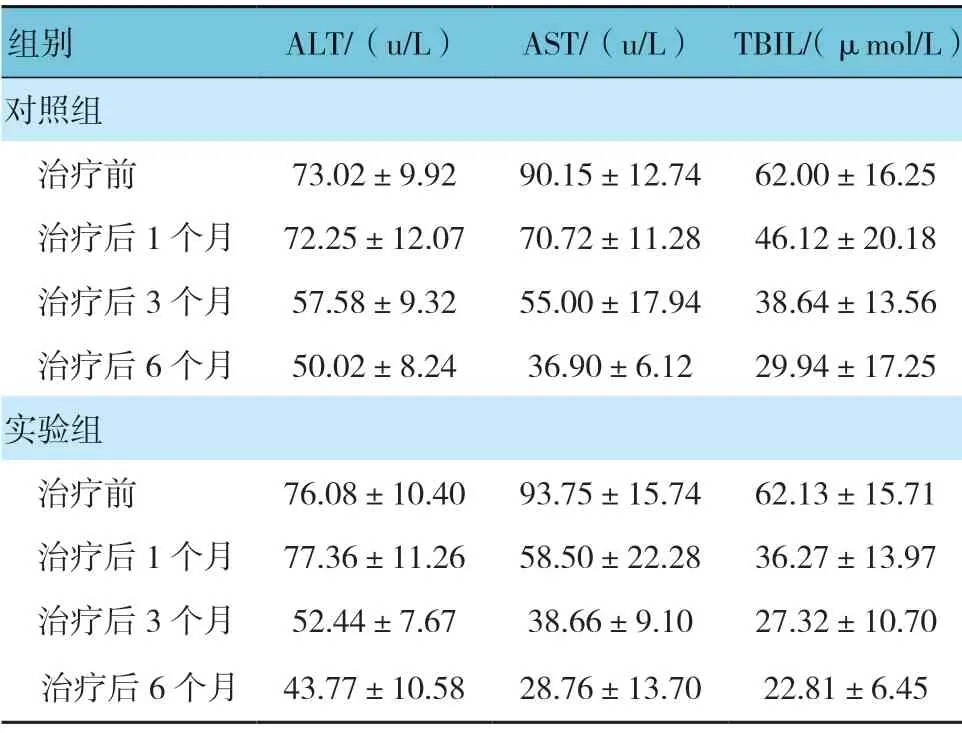
表3 两组治疗前后肝功能比较 (±s)
组别 ALT/(u/L) AST/(u/L) TBIL/(μmol/L)对照组治疗前 73.02±9.92 90.15±12.74 62.00±16.25治疗后1 个月 72.25±12.07 70.72±11.28 46.12±20.18治疗后3 个月 57.58±9.32 55.00±17.94 38.64±13.56治疗后6 个月 50.02±8.24 36.90±6.12 29.94±17.25实验组治疗前 76.08±10.40 93.75±15.74 62.13±15.71治疗后1 个月 77.36±11.26 58.50±22.28 36.27±13.97治疗后3 个月 52.44±7.67 38.66±9.10 27.32±10.70治疗后6 个月 43.77±10.58 28.76±13.70 22.81±6.45
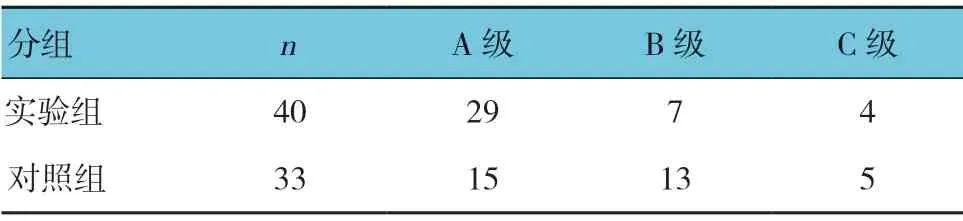
表4 两组治疗1年后的Child-Pugh 分级比较 例

图4 两组ALT 变化趋势
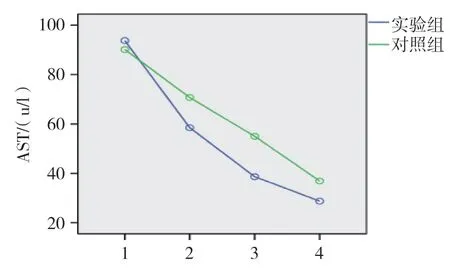
图5 两组AST 变化趋势
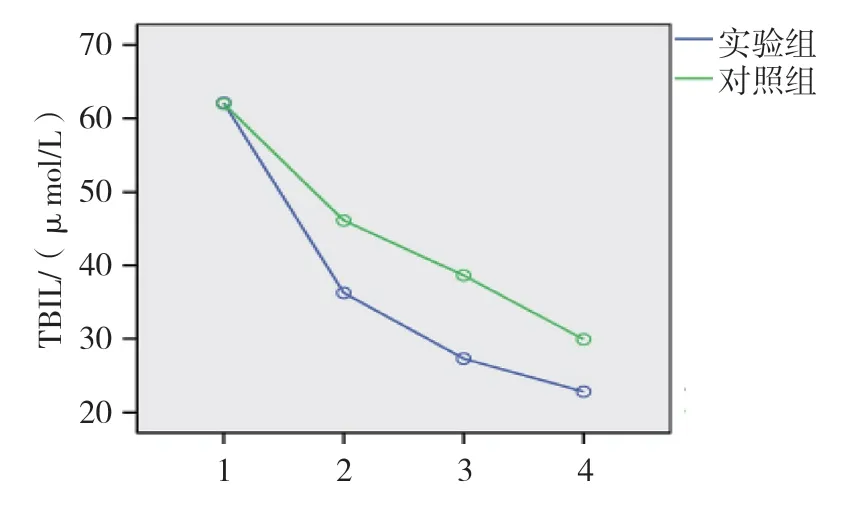
图6 两组TBIL 变化趋势
2.4 两组疗效比较
两组疾病控制率比较,经χ2检验,差异有统计学意义(χ2=6.563,P=0.010),实验组较对照组高。见表5。
2.5 两组不良反应比较
两组发热、白细胞减少、恶心呕吐、腹痛及肝损伤比较,经χ2检验,差异无统计学意义(P>0.05)。见表6。

表5 两组疾病控制率比较 (n =42)
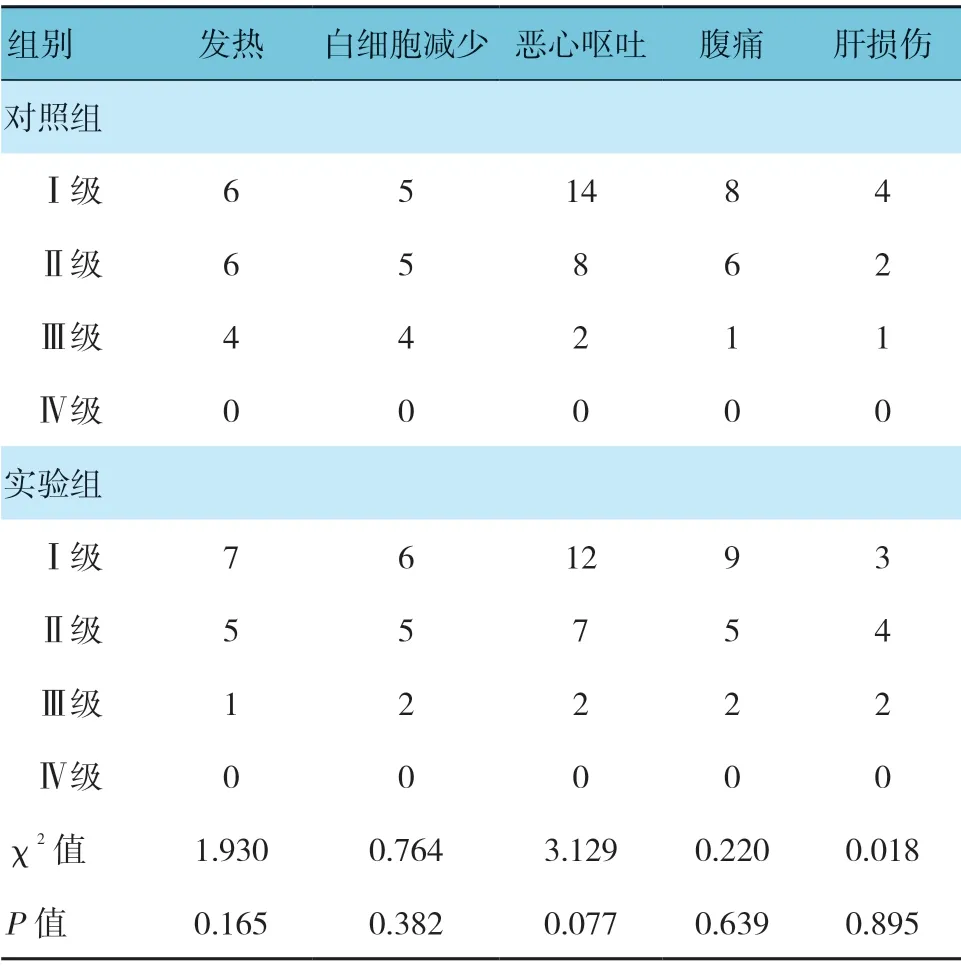
表6 两组不良反应比较 例
3 讨论
PHC 很常见,其发展速度迅猛,陈金东[15]统计显示2015年中国新增癌症病人数为429 万,其中肝癌患者所占比例为10.86%,癌症病死总人数为281 万,其中肝癌占15.00%。由此可见,肝癌的预防和治疗将继续成为中国肿瘤防控的重中之重。
经TACE 治疗后的肝癌患者,肿瘤血管再生及侧枝循环形成风险升高,故肿瘤复发率升高[16]。而VEGF-2 对于肿瘤血管形成至关重要,阿帕替尼和VEGF-2 结合的高亲和力,使其能够抗肿瘤[7-8]。但是有研究表明很多肝癌患者在接受TACE 及阿帕替尼治疗后,仍有复发可能,这可能与机体免疫功能低下有关。在肿瘤发生过程中最主要的细胞免疫过程是T 淋巴细胞所介导的免疫应答过程[17]。刘晓芬等[18]研究显示TACE 治疗后肝癌患者T 淋巴细胞和辅助性T 淋巴细胞数明显减少,抑制性T 淋巴细胞明显增加,最终抑制了拥有杀伤活性的T 淋巴细胞产生,导致肝癌患者免疫力低下。胸腺肽α1 是一种免疫细胞激活剂,它能够刺激淋巴细胞有丝分裂原加速T 淋巴细胞成熟,从而提高淋巴因子(α 干扰素、γ 干扰素、白细胞介素-2、白细胞介素-3 等)的浓度,同时增加T 细胞表面淋巴因子受体水平[19-20]。
本研究结果可知,两组患者治疗后血清CD3+、CD4+浓度较治疗前升高,CD8+浓度较治疗前降低,实验组下降更显著,CD3、CD4 T 淋巴细胞水平降低,通常反映机体免疫功能状态的降低,而CD8 为抑制性T细胞,水平升高,会降低机体免疫力,所以该研究表明使用胸腺肽α1 治疗后的患者免疫功能得到较好恢复。实验组患者ALT、AST 及TBIL 水平随着治疗时间的延长明显下降,且Child-pugh 分级转A 级患者较实验组多,ALT、AST 及TBIL 下降越显著,转A 级患者数越多显示肝功能恢复越好,故实验组患者肝功能恢复更佳;治疗1年后,实验组的疾病控制率高于对照组,而实验组病死患者数较少,所以该研究表明胸腺肽α1 能够为患者带来良好的疗效,降低病死率;患者主要的不良反应为阿帕替尼所致,不良反应发生率无差异。所以胸腺肽α1 的应用能够显著提高患者免疫力,改善肝功能,提高疾病控制率,降低病死率,且不良反应的发生无明显差异。
综上所述,虽然本研究证实了胸腺肽α1 对PHC患者的治疗作用,但同时存在随访时间短、样本量少、患者依从性差等问题,大样本、长期的研究需要进一步论证。

