手性5-异丙基-2-噁唑烷酮的酶催化立体选择性互补合成
徐 秦, 田嘉伟, 陈永正, 万南微*
(1. 遵义医科大学 a. 药学院; b. 贵州省生物催化与手性药物合成重点实验室; c. 贵州省绿色制药工程研究中心,贵州 遵义 563000)
手性噁唑烷酮不仅是许多药物和天然产物的核心骨架,而且是有机不对称合成中的重要手性辅基[1]。手性噁唑烷酮的化学合成往往需要使用有毒试剂或危险气体,反应条件苛刻,操作过程复杂[2-4]。生物催化反应因其条件温和,具有较高的化学、区域和立体选择性,在有机合成中的应用越来越重要,尤其是手性化合物的制备[5]。

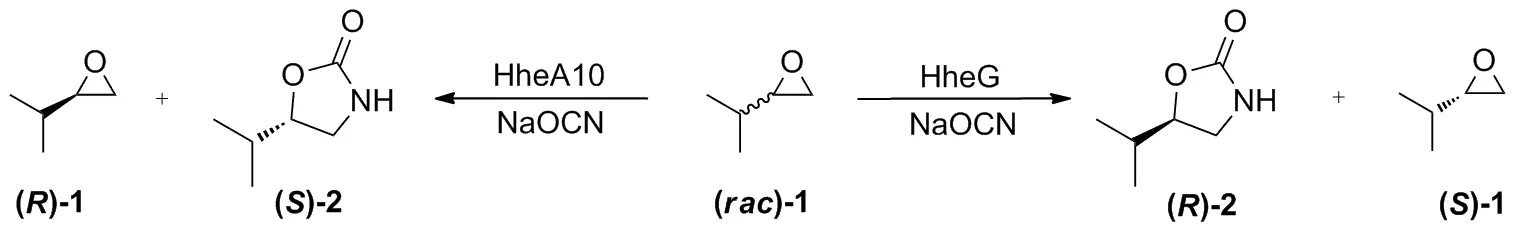
Scheme 1
1 实验部分
1.1 仪器与试剂
Agilent 400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Agilent 7890A型气相色谱仪。
氰酸钠和2-异丙基环氧乙烷,Alfa Aesar公司;其余所用试剂均为分析纯。
1.2 合成
5-异丙基-2-噁唑烷酮消旋体2: 白色固体,产率43%;1H NMR(400 MHz, CDCl3)δ: 6.21(s, 1H), 4.42~4.26(m, 1H), 3.58(t,J=8.6 Hz, 1H), 3.39~3.22(m, 1H), 1.89(d,J=13.4, 1H), 1.01(d,J=6.7 Hz, 3H), 0.92(d,J=6.8 Hz, 3H);13C NMR(100 MHz, CDCl3)δ: 160.6, 81.9, 44.0, 32.5, 17.7, 17.1。
1.3 生物转化
重组卤醇脱卤酶的表达和粗酶液的制备参考文献执行[11-12]。卤醇脱卤酶的初步筛选,用粗酶液作催化剂,反应条件如下:向10 mL反应器中加入含1和NaOCN的PB溶液2 mL,卤醇脱卤酶粗酶液3 mL, 30 ℃和250 rpm条件下反应6 h;反应结束后,加入3 mL乙酸乙酯萃取,分离有机相,经无水硫酸钠干燥后进行手性气相色谱分析。
卤醇脱卤酶HheA10和HheG整细胞反应条件如下:在10 mL反应器中,用5 mL缓冲溶液将收集的重组表达卤醇脱卤酶的大肠杆菌细胞重悬至一定细胞浓度;用DMSO作助溶剂,向体系中加入1母液后加入一定量的NaOCN,一定温度下,250 rpm下反应,反应结束后,加入3 mL乙酸乙酯萃取,分离有机相,经无水硫酸钠干燥后进行手性气相色谱分析。
2 结果与讨论
2.1 卤醇脱卤酶的筛选
以1为底物,NaOCN为亲核试剂,对11种卤醇脱卤酶催化剂进行筛选,反应结果如表1所示。HheA10具有较好的S立体选择性,可以获得92%ee和12%产率的2。卤醇脱卤酶HheA10对芳基卤代醇的脱卤反应表现出较好的S立体选择性[11]。此外,HheG表现出较好的R立体选择性,可以获得91%ee和9%产率的2。
表1 卤醇脱卤酶的筛选
Table 1 Screening of halohydrin dehalogenases
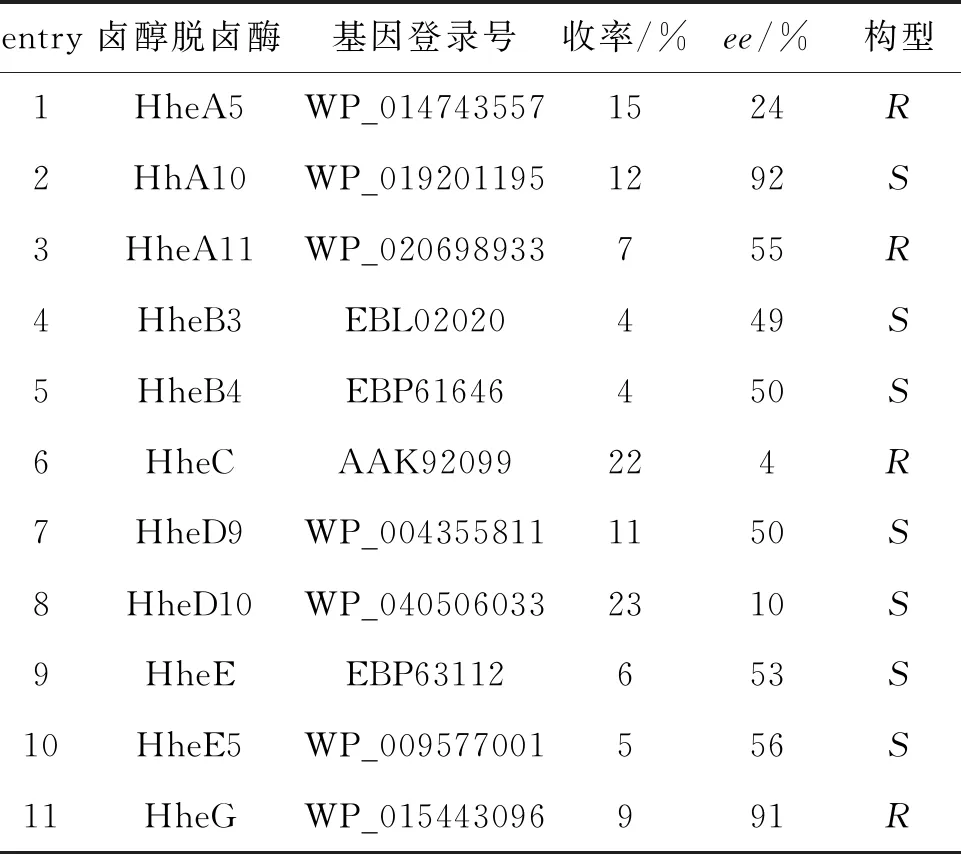
表1 卤醇脱卤酶的筛选
entry卤醇脱卤酶基因登录号收率/%ee/%构型1HheA5WP_0147435571524R2HhA10WP_0192011951292S3HheA11WP_020698933755R4HheB3EBL02020449S5HheB4EBP61646450S6HheCAAK92099224R7HheD9WP_0043558111150S8HheD10WP_0405060332310S9HheEEBP63112653S10HheE5WP_009577001556S11HheGWP_015443096991R
反应条件:底物终浓度10 mM, NaOCN终浓度15 mM, 30 ℃, 250 rpm反应6 h。
研究发现HheG对芳基取代的环氧化物表现出α-进攻开环区域选择性,但其拆分立体选择性较差[13]。然而,HheG对脂肪族取代环氧化物1却表现出β-进攻开环区域选择性和良好的立体选择性。卤醇脱卤酶HheC和HheD10可以获得22%和23%产率,但它们的立体选择性较差。其他卤醇脱卤酶对1的动力学拆分均表现中等立体选择性,获得24%~56%ee的2。
2.2 (S)-2合成条件的考察
考察了卤醇脱卤酶HheA10催化1动力学拆分合成(S)-2的反应条件。首先是对反应pH、缓冲溶液和反应温度的研究,结果如表2所示,发现HheA10合成(S)-2的最佳反应缓冲溶液为PB, pH 6.5。在此条件下,可以获得19%产率和93%ee。以较低pH或偏碱性的缓冲溶液作为反应溶剂时,HheA10的催化活性都有所下降,但对其立体选择性影响不大。对不同反应温度考察发现,在35 ℃条件下可以获得22%产率和91%ee的(S)-2,而其他较低或较高反应温度都引起了产率的降低,因此35 ℃为最适反应温度。
表2 反应pH、缓冲液和反应温度对HheA10合成(S)-2的影响
Table 2 The influences of reaction pH/buffer and temperature on the HheA10-catalyzed formation of (S)-2
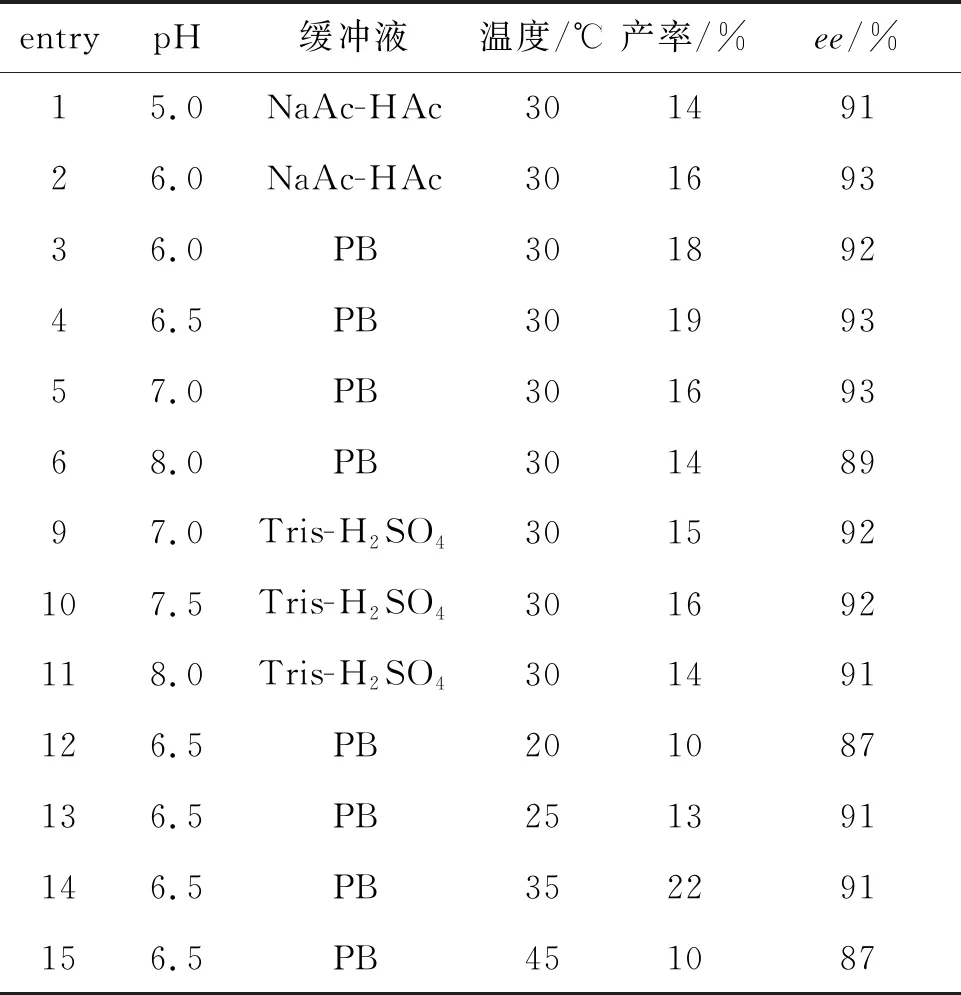
表2 反应pH、缓冲液和反应温度对HheA10合成(S)-2的影响
entrypH缓冲液温度/℃产率/%ee/%15.0NaAc-HAc30149126.0NaAc-HAc30169336.0PB30189246.5PB30199357.0PB30169368.0PB30148997.0Tris-H2SO4301592107.5Tris-H2SO4301692118.0Tris-H2SO4301491126.5PB201087136.5PB251391146.5PB352291156.5PB451087
反应条件:细胞浓度10 g cdw·L-1, 底物浓度10 mM, NaOCN浓度15 mM, 30 ℃, 250 rpm反应6 h。
对NaOCN当量比和生物催化剂添加量(细胞浓度)进行了考察,结果如表3所示, NaOCN当量比减少时,产率降低,表明该反应速率下降。随着当量比增加,产率随之增加;在当量比为在6/1时,产率达到最大值40%,继续增加当量比并未获得更高的产率。此外,增加当量比并未导致产物ee降低,表明卤醇脱卤酶HheA10具有较好的立体选择性。因此,确定该反应NaOCN的当量比为6/1。通过对不同细胞浓度研究发现,降低细胞浓度至5 g cdw·L-1,产率明显下降;增加细胞浓度至15 g cdw·L-1时,可以获得44%产率和93%ee;继续增加细胞浓度至20 g cdw·L-1时,产率略有增加,但ee值也有所下降。综合考虑产物2的产率和ee,确定最优的催化剂用量为15 g cdw·L-1。
表3 当量比与细胞浓度对HheA10合成(S)-2的影响
Table 3 The influences of ration and cell density on the HheA10-catalyzed formation of (S)-2
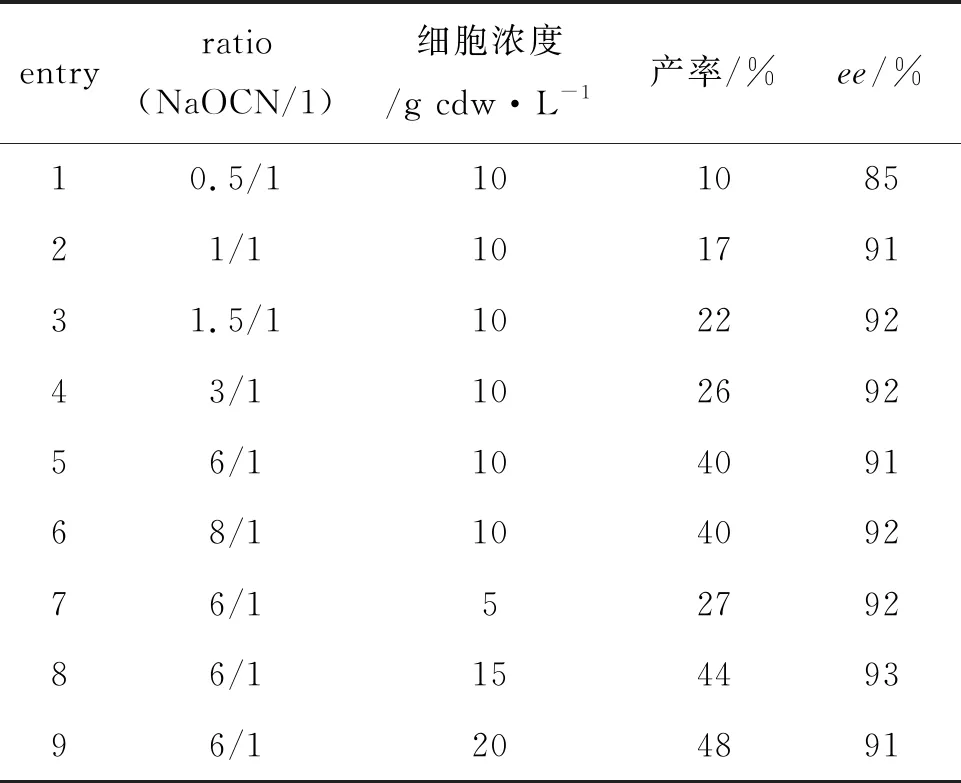
表3 当量比与细胞浓度对HheA10合成(S)-2的影响
entryratio(NaOCN/1)细胞浓度/g cdw·L-1产率/%ee/%10.5/110108521/110179131.5/110229243/110269256/110409168/110409276/15279286/115449396/1204891
反应条件:PB (pH 6.5)反应缓冲液,底物浓度10 Mm, 35 ℃, 250 rpm反应6 h。
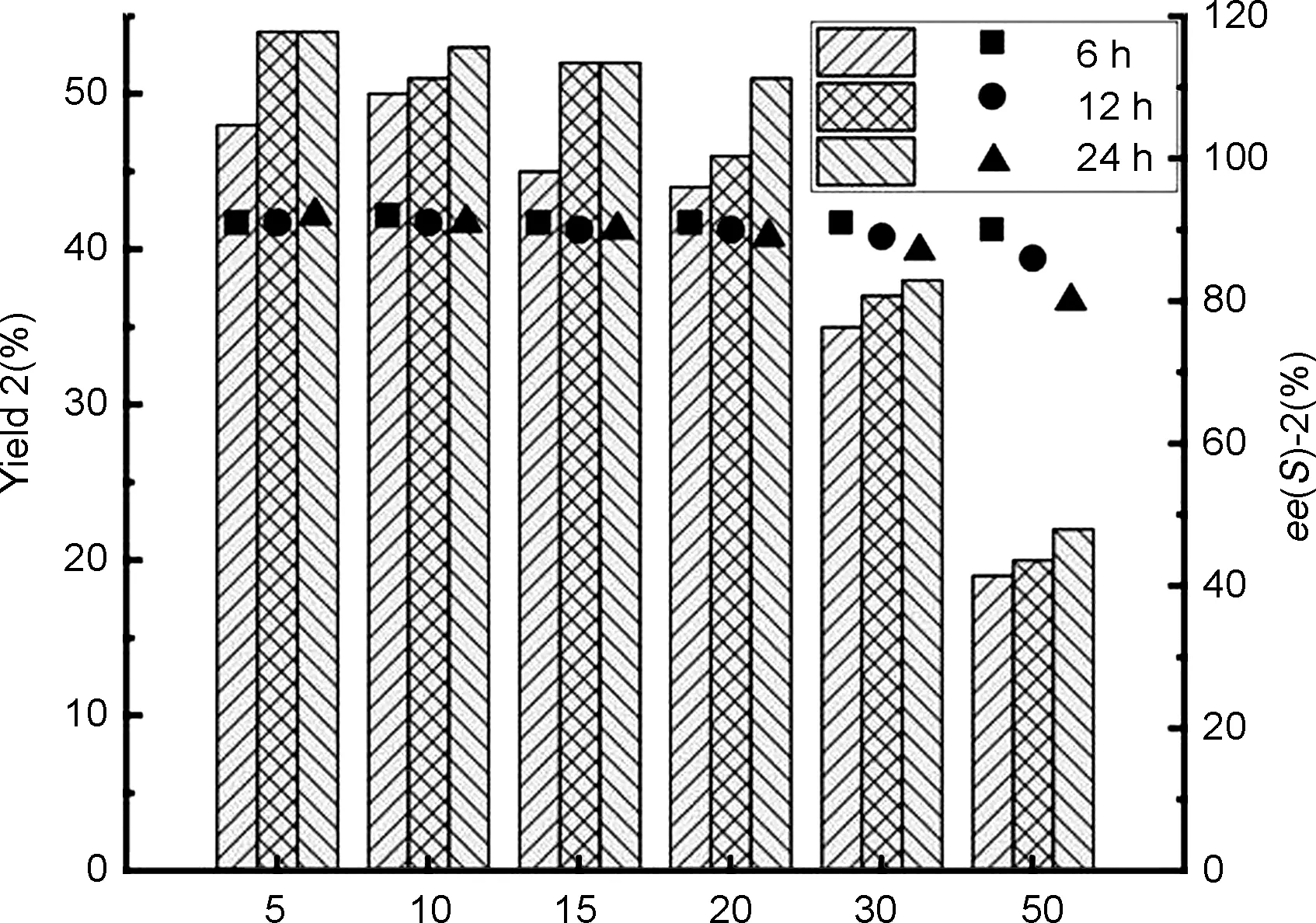
在确定最优反应条件后,对不同底物浓度的生物转化反应进程进行了考察,分别在6、 12和24 h对反应进行取样检测,研究结果如图1所示,当底物浓度在5~20 mM时,HheA10催化获得(S)-2的产率在50%左右,立体选择性保持在92%左右。当继续增加底物浓度至30 mM时,可以发现产率下降至40%左右,延长反应时间并未使产率得到明显提高。此外,反应的立体选择性有略微的下降;在反应24 h时,得(S)-2的ee为87%。进一步增加底物浓度至50 mM时,发现产物2的产率和ee都有明显的下降;在反应24 h时,得(S)-2的产率为22%,ee为80%。结果表明,当底物浓度超过30 mM时,会影响HheA10催化合成手性(S)-2的转化率和立体选择性。
mM
mM
2.3 (R)-5-异丙基-2-噁唑烷酮合成条件的考察
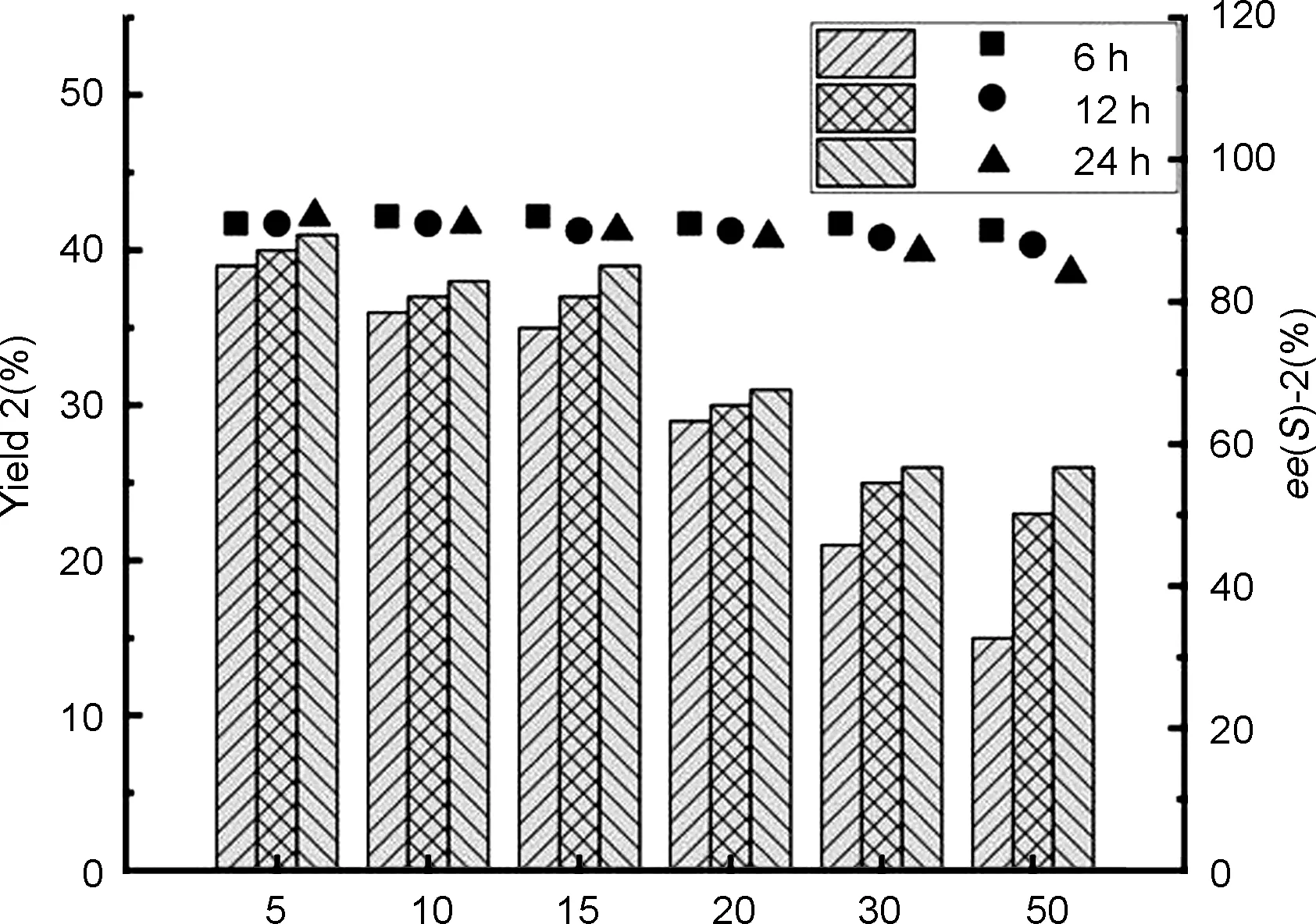
对HheG催化合成4-芳基取代噁唑烷酮的反应pH、缓冲溶液、反应温度、NaOCN当量比和细胞浓度进行考察后[13],针对HheG催化1合成手性(R)-2的最优条件直接参考前期的研究结果:PB缓冲液,pH 7.5, 30 ℃, NaOCN当量比3/1,细胞浓度为10 g cdw·L-1。在此基础之上,重点研究了HheG催化不同底物浓度1合成(R)-2的反应进程。同样在6、 12和24 h 3个时间点对反应进行取样检测,研究结果如图2所示,当底物浓度在5~10 mM时,HheG可以催化获得(R)-2的产率在40%左右,立体选择性保持在90%左右。当继续增加底物浓度至20 mM时,我们可以发现产率下降至30%左右,反应的立体选择性基本保持。当进一步增加底物浓度至30和50 mM时,发现产率明显下降,在反应24 h时的产率均为25%左右。此外,在30和50 mM底物浓度下,HheA10立体选择性性也有略微下降,反应24 h时,获得(R)-2的ee分别为87%和84%。结果表明,较高的底物浓度同样会影响HheG催化合成(R)-2的反应转化率和立体选择性。但与HheA10催化合成(S)-2的反应相比,该反应的立体选择性受底物浓度影响较小,宜在低于20 mM底物浓度下进行。
以2-异丙基环氧乙烷为底物,通过酶的筛选获得可以分别立体选择性合成(S)-5-异丙基-2-噁唑烷酮的卤醇脱卤酶HheA10,以及可立体选择性合成(R)-5-异丙基-2-噁唑烷酮的卤醇脱卤酶HheG。两种卤醇脱卤酶均表现出较好的催化活性和立体选择性,为手性5-异丙基-2-噁唑烷酮的合成提供了立体选择性互补的生物催化剂。

