棒曲霉素生物合成及分子调控研究进展
王艳玲,郭小洁,张紊玮,尚敏敏,宗元元,毕 阳
(1.兰州理工大学生命科学与工程学院,甘肃 兰州 730050;2.甘肃农业大学食品科学与工程学院,甘肃 兰州 730070)
棒曲霉素(patulin,PAT)分子式C7H6O4,相对分子质量154,化学名称为4-羟基-4氢-呋喃[3,2-碳]吡喃-2[6氢]-酮,是一种杂环内酮化合物,与黄曲霉毒素[1]、伏马毒素[2]、赭曲霉素[3]等属于聚酮类代谢产物[4-6],化学结构式如图1所示。PAT易溶于水、乙醇、丙酮、乙酸乙酯和氯仿,微溶于乙醚和苯,不溶于石油醚,最大紫外吸收波长为276 nm,耐酸、不耐碱,对光较敏感[7-9]。PAT主要由青霉属(Penicillium)、曲霉属(Aspergillus)和丝衣霉属(Byssochlamys)等丝状真菌产生[10-11],普遍存在于多种谷物、蔬菜、水果及其制品中[12],其中扩展青霉(Penicillium expansum)是产生棒曲霉毒素最主要的一种植物病原菌,能够引发苹果、梨、桃和葡萄等多种水果的青霉病,给水果产业带来巨大的经济损失[13-14]。

图 1 PAT化学结构式[2,6]Fig. 1 Chemical structure of PAT[2,6]
PAT是一类中等毒性物质,经国际癌症研究中心分类为第三类“未归类致癌物”。它能致畸、致癌、致突变且具有生理、遗传及细胞等多种毒性作用,严重危害人类的健康(表1)[15]。PAT通过诱导DNA链断裂、氧化损伤以及DNA链之间相互交联、产生核质桥等机制影响微核形成,从而引起DNA结构性损伤,产生遗传毒性,甚至导致突变等[16];PAT化学结构中的内酰基基团(C6端或C2端不饱和杂环内酯)能竞争性地与生物有机体内的活性物质、蛋白酶活性中心或细胞其他组分中的巯基发生作用破坏细胞功能,继而干扰正常新陈代谢[17];PAT还可共价结合细胞内亲核物质(如—SH、—NH2),特别是一些蛋白或谷胱甘肽(glutathione,GSH)上的活性巯基,导致细胞内GSH消耗和活性氧自由基浓度上升从而产生毒性,并破坏染色体和致突变[18-19]。PAT在不同动物中均引起不同的急性中毒反应,如产生呕血、腹泻、极度虚弱、嗜睡、呼吸急促和肺泡出血等现象,且致死量也有所不同[20],已有研究证明狗的半数致死剂量(median lethal dose,LD50)为10.4 mg/kgmb,小鼠的LD50为7.60 mg/kgmb,大鼠的LD50为5.80 mg/kgmb等[21];它在不同动物中致染色体畸变、致癌和致基因突变性质的差异较大,目前已发现PAT在大鼠、鸡胚以及各种哺乳动物的L5178Y、V79和FM3A等细胞中可致畸、致癌变等[22-23];PAT在不同类型细胞中(肝癌细胞、肺泡巨噬细胞、肠上皮细胞和胚肾细胞等)可表现出遗传毒性、免疫毒性及细胞毒性等[24-25]。鉴于PAT造成的巨大危害,真菌毒素的控制显得尤为重要。

表 1 PAT的健康危害[15]Table 1 Health hazards of PAT[15]
1 PAT生物合成的相关基因
随着棒曲霉(Aspergillus clavatus)、扩展青霉等全基因组测序和分析的完成,参与PAT生物合成的基因序列和功能已经较为清楚[4]。PAT基因簇长度约为40 kb,包括15 个相关Pat基因:11 个生物合成基因(PatB、PatD、PatE、PatG、PatH、PatI、PatK、PatN、PatO、PatF和PatJ),一个转录因子基因(PatL),3 个转运蛋白基因(PatM、PatC和PatA)。在不同的菌属之间,PAT合成基因簇基因的排布存在一定的差异(图2)[6,26-28]。在棒曲霉、扩展青霉和灰黄青霉(Penicillium griseofulvumi)中PAT生物合成基因簇均包含相同的15 个基因,其中扩展青霉和灰黄青霉PAT合成基因簇基因排布一致,与棒曲霉相比有较大差异,均能产生PAT;产黄青霉(Penicillium chrysogenum)、指状青霉(Penicillium digitatum)和意大利青霉(Penicillium italicum)中只含有PAT生物合成基因簇的部分基因,均不能产生PAT[6,27-29]。

图 2 扩展青霉、棒曲霉及相关青霉属中PAT基因簇示意图[6,26-28]Fig. 2 Schematic diagram of PAT gene clusters in Penicillium expansum and Aspergillus clavatus and related Penicillium[6,26-28]
参与PAT生物合成相关Pat基因的序列和功能绝大部分已经清楚(表2),包括:编码6-甲基水杨酸合酶的PatK;编码6-甲基水杨酸脱羧酶的PatG;编码细胞色素氧化酶的PatH和PatI;编码异环氧菌素脱氢酶(isoepoxydon dehydrogenase,IDH)的PatN;编码二氧合酶和异戊醇脱氧酶的PatJ和PatO;编码乙醇脱氢酶和葡萄糖-甲醇-胆碱(glucose-methanol-choline,GMC)氧化还原酶的PatD和PatE;编码新棒曲霉素合酶的PatF;编码醋酸盐、MFS和ABC的转运蛋白的PatA、PatC和PatM;编码C6转录激活因子的PatL。另外,最新研究证实PatB编码一种羧酸酯酶[30],但它具体如何参与并影响PAT的合成尚不清楚。扩展青霉基因组信息的挖掘大大促进了对PAT及某些次生代谢产物代谢通路和功能基因的认知[4]。
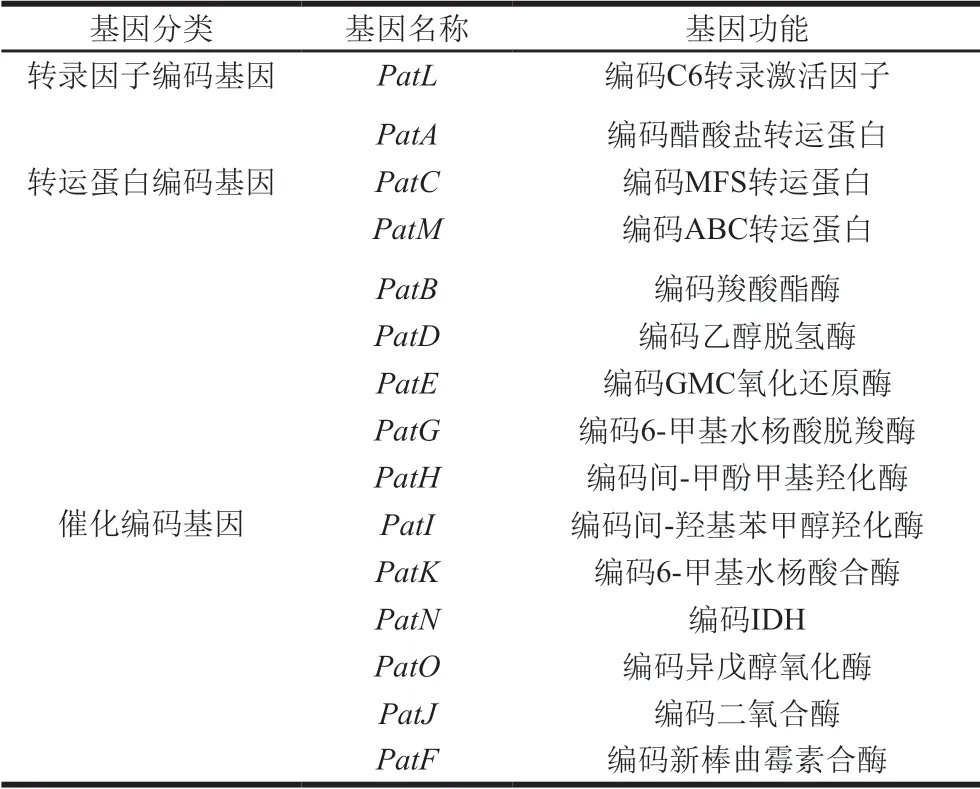
表 2 PAT合成基因簇及其功能[6]Table 2 PAT synthesis gene cluster and its functions[6]
2 PAT生物合成途径
目前,通过加入同位素标记物跟踪、敲除特定基因的突变菌株、监测中间产物的出现时间等方法已基本确定PAT的生物合成途径[15]。如图3所示,PAT的合成过程包括十步反应,在扩展青霉中已经发现了15 个与PAT合成相关的基因[27],其中已确定有10 个基因控制参与合成反应的酶,包括PatK、PatG、PatH、PatI、PatN、PatJ、PatO、PatF、PatD和PatE。首先,由PatK编码的6-甲基水杨酸合成酶催化一分子乙酰辅酶A和三分子的丙二酰辅酶A缩合生成6-甲基水杨酸,该反应是PAT合成中的第一步反应,也是PAT合成中最为关键的一步,同时也是第一步限速反应[32];第二步,由PatG编码的6-甲基水杨酸脱羧酶催化6-甲基水杨酸脱羧成间-甲酚,此反应为一个脱羧反应;第三步,由PatH编码的间-甲酚甲基羟化酶催化间-苯酚成间-羟基苯甲醇,此反应为羟基化反应,间-苯酚上甲基位置的一个H原子被羟基取代;第四步,由PatI编码的间-羟基苯甲醇羟化酶催化间-羟基苯甲醇成龙胆醇,但间-羟基苯甲醇催化生成间-羟基苯甲醛所参与的编码基因尚不清楚,其中在第四步到第五步反应过程中所涉及的中间产物尚存在争议[32-33],最新研究报道,并不存在间-羟基苯甲醇到间-羟基苯甲醛这一分支;第五步和第六步反应为非酶促反应,最新研究表明,叶酸的摄取恢复了ΔPePatJ和ΔPePatO中PAT的产生,表明PatJ和PatO参与了第六步反应,由PatJ和PatO所编码的催化酶都参与了由龙胆醛到异环氧菌素的转化;第七步,由PatN编码的IDH[6,34]催化异环氧菌素生成叶点霉素;第八步,PatF编码新棒曲霉素合酶催化叶点霉素形成新棒曲霉素;第九步,PatD编码的乙醇脱氢酶催化新棒曲霉素转化为E-ascladiol;第十步,由PatE编码的GMC氧化还原酶催化E-ascladiol形成PAT[35]。尽管PAT生物合成途径中绝大多数基因的功能得到了验证,要阐明PAT完整的生物合成途径及其分子调控网络,还要做更深入的研究工作。
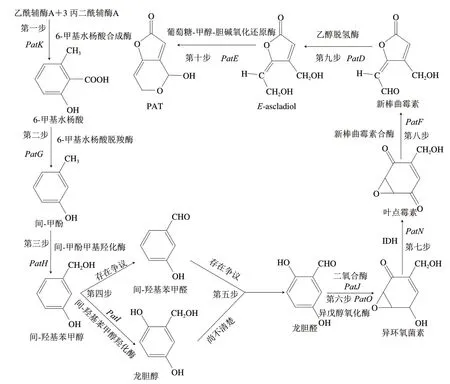
图 3 PAT的生物合成途径[15,31]Fig. 3 Biosynthesis pathway of PAT[15,31]
3 PAT合成的分子调控机制
PAT的生物合成是围绕Pat基因簇编码的催化酶、转录因子、相关转运蛋白等展开的一系列网式互作过程。尽管其合成途径已基本清楚,但代谢途径中涉及到相关基因的分子调控机制,相对而言研究较少。敲除或打断一些编码PAT合成催化酶的基因,导致PAT的合成受到严重影响。如Sanzani等[36]利用T-DNA插入的方法打断了PatK基因,突变型菌株产生的PAT含量明显低于野生型菌株,抑制了PAT的合成;Barad等[37]通过RNAi的方法抑制PatN的表达,将毒素产量降到野生型的10%左右;Li Boqiang[30]和Ballester[38]等通过基因敲除的方法将PatK、PatI和PatN完全敲除,结果表明这3 个基因的敲除突变株几乎完全丧失了PAT的合成能力。上述研究表明PatK、PatI和PatN是PAT合成的关键基因。PAT生物合成中除了受编码催化酶的关键基因决定之外,还受到一个编码基因簇特异性转录因子PatL基因的调控。PatL编码一个属于Zn(II)2cys6锌簇蛋白的特异性转录因子,它可作为中断剂促进PAT的产生,并影响除基因簇之外其他基因的表达[39]。这与黄曲霉素基因簇中编码的转录因子AflR很相似[40-42],AflR能够识别并结合黄曲霉毒素生物合成基因的启动子区特有序列(5’-TCGN5CGR-3’)[43],调控黄曲霉毒素的生物合成。当PatL基因敲除后,扩展青霉完全丧失了产毒能力,同时PAT合成基因簇内其他Pat基因的表达均显著下调,因此推断PePatL可能是通过在转录水平调控基因簇内其他Pat基因以及基因簇以外基因的表达来影响PAT的生物合成。
PAT的生物合成除了受特异性转录因子PatL调控之外,还受到与外界环境因素密切相关的全局性调控因子的调控。LaeA是丝状真菌中一个保守的次级代谢全局性调控因子,它可正向调控抗生素、真菌毒素等大量次级代谢物的生物合成,同时还影响菌体形态分化和发育[44]。在扩展青霉中敲除LaeA之后,PAT含量和PAT基因簇基因的表达均显著下降,其中PatB、PatC、PatM和PatN下调幅度最大,说明LaeA可以正向调控扩展青霉中PAT的积累[45]。外界的碳源和氮源均对PAT的生物合成有显著的影响[46],在含有不同类型碳、氮源培养基上,扩展青霉的生长状况和产毒素能力有所不同。果糖、蔗糖、葡萄糖、麦芽糖和淀粉更有利于PAT的产生和其合成基因簇相关Pat基因的表达,而乳糖、纤维素、苹果酸不利于毒素的生成和其合成基因簇相关Pat基因的表达;复合氮源如酵母提取物、蛋白胨和牛肉浸膏有利于毒素的生成和其合成基因簇相关Pat基因的表达,精氨酸和尿素不利于毒素的生成和其合成基因簇相关Pat基因的表达。AreA是一类含有锌指结构的GATA类调控因子,主要与Nmr互相协调共同参与氮源代谢的调控,并可直接调控丝状真菌次级代谢产物的合成[47-48],但其如何影响PAT的合成目前尚不清楚。CreA是一个全局性碳代谢调控因子[49],主要通过CCR Pathway在真菌碳代谢中行使着重要的功能,并影响次级代谢产物的生物合成[50]。在高浓度蔗糖条件下,扩展青霉中PAT的合成、PAT合成基因簇Pat基因和LaeA基因的表达均显著下降,CreA基因表达上升[51];然而敲除CreA之后,PAT的生成严重下调;LaeA与CreA具体如何协调参与调控PAT的合成还有待深入研究。pH值是影响PAT生成的另一个重要环境因子。在扩展青霉中偏酸的环境有利于PAT的积累和Pat基因的表达,偏碱的环境不利于毒素的产生和相关基因的表达[48]。定植于苹果上的扩展青霉在酸性环境分泌依赖于pH值调节的谷氨酸和氨离子[52],谷氨酸的积累由GOX2催化且很可能作为诱导PAT积累的前体物质并且会使环境pH值下降[53];氨离子的积累会诱导PAT积累及PacC表达的升高,同时会使环境pH值升高[54],可能通过激活pal的转录从而激活PacC。在有限碳源和酸性条件(pH 4.5)下,扩展青霉菌诱导氨积累并伴随着PacC和PAT积累的诱导增加[55]。在pH值影响条件下,体内PAT积累是一种依赖PacC的过程并且可以在酸性环境中积累,碳源作为氨代谢调节的主要限制因素,碳源的消耗限制了蛋白质的合成[56]。PacC是pH值依赖性基因表达调控的转录因子[57],参与一系列pH值响应基因的激活或抑制[58],在真菌适应环境pH值中起到重要的作用。它不仅是生长和发育的有效调节因子,也是控制丝状真菌致病性的关键因素[59]。Chen Yong等[60]研究发现PacC基因表达严格依赖于pH值,PacC的缺失导致在酸性和碱性条件下培养的扩展青霉的生长和分生孢子明显减少;在pH>6.0时完全丧失产毒能力,PAT基因簇中所有基因的表达均显著下调,PePacC有助于扩展青霉的分生孢子的生长和PAT的产生。
还有一些重要的环境因子(光照、温度、水分活度及气体成分等)及宿主自身类型也会影响PAT的积累[61]。光照也会影响真菌的生长和发育。真菌感受光刺激会做出反应,调整代谢通路来适应环境的变化。Velvet基因编码的VeA、VelB也是一种重要的光调控蛋白[62]。研究表明VeA与VelB与LaeA形成异源复合物参与了丝状真菌生长发育与次级代谢产物的合成[63]。在扩展青霉中,敲除VeA、VelB和VelC会严重影响PAT的生成及Pat基因的表达[32,64];在适合扩展青霉生长的温度范围内16 ℃最利于PAT的产生,但随着培养温度上升,PAT的产量会显著降低;同时水分活度偏低(低于0.85)也不利于毒素的积累[65],表明PAT的合成需要较高的水分活度。de Clercq等[66]发现低温低氧下,编码IDH的PatN基因表达和PAT的积累均下调;在低氧、高二氧化碳条件下也不利于PAT的生成。外源性的磷含量可以显著抑制苹果果实中扩展青霉的生长和PAT的产生,推测在转录水平上进行调控且主要作用于PAT生物合成的早期阶段[67]。宿主的种类、品种不同也会对PAT的积累产生很大的影响,可能因为宿主自身所含的糖、有机酸和蛋白质等营养物质不同,故而导致PAT的产生也不同[54,68]。PAT的生物合成受到C、N、pH值等多种外界环境因素的影响,可能是通过特异性转录因子(PatL)及全局性转录因子(CreA、AreA和PacC等)在转录水平上进行调节PAT的生物合成(图4)。丝状真菌的次级代谢途径非常复杂,许多的调控因子逐渐被鉴定,但是具体的调节机制还有待进一步研究。
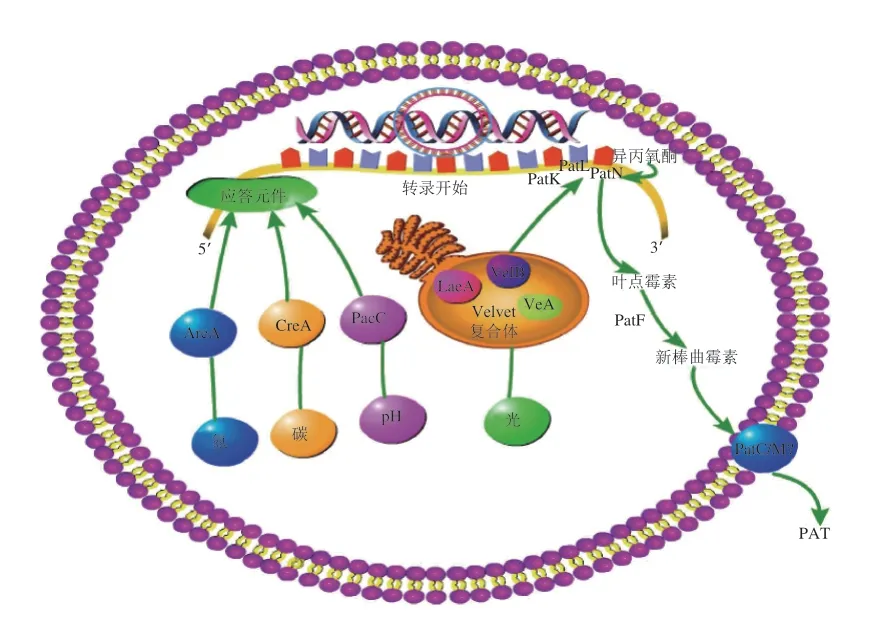
图 4 PAT生物合成的分子调控示意图Fig. 4 Schematic diagram of molecular regulation of PAT biosynthesis
4 结 语
PAT是青霉、曲霉和丝衣霉等丝状真菌自身生长过程中所分泌的一种次级代谢产物,PAT的生物合成受到产生菌与宿主之间、产生菌与环境等因素相互作用过程的综合调控[69-72]。目前,对真菌毒素的产生、检测以及毒性等方面的研究多有报道[73-74],但对毒素生物合成及调控机理方面的报道不多[75],所以更应该深入探究真菌毒素的生物合成途径及其合成中相关的基因及调控机制,以利于推动农业及食品等行业中真菌毒素的防控与去除。本文针对真菌毒素PAT的生物合成及分子调控进行了综述,分别阐释了PAT合成的相关基因、合成途径及相关酶、分子调控机制。PAT生物合成途径是一系列Pat基因编码酶催化的羟基化和脱氢反应,需要特异性和一些全局性转录调控因子的共同参与并需要Pat基因的表达。由PAT生物合成途径可以看出,毒素形成的差异主要是由代谢途径和基因差异决定的,如果能够调控合成途径中的关键基因的表达,则可以起到调控毒素积累的作用,如PatK、patI和patN等。真菌次级代谢基因一般成簇存在,这通常被认为与它们享有共同的染色质组织有关[76],染色质重塑等表观遗传调控机制在PAT等真菌次级代谢基因簇的基因表达调控中一定发挥着重要作用,但目前对其具体的作用机制研究还很少。因此,深入探究表观遗传调控机制在PAT等次级代谢物生物合成调控中的作用机理是今后研究的重要方向之一。
植物提取物例如各种植物精油、多酚及黄酮类物质可以抑制病原真菌的生长和毒素的积累,如精油葵醛能显著抑制扩展青霉的生长和PAT的产生,可抑制PAT合成中PatK、PatG、PatH、PatI和PatN等基因的表达[29];柠檬醛与大蒜油能够完全抑制扩展青霉的生长,姜黄油对PAT的合成具有显著的抑制作用[77];肉桂醛类、丁香油和茉莉酸甲酯等对扩展青霉的生长和产毒均有抑制作用[78];阿魏酸可有效抑制由扩展青霉引起的番茄果实腐烂,对防御相关的基因具有调控作用[79]。本课题组主要集中于PAT生物合成代谢调控机制及其对苹果青霉病生物防治方面的研究。目前通过体内和体外实验,结合蛋白质组学和转录组学技术,特别是对PAT生物合成中的作用机理和相关基因的表达展开了大量的研究。本课题组研究表明了阿魏酸、绿原酸及咖啡酸3 种植物源酚类物质对扩展青霉的抑制作用,通过3 种植物源酚类物质对扩展青霉孢子萌发率、生物量及抑菌圈直径研究发现抑菌效果并不明显,但是通过对苹果病斑直径的研究发现3 种植物源酚类物质对苹果青霉病有较好的抑制效果,并且3 种药物对扩展青霉在低浓度下抑制PAT的产生,高浓度下促进PAT的产生,这与Kumar等[51]研究绿原酸对扩展青霉产PAT的结果一致,绿原酸浓度较高时产PAT含量较多,反之亦然。Jiao Wenxiao等[80]研究发现,绿原酸对扩展青霉抑菌效果一般,但是能很好地抑制桃子青霉病的发生,这也与本课题组在苹果体内研究的结果一致,但具体是否对产PAT有影响,还需要进一步的研究。
真菌毒素对人畜的健康造成较大威胁,因此开展防控农产品中真菌毒素污染的研究显得尤为重要。化学杀菌剂虽然可有效控制扩展青霉引起的危害,但药物残留不仅会危害人类健康,还会导致扩展青霉产生抗药性和环境污染。因此,寻找安全、高效、环保的真菌毒素抑制剂便成为当前食品安全控制中亟待解决的问题。果制品品种多并且地域分布广,因而对PAT的产毒真菌的敏感性存在差异,目前主要是对一些相关Pat基因或关键酶进行单个的研究,缺乏整体且系统的探索。对于这些物质是如何调控PAT产生的分子机制目前尚不清楚。鉴于目前尚无理想的防控农产品PAT污染的措施,而来自植物体内的天然化合物又表现出抑制扩展青霉及真菌毒素的巨大潜力,应该进一步加强对PAT产生的途径和调控机理的系统研究,建立植物体内天然化合物调控PAT的代谢网络,遏制病原菌真菌毒素的代谢,降低农产品、食品受真菌毒素污染的风险,得到高效、经济、环保的产品以确保人类饮食健康安全。

