对羟基苯甲酸及其烷基酯在水包油乳液中抗氧化效率的假相模型解释
黄师荣,万 慧,颜思念,陈东方
(1.湘潭大学化工学院,湖南 湘潭 411105;2.湘潭大学“环境友好与资源高效利用化工新技术”湖南省高校2011协同创新中心,湖南 湘潭 411105)
脂类成分易被氧化。食品中的脂类氧化是食品腐败变质的原因之一,会降低食品的营养价值和安全性[1-2]。食品乳液(如牛奶、蛋黄酱、调味品、酱汁、饮料、冰淇淋等)由于界面面积更大,比本体油更容易被氧化[2-3]。目前,降低脂类氧化的最有效、方便和经济的方法是添加天然或合成抗氧化剂[4]。
植物中的酚类物质由于在自然界广泛存在,且安全、低毒,被广泛用作新型的天然抗氧化剂[5]。但是酚类物质极性较高,在非极性介质中溶解度较低,限制了其在乳化体系中的应用[6]。为此,近年来有学者对这些酚类物质进行了酯化修饰,以增强其疏水性,使其能更好地定位于氧化反应发生的油-水界面,从而改善其抗氧化性能[7]。然而,许多研究表明用不同链长正烷基醇酯化的酚类物质在乳液中的抗氧化效率会随着其疏水性增加而达到最大,进一步增加其疏水性则其抗氧化效率显著降低,表现出所谓的“截止效应”[8-10]。Barreiro等[10]用假相动力学模型解释了没食子酸及其丙酯、辛酯和月桂酯随着疏水性增加抗氧化效率达最大值的原因。他们的研究结果表明,没食子酸及其烷基酯的抗氧化效率与其在乳液界面区域的比例相对应。在其他条件都相同的情况下,乳液界面区域中比例最大的抗氧化剂效率最高。
假相模型是在20世纪70年代首次被提出,以测定均相缔合胶体如胶束、微乳液等的化学反应速率[10]。该模型同样适用于搅拌的乳液,可以用来测定乳液中油相、水相和界面区中的抗氧化剂质量分数,也可用来估算乳液中二级反应的速率常数,通过比较这些速率常数可以评估抗氧化剂的效率。目前,鲜有其他方法可以对这些参数提供可靠估算[10-11]。据报道,该模型具有很强的通用性,适用于不同实验条件下的各种抗氧化剂、油脂和乳化剂,该模型应用需要满足两个基本假设:1)所有组分在油相、界面和水相之间处于动态平衡,即反应物在乳液区域之间的传输速率比化学反应的速率快得多;2)抗氧化剂在油相、水相和界面区域之间的分布仅取决于其在每个区域中的相对溶解度,而与乳液中液滴的尺寸、形状或乳液类型无关[10-12]。
为验证这一模型的适用性,本实验研究了与没食子酸结构比较类似的对羟基苯甲酸(p-hydroxybenzoic acid,HA)及其烷基酯在均相甲醇溶液中和菜籽油乳液中的抗氧化效率。用假相动力学模型测定和计算了HA及其烷基酯在乳液界面中的分布,旨在为特定乳液体系确定最有效的抗氧化剂提供理论依据。
1 材料与方法
1.1 材料与试剂
HA(质量分数不低于99.0%)、对甲基苯磺酸(质量分数不低于99.0%)、对十六烷基苯胺(纯度97%)、亚硝酸叔丁酯(纯度90%)、三氟化硼乙醚(纯度98%)、盐酸萘乙二胺(分析纯)、正十二醇(质量分数高于98.0%)购自Macklin公司;Trolox(纯度97%)购自美国Sigma公司;1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)(纯度96%)购自日本和光纯药工业株式会社;分子筛、硅胶(200~300 目)、活性炭(200 目)购自国药集团化学试剂有限公司;氯仿、石英砂、四氢呋喃、无水乙醇、正丁醇、正辛醇、浓硫酸、乙酸乙酯、甲苯、正庚烷、正己烷、甲酸、甲醇、二氯甲烷、乙腈、无水乙醚、戊烷、硅酸、冰醋酸、磷酸氢二钠、磷酸二氢钠、亚硝酸钠、氯化钠、碳酸钠、对甲氧基苯胺、吐温20等试剂均为市售分析纯;菜籽油购自湘潭大学周边超市。
1.2 仪器与设备
Cary60型紫外分光光度计 安捷伦科技(中国)有限公司;PHS-3BW型pH计 上海般特仪器有限公司;ZF-7型三用紫外分析仪 上海杰涵实验设备有限公司;FJ-200型高速分散均质机 上海标本仪器厂;AVANCE III HD 400 MHz型核磁共振(nuclear magnetic resonance,NMR)波谱仪 瑞士布鲁克公司;380型傅里叶变换红外光谱(Fourier transform infrared spectrometer,FTIR)仪美国Thermo公司。
1.3 方法
1.3.1 HA烷基酯的合成及表征
HA乙酯的合成参考曾立华[13]的方法并稍作修改,将0.02 mol HA、0.4 mol乙醇和0.001 mol对甲苯磺酸加入到100 mL圆底烧瓶中,接上索氏提取器(装入适量分子筛以吸收反应中产生的水分)加热回流反应4 h。冷却后分别用质量分数10%的NaHCO3溶液、蒸馏水洗涤两次,分出上层液体并用无水硫酸钠干燥,抽滤,减压蒸馏蒸出未反应的乙醇。冷却至室温后所得产品用色谱柱纯化,纯化条件为等度洗脱,洗脱剂为三氯甲烷-乙酸乙酯(3∶1,V/V),每次收集10 mL,用薄层色谱(thin layer chromatography,TLC)检测确认后,合并相同的组分。TLC在FCP硅胶和GF254硅胶板上进行。流动相为氯仿-甲醇(9∶1,V/V)。在波长为254 nm的紫外光下观察斑点。
HA丁酯的合成参考项艳[14]的方法并稍作修改,将0.02 mol HA、0.4 mol丁醇和0.001 mol对甲苯磺酸加入到250 mL三口烧瓶中,接入预先装满丁醇的分水器加热到回流开始计时,反应至分水器中不再产生水为止,整个反应大约需要6 h。反应结束后,冷却至室温,分别用质量分数10%的NaHCO3、蒸馏水洗涤两次,分出上层液体并用无水硫酸钠干燥,抽滤,减压蒸馏蒸出未反应的丁醇。冷却至室温后所得产品用体积分数为50%的乙醇溶液进行重结晶,得到HA丁酯。
H A 辛酯和十二酯的合成参考侯艳冰等[15]的方法,将0.02 mol HA、0.06 mol辛醇(或正十二醇)、0.001 mol对甲苯磺酸和20 mL甲苯(带水剂)加入到250 mL三口烧瓶中,接上预先装满甲苯的分水器,加热到回流开始计时,反应至分水器中不再产生水为止。反应结束后,冷却至室温,分别用质量分数为10%的NaHCO3、蒸馏水洗涤两次,分出上层液体并用无水硫酸钠干燥,抽滤,减压蒸馏蒸出甲苯得到油状液滴,趁热将液滴滴到正庚烷中,冷却析晶、抽滤、干燥,得到HA辛酯(或十二酯)。
所得产物分别用1H NMR和FTIR进行分析。
样品的FTIR分析。取每种样品2 mg研磨成细粉,再加入适量干燥的KBr粉末混合(样品与KBr的质量比为1∶100),然后装入模具进行压片,最后将压片放入样品槽中,采用380型FTIR仪,在4 000~400 cm-1范围内进行FTIR测定。
样品的1H NMR分析。取适量(5~10 mg)纯化后的样品溶解于氘代氯仿中,然后用孔径0.22 µm微孔滤膜过滤于核磁管中,采用AVANCE III HD 400 MHz型NMR波谱仪测定氢谱,使用5 mm NMR探头,以四甲基硅烷(tetramethylsilane,TMS)作为内标。
1.3.2 DPPH自由基清除能力测定
参考Claudia等[16]的方法测定DPPH自由基清除能力,称取适量DPPH,用甲醇定容至100 mL,配制成150 μmol/L的DPPH溶液。称取适量6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox),用甲醇定容到100 mL,配制成600 μmol/L的溶液,然后再稀释成浓度分别为250、200、150、100、50 μmol/L的溶液。分别取0.5 mL Trolox稀释液和4.5 mL DPPH-甲醇溶液混合,振摇,置于暗处120 min后,用甲醇作空白,在515 nm波长处测吸光度。以Trolox浓度为横坐标,吸光度为纵坐标建立标准曲线,曲线斜率记为k1。取HA及其烷基酯样品代替Trolox试剂,同上步骤,建立以样品浓度为横坐标,吸光度为纵坐标的标准曲线,曲线斜率记为k2。样品的DPPH自由基清除能力由k2/k1计算得到,以Trolox当量(单位mmol Trolox/mol)表示。重复测定3 次,结果取平均值。
1.3.3 HA及其烷基酯对水包油乳液的抗氧化效率的测定
参考课题组前期方法[17]进行HA及其烷基酯对水包油乳液的抗氧化效率的测定,先将精制的菜籽油、0.04 mol/L柠檬酸盐缓冲溶液(pH 3)(菜籽油与柠檬酸盐缓冲溶液体积比为2∶8)、0.004 mol/L HA及其烷基酯和作为乳化剂的吐温20(体积分数分别为1%、2%、3%和4%)高速均质2 min制成不同的乳液。目视检查乳液的稳定性,以3~4 h内没有观察到相分离为准。将所得乳液避光保存于45 ℃烘箱中进行Schaal烘箱实验,在规定的时间取样测定其共轭二烯值和p-茴香胺值。共轭二烯值和p-茴香胺值的测定分别参考文献[18]和[19]的方法进行。
1.3.4 无乳化剂下HA及其烷基酯在油相和水相之间的分配常数的测定
在无乳化剂的情况下,使用改进的摇瓶法[20]测定油相和水相之间的分配常数(PWO)。将HA及其烷基酯分别加入到2 mL精制菜籽油和8 mL酸性水溶液(0.04 mol/L柠檬酸盐缓冲液,pH 3.0)中,使HA及其烷基酯的最终浓度为4 mmol/L,高速均质1 min。然后缓慢搅拌混合物至少1 h,并使其在室温下平衡至少24 h。通过离心分离油相和水相,并分别测定其吸光度,借助于预先制作的标准曲线测定水相和油相中HA及其烷基酯的浓度。通过式(1)~(3)计算PWO。

式中:分别为抗氧化剂在水相和界面以及油相和界面之间的分配常数;%AOO和%AOW分别为抗氧化剂在油相和水相的质量分数(摩尔分数);VW和VO分别是水相和油相的体积/L;[AOO]表示抗氧化剂在油相中的浓度/(mol/L);下标O、I和W分别表示油相区、界面区和水相区。
1.3.5 乳液中4-十六烷基重氮苯和HA及其烷基酯之间的反应表观速率常数kobs的测定
参考Doyle等[21]的方法测定乳液(吐温20体积分数分别为0.5%、1%、2%、3%、4%、5%)中4-十六烷基重氮苯和H A 及其烷基酯之间的反应表观速率常数kobs,该方法利用4-十六烷基重氮苯(16-Ar)与偶联剂N-(1-萘基)乙二胺(N-(1-naphthyl)ethylenediamine,NED)能快速反应生成稳定的偶氮染料,该染料用乙醇-丁醇(1∶1,V/V)溶液稀释后能得到光学透明的均相溶液,该溶液在λ=572 nm波长处的吸光度与未反应的16-Ar浓度呈线性关系。故可用偶氮染料的吸光度随时间变化来确定表观速率常数kobs。具体步骤如下:将16-Ar配制成0.17 mol/L的乙腈溶液,取20 µL该溶液加入到乳液中以使其和抗氧化剂进行反应。以一定时间间隔(由16-Ar与抗氧化剂之间的反应半衰期而定)取出200 µL反应物,并立即加入预先装有2.5 mL含0.02 mol/L NED的乙醇-丁醇溶液(1∶1,V/V)的试管中,以使NED和未反应完全的16-Ar反应生成偶氮染料。测定偶氮染料在λ=572 nm波长处的吸光度。由于[AO]>>[16-Ar],所以NED和16-Ar的反应属于假一级反应,因而,样品吸光度的对数与时间的关系如式(4)所示。
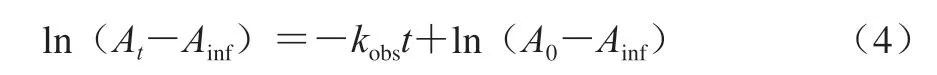
式中:A0和At分别为样品在0和t时刻的吸光度;Ainf为样品反应完全时的吸光度。
1.3.6 乳液中分配常数和表观速率常数kobs间的关系
乳液中分配常数和表观速率常数kobs间的关系根据假相动力学模型[10]得出。
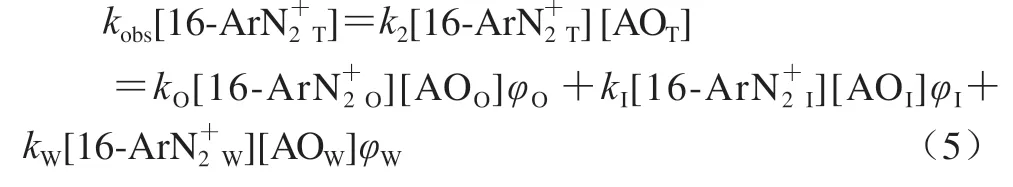
式中:k2是表观二级速率常数/(L/(mol·s));kO、kW和kI分别表示油相、水相和界面区域中二级速率常数/(L/(mol·s));[]表示乳液中各物质的浓度/(mol/L),下标T表示总量,下标O、I和W分别表示在油相区、界面区和水相区;φ是某个区域的体积分数/%,定义为某区域体积比乳液总体积。

结合式(6)与式(1)~(3)和相关质量平衡方程,把表观一级速率常数与可测参数关联起来,可以得出方程式(7)[22-23]。

对于亲水性中等的HA-C2、HA-C4和HA-C8(其分别为6.1、36.1和84.2),由于其在油相区、水相区和界面区的量都比较大,用和两个分配常数来描述它们的分布。但是对疏水性很强或亲水性很强的抗氧化剂,它们的分布描述可以简化。例如亲水性很强的抗氧化剂HA(=0.13)主要分布在水相区和界面区,其在油相区内的浓度基本上为零。因而,只需要PWI 来描述其分布,kobs和φI间的关系由式(8)给出。然而,对于疏水性很强的抗氧化剂HA-C12,主要分布在油相区和界面区,其在水相区中的浓度基本上为零,只需要POI来描述其分布,kobs和φI间的关系由式(9)给出。

可从式(7)~(9)的倒数形式得到分配常数,即,以1/kobs对φI作图得到直线,通过直线的斜率和截距计算出HA、HA-C2、HA-C4、HA-C8和HA-C12的。
得到分配常数后,即可根据式(10)~(12)分别计算亲水性强、疏水性强和亲水性中等的抗氧化剂在乳液界面区域的质量分数(%AOI)。

1.3.7 表面张力的测定
参考申云霞[24]的方法,用三蒸水配制不同浓度的抗氧化剂溶液,用DMPYZC型表面张力仪测定气泡破裂的瞬间数字压差计显示的最大压差ΔP/Pa。从物理化学手册中查出实验温度下水的表面张力σ水=7.257×10-2N/m,则仪器的常数K=σ水/ΔP。根据σ=K×ΔP即可求得各浓度样品溶液的表面张力σ(N/m)。
1.4 数据统计分析
采用SPSS 19.0统计软件包、OriginPro 8和Excel 2007软件进行数据分析和处理,结果表示为平均值±标准差。显著性检验以Duncan’s检验方法进行,P<0.05表示差异显著。
2 结果与分析
2.1 对羟基苯甲酸烷基酯的合成及结构表征
本研究用1.3.1节部分介绍的方法合成了对羟基苯甲酸的乙酯、丁酯、辛酯和十二酯。所得产物分别用1H NMR和FTIR进行了表征。各合成产物的表征结果如下所示。
HA乙酯(HA-C2)1H NMR(400 MHz,CDCl3),δ:7.97(d,J=8.7,2H)、6.89(d,J=8.7,2 H)、4.3 7(q,J=7.1,2 H)、1.3 9(t,J=7.1,3H)。FTIRγ/cm-1:3 218、2 978、2 906、1 673、1 607、1 522、1 447、1 287、1 169。
H A 丁酯(H A-C4)1H N M R(4 0 0 M H z,CDCl3),δ:7.97(d,J=8.7,2H)、6.88(d,J=8.7,2H)、4.31(t,J=6.6,2H)、1.84~1.63(m,2H)、1.57~1.37(m,2H)、0.98(t,J=7.4,3H)。FTIRγ/cm-1:3 384、2 954、2 873、1 679、1 604、1 510、1 467、1 283、1 162。
H A 辛酯(H A-C8)1H N M R(4 0 0 M H z,CDCl3),δ:7.97(d,J=8.8,2H)、6.88(d,J=8.8,2H)、4.29(t,J=6.7,2H)、1.87~1.61(m,2H)、1.44(t,J=7.7,2H)、1.34~1.26(m,8H)、0.88(d,J=7.0,3H)。FTIRγ/cm-1:3 390、2 918、2 854、1 680、1 605、1 510、1 471、1 282、1 163。
HA十二酯(HA-C12)1H NMR(400 MHz,CDCl3),δ:7.97(d,J=8.7,2H)、6.88(d,J=8.7,2H)、4.29(t,J=6.7,2H)、1.83~1.68(m,2H)、1.54~1.39(m,2H)、1.27(d,J=4.2,16H)、0.89(t,J=6.7,3H)。FTIRγ/cm-1:3 391、2 916、2 849、1 682、1 607、1 515、1 467、1 279、1 167。
将分析结果与文献[25-26]数据对比,确认所得产物分别为HA-C2、HA-C4、HA-C8、HA-C12。
2.2 DPPH自由基清除能力

表 1 HA及其烷基酯的DPPH自由基清除能力Table 1 DPPH radical scavenging capacity of p-hydroxybenzoic acid and its alkyl esters
通过DPPH自由基清除能力研究了HA及其烷基酯在甲醇溶液中的抗氧化效率,结果如表1所示,HA烷基酯对DPPH自由基清除能力显著大于HA的,其清除能力大小顺序为HA-C8>HA-C12>HA-C4>HA-C2>HA。表明HA的酯化提高了其清除自由基的能力。Panya等[27]在研究迷迭香酸烷基酯(C0~C20)时也得到相似结果。Laguerre等[8]也报道了C4和C8酯具有比绿原酸本身更高的DPPH自由基清除活性。
2.3 HA及其烷基酯在水包油乳液中的抗氧化效率
水包油乳液中脂类氧化通常发生在乳液液滴界面附近。因此,界面区域内的抗氧化剂比例变化会影响脂类氧化的效率[10]。HA及其烷基酯对乳液中脂质的抗氧化效率结果分别如图1和图2所示,添加不同体积分数的吐温20乳液的共轭二烯值和p-茴香胺值都随着储藏时间的延长而显著增加,说明这些乳液均发生了脂质氧化。添加HA烷基酯对乳液的共轭二烯与p-茴香胺的形成均有一定的抑制作用,表明HA烷基酯均具有抗氧化作用。
通过共轭二烯值达到1所用的时间和p-茴香胺值的变化趋势来评价HA烷基酯对水包油乳液的抗氧化作用。结果发现,HA烷基酯对乳液的抗氧化作用显著大于HA,并且随着烷基酯链的增长,其抗氧化作用逐渐增大,HA-C4达到最大,随后减少。Costa等[28]在研究咖啡酸及其酯对水包橄榄油乳液的抗氧化效率时也得到类似的结果。Barreiro等[10]认为,酚酸烷基酯的抗氧化活性随着链长增加观察到最大值的根本原因是抗氧化剂在界面区的浓度不同。Silva等[29]也得到类似结论。
从图1、2中还可以看出,随着吐温20的体积分数的增加,HA丁酯对乳液的抗氧化作用显著下降。Panya等[27]在研究吐温20对水包大豆油乳液中迷迭香酸酯抗氧化活性的影响时也得到类似结果,其发现迷迭香酸丁酯和月桂酯的抗氧化活性随吐温20浓度增加而下降,认为随着吐温20浓度的增加,迷迭香酸酯在水相中的分布也增加,因而可能阻止了迷迭香酸酯清除乳液液滴中的脂类自由基。Costa等[28]在研究咖啡酸及其烷基酯对橄榄油乳液的抗氧化效率与其在乳液界面区域浓度的关系时也得到类似的结果。
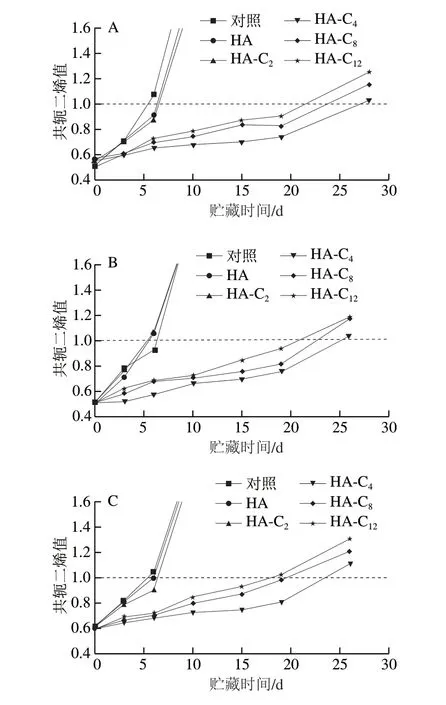

图 1 吐温20体积分数分别为1%(A)、2%(B)、3%(C)和4%(D)制备的菜籽油乳液中共轭二烯值随时间的变化Fig. 1 Changes in CDV with storage time in rapeseed oil/water emulsions with emulsifier concentrations of 1% (A), 2% (B), 3% (C) and 4% (D)

图 2 吐温20体积分数分别为1%(A)、2%(B)、3%(C)和4%(D)制备的菜籽油乳液中p-茴香胺值随时间的变化Fig. 2 Variation in p-AV with storage time in rapeseed oil/water emulsions with emulsifier concentrations of 1% (A), 2% (B), 3% (C) and 4% (D)
2.4 HA及其烷基酯在乳液油相、水相和界面之间的分配常数
从上述结果可以看出,HA-C8在均相溶液(甲醇)中的抗氧化效率最强,但是在乳液中HA-C4更有效。其原因可能是由于乳液界面区内的抗氧化剂质量分数不同而引起的。为探究这一猜测,采用假相动力学模型法测定了HA及其烷基酯在乳液界面的分布。为此,首先测定了HA及其烷基酯在乳液油相、水相和界面之间的分配常数。
在无乳化剂下HA及其烷基酯在水相和油相中的质量分数以及分配常数如表2所示,随着烷基链长的增加HA及其烷基酯的均增加,这说明有更多的抗氧化剂位于油相区域。
表 2 HA及其烷基酯的分配常数Table 2 Values of partition constant for HA and its alkyl esters

表 2 HA及其烷基酯的分配常数Table 2 Values of partition constant for HA and its alkyl esters
注:—.未测出。
抗氧化剂 水相区质量分数/% 油相区质量分数/% PWO HA 95.50±0.85 3.00±0.08 0.13±0.02 HA-C2 39.00±0.51 59.50±0.41 6.10±0.14 HA-C4 9.80±0.24 88.70±0.47 36.10±2.92 HA-C8 4.27±0.10 94.20±0.22 84.20±3.16 HA-C12 — 98.50±0.80 —

图 3 偶氮染料的吸光度和ln(At-Ainf)随时间的变化Fig. 3 Changes in absorbance and ln(At-Ainf) of azo dye with time

表 3 HA及其烷基酯的表观速率常数(kobs)随乳化剂体积分数(φI)的变化Table 3 Changes in apparent rate constant (kobs) with emulsifier concentration (φI) s-1
通过测定添加H A 或其烷基酯的乳液中未反应完全的16-Ar和NED生成的偶氮染料的吸光度和ln(At-Aint)随时间的变化情况,由式(4)进行线性拟合后,得到菜籽油乳液中16-Ar和HA之间的表观速率常数kobs。图3给出了添加HA乳液中未反应完全的16-Ar和NED生成的偶氮染料吸光度和ln(At-Aint)随时间的变化情况。由式(4)进行线性拟合得到其表观速率常数kobs为6.8×10-4s-1。HA烷基酯的表观速率常数由同样的方法得到,结果如表3所示。随着φI(本研究中所用乳化剂量较少,其几乎全部分布在界面区,故乳化剂在乳液中的体积分数可用φI表示)的增加,kobs减小,与式(7)的预测相一致。
由1/kobs对φI作图得到直线,通过直线的斜率和截距计算出HA及其烷基酯的和kI的值。图4给出了添加HA菜籽油(油水体积比2∶8)的乳液中kobs与1/kobs随φI的变化。通过1/kobs对φI的拟合直线(y=164 334x+458.65,R2=0.984 0)的截距和斜率,结合式(8)求出HA的和kI。HA烷基酯的和kI由同样方法得到,结果如表4所示。随着烷基链长的增加,增大,表明HA烷基酯疏水性的增加降低了它们在水中的溶解度,它们更多地溶于界面区域。但的增加并不一定意味着的增加,因为抗氧化剂的疏水性增加,它们可以更多地溶解于油相区域中;另一方面,HA及其烷基酯的kI在数值上比较接近,表明kI并不是其在乳液界面区域抗氧化效率的决定性因素。

图 4 HA在油水比为2∶8的菜籽油乳液中的kobs和1/kobs随φI的变化Fig. 4 φI-dependent changes in kobs and 1/kobs of HA in rapeseed emulsion with oil/water ratio of 2:8
表 4 HA及其烷基酯的和kITable 4 Values of and kI for HA and its alkyl esters

表 4 HA及其烷基酯的和kITable 4 Values of and kI for HA and its alkyl esters
注:—.未测出。
抗氧化剂 PO I PW I kI/(L/(mol·s))HA—182.070.001 5 HA-C4 204.98 7 399.90 0.001 5 HA-C8 110.77 9 338.21 0.001 0 HA-C1270.15— 0.001 3
2.5 HA及其烷基酯在乳液界面的分布
得到分配常数后,可通过式(10)~(12)分别计算HA及其烷基酯在乳液界面区域的质量分数(%AOI),结果如图5所示,随着乳化剂体积分数的增加,HA及其烷基酯在界面区域的质量分数增加。在乳化剂体积分数相同的情况下,HA在界面的质量分数最低,HA-C4的最高。当乳化剂体积分数从0.5%增加到5%时,HA在界面的质量分数从46%增加到了90%,增加了约1 倍。HA-C4在界面的质量分数从76%增加到96%,仅增加了约26%。即乳化剂体积分数扩大10 倍,HA及其烷基酯在界面区域的质量分数增加不到1 倍。
从图5还可以看出,HA及其烷基酯在界面区域中的质量分数与烷基链的长度没有直接关系,即与抗氧化剂的疏水性无关,其大小顺序为HA-C4>HA-C8>HA-C2≈HA-C12>HA。HA-C4具有最佳的抗氧化效率,与的变化趋势相一致。这一结果表明,HA-C2、HA-C4和HA-C8比HA更容易在界面定位,这也可以从图6中看出(HA-C12在水中的溶解度很低,不能测定其相应的表面张力),HA在其饱和浓度下也没有降低表面张力,表明其没有表面活性[30]。典型的表面活性剂在水中的表面张力随其浓度增加而线性下降,当界面浓度达到饱和时表面张力趋于稳定[30-31]。HA-C2、HA-C4和HA-C8在水中的表面张力随其浓度的变化与表面活性剂的非常类似,表明这些抗氧化剂起到了表面活性剂的作用,具有表面活性剂的性能[30-31],能更好地定位在油-水界面。结合前面HA及其烷基酯对乳液抗氧化作用的结果,可以发现HA及其烷基酯对乳液抗氧化效率的大小与这些抗氧化剂在界面区域的质量分数基本对应。这些实验结果表明,对HA及其烷基酯抗氧化效率起决定性的因素是其在乳液界面区域的质量分数,这与其他研究人员研究绿原酸、迷迭香酸[8]和没食子酸[9-10]及其烷基酯中所得的结果相似,烷基链在中等链长(C4~C12)的抗氧化活性最高,随后活性下降,体现出“截止效应”。
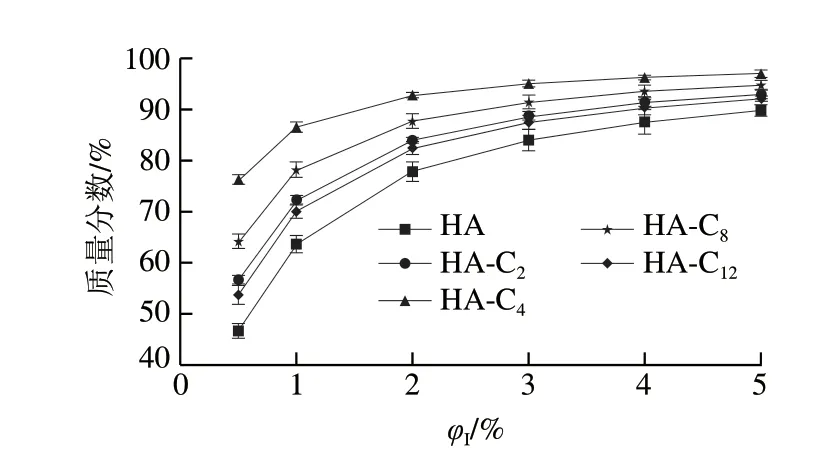
图 5 HA及其烷基酯在乳液界面区域的质量分数随φI的变化Fig. 5 φI-dependent changes in concentrations of HA and its alkyl esters in the emulsion interfacial region

图 6 HA及其烷基酯的表面张力对浓度的对数图Fig. 6 Plot of surface tension versus logarithm of concentration of HA and its alkyl esters
3 结 论
通过直接酯化法合成了一系列HA烷基酯,并测定其在均相甲醇溶液和在水包菜籽油乳液中的抗氧化效率。结果表明,HA酯化后在均相甲醇溶液和菜籽油乳液中的抗氧化效率均比本体更高,在均相甲醇溶液中HA-C8抗氧化效率最高,在菜籽油乳液中HA-C4抗氧化效率最高。假相动力学模型结果表明,HA及其烷基酯的抗氧化效率与其在乳液界面区域的质量分数基本对应。在其他条件都相同的情况下,HA-C4在乳液界面区中质量分数最大。本实验结果表明,抗氧化剂在乳液中的抗氧化效率除了与其抗氧化能力大小有关外还与其在乳液界面的质量分数有关。该研究结果为合理设计对水包油乳液有效的酚类抗氧化剂提供了理论指导。

