卵巢癌中SMS1对细胞增殖、侵袭和迁移的影响
杭 月,林昌岫,黄成日
卵巢癌是女性常见的恶性肿瘤,早期症状不典型,大部分患者就诊时已处于晚期,其中卵巢癌增殖、侵袭和迁移是影响治疗、预后的主要原因[1]。寻找抑制卵巢癌增殖、侵袭和迁移的靶点对于缓解疾病意义重大。神经鞘磷脂合成酶(sphingomyelin synthase, SMS)是神经鞘磷脂(sphingomyelin, SM)合成途径的最后一个酶,在卵巢癌中上调SMS1可诱导T细胞分化后识别卵巢癌细胞表面抗原,促进卵巢癌细胞凋亡[2],但尚未发现对卵巢癌细胞侵袭和迁移的影响。SMS活性改变与SM、甘油二酯(diacylglycerol, DAG)、卵磷脂(phosphatidylcholine, PC)、神经酰胺(ceramide, Cer)水平变化有关[3],SMS活性改变是否因其影响卵巢癌细胞中SM、DAG、PC、Cer水平的变化,从而影响卵巢癌细胞的增殖、侵袭和迁移。本实验通过检测低表达SMS1对卵巢癌细胞增殖、侵袭和迁移的影响,旨在探讨SMS1与卵巢癌发生、发展的相关性,为卵巢癌的早期诊断及靶向治疗积累临床数据。
1 材料与方法
1.1 材料
1.1.1细胞系 人卵巢癌细胞系HO8910及人正常卵巢上皮细胞系Hose,购自中国上海科学院细胞系。
1.1.2试剂 Trizol试剂、反转录试剂盒、荧光定量聚合酶链反应(quantitative real-time polymerase chain reation, qRT-PCR)试剂盒购自Takara公司;DMEM培养基、胎牛血清购自Invitrogen公司,胰蛋白酶、噻唑蓝(MTT)试剂购自SIGMA公司,Lipofectamine 2000转染试剂盒购自Invitrogen公司,PCR仪购自Bio-Rad公司。引物由上海生物工程公司合成。
1.2 方法
1.2.1细胞培养与转染 细胞培养:卵巢癌细胞HO8910复苏后常规培养于DMEM培养基内,(10%胎牛血清、5%CO2、37 ℃饱和湿度),3~5天待接种细胞生长铺满整个培养瓶底面后,胰蛋白酶消化,传代培养,用于后续实验。细胞转染:根据参考文献[4]及siRNA技术要求,设计针对SMS1的siRNA,采用国际通用与所有基因均无同源性序列的non-target siRNA为阴性对照。将培养至对数期的细胞接种于6孔(5.0×104个/孔)板中,siRNA组为实验组,siRNA-NC转染组为阴性对照组(negative control, NC),利用Lipofectamine 2000分别转染SMS1-siRNA、siRNA-NC,无转染组为空白对照组(blank control, BC),转染48 h后,采用qRT-PCR和Western blot法检测细胞SMS1蛋白表达,检测转染效率,筛选稳定表达SMS1的细胞进一步培养。引物序列详见表1。
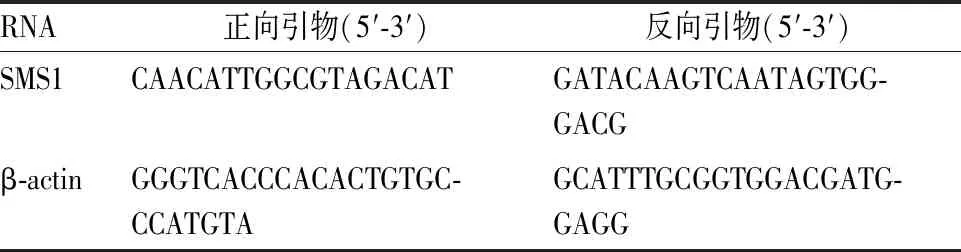
表1 qRT-PCR引物序列
1.2.2MTT法检测细胞增殖 收集转染成功的细胞,接种于96孔板中(1×104个/孔),重复5孔,每孔培养基总量为200 μL,培养箱内常规培养(5%CO237 ℃),分别于0、12、24、36、48、60、72 h时,每孔内加入5 mg/mL MTT溶液(每孔为20 μL)继续培养4 h后加入DMSO,利用自动酶标仪于570 nm处检测各孔光吸收值(A值),绘制细胞活力曲线。
1.2.3划痕实验检测细胞迁移 收集转染后培养至对数生长期的细胞在6孔板中铺板(1×105个/孔),培养过夜,观察细胞生长情况,单层生长细胞铺满6孔板时,10 μL灭菌移液器头在细胞上垂直划痕,PBS洗去划痕中细胞,加入空白培养基培养,分别在培养0、48 h后选取5个视野,测量细胞中间划痕宽度。
1.2.4Transwell实验检测细胞侵袭 收集转染后培养至对数生长期的细胞,胰蛋白酶消化,离心后加入空白培养基,混匀。Transwell小室上层加入基质胶Matrigel,将细胞在Transwell小室上层铺板(1×105个/孔),下室预先加入500 μL含10%胎牛血清的培养基,将Transwell小室放入24孔板内,于细胞培养箱培养24 h后,倒出培养基,PBS冲洗,风干、4%多聚甲醛固定,加入0.14%结晶紫染色,倒置显微镜随机选取5个不重叠视野进行计数并拍照。
1.2.5SMS酶活检测 消化、收集转染成功后细胞,胰蛋白酶消化后匀浆、离心后取上清液,根据参考文献[5],37 ℃ 5 h,氯仿/甲醇抽提,干燥后,利用薄层层析法检测SMS1酶活。
1.2.6细胞内SM、PC、Cer水平测定 检测细胞内SM、PC:消化、收集转染成功后的细胞,萃取脂质,加入酶显色剂,孵育45 min后,利用自动酶标仪于595 nm处检测吸光度(配制不同浓度SM、PC,绘制标准曲线,根据标准曲线测得吸光度对应的SM、PC浓度);Cer检测:萃取脂质,加入含有DAG的缓冲液中孵育30 min,利用薄层层析法检测Cer水平。

2 结果
2.1 正常卵巢细胞和卵巢癌细胞中SMS1 mRNA及蛋白的表达卵巢癌HO8910细胞中SMS1 mRMA及蛋白表达水平比正常卵巢细胞显著升高(1.03±0.02vs2.74±0.01,t=187.321,P<0.05,图1)。
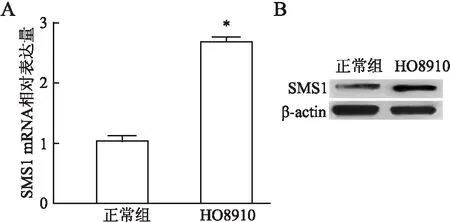
图1 正常卵巢细胞、卵巢癌细胞中SMS1 mRNA(A)及蛋白(B)的表达:与正常组相比,*P<0.05
2.2 siRNA-SMS1转染后HO8910细胞中SMS1 mRMA及蛋白表达量转染48 h后,siRNA(0.47±0.02)组细胞中SMS1 mRMA及蛋白相对表达量较NC组(1.07±0.02)与BC组(1.04±0.01)均显著降低(t=51.962、62.440,P<0.05,图2)。

图2 siRNA-SMS1转染后细胞中SMS1 mRMA(A)及蛋白(B)的表达:与阴性对照组相比,*P<0.05;与空白对照组相比,#P<0.05
2.3 siRNA-SMS1转染后HO8910细胞内SMS1酶活变化转染48 h后,siRNA组(0.76±0.03)细胞中SMS1酶与NC组(1.04±0.01)、BC组(1.02±0.02)相比,其显著降低(t=21.689、17.664,P<0.05,图3)。

图3 siRNA-SMS1转染后细胞内SMS1酶活变化:与阴性对照组相比,*P<0.05;与空白对照组相比,#P<0.05
2.4 siRNA-SMS1转染后HO8910细胞增殖siRNA-SMS1转染后siRNA组A570与BC、NC组相比,其显著降低(P<0.05,图4)。
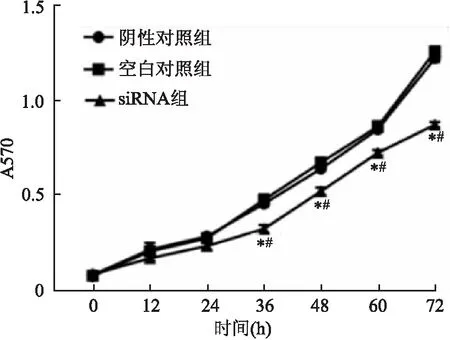
图4 siRNA-SMS1转染后细胞增殖:与阴性对照组相比,*P<0.05;与空白对照组相比,#P<0.05
2.5 siRNA-SMS1转染后HO8910细胞的迁移和侵袭能力转染后,siRNA组迁移指数、侵袭细胞数与BC、NC组相比,其显著降低(P<0.05,表2,图5)。
2.6 siRNA-SMS1转染后HO8910细胞中Cer、PC、SM水平转染后,siRNA组HO8910细胞中SM水平与NC、BC组相比,其显著降低(P<0.05);siRNA组HO8910细胞中Cer水平与NC、BC组相比,其显著升高(P<0.05);siRNA组HO8910细胞中PC水平与NC、BC组比较,差异无统计学意义(P>0.05,表3)。
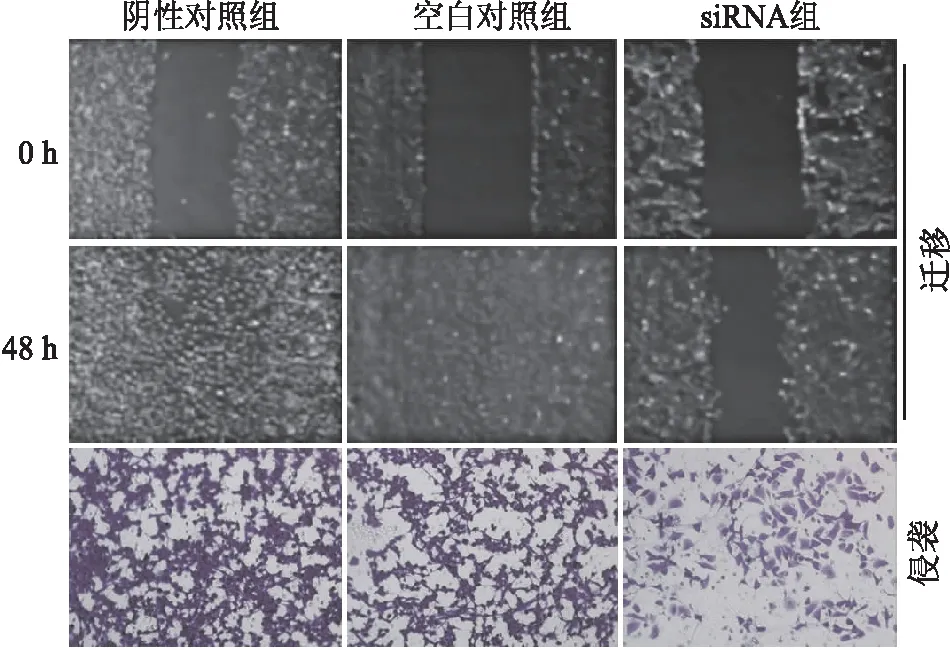
图5 siRNA-SMS1转染后HO8910细胞的迁移、侵袭

表2 siRNA-SMS1转染后HO8910细胞的迁移和侵袭能力
3 讨论
SMS有SMS1和SMS2两种同工酶,其中SMS1定位于顺面高尔基体,与SM的生物合成有关,SMS1活性对于保持肾乳头收集管细胞中细胞与细胞黏附结构至关重要[6];SMS1影响膜运输,是细胞增殖和凋亡过程的重要酶[7]。研究发现小鼠胚胎成纤维细胞中,敲除SMS1可抑制胚胎成纤维细胞的增殖[8];下调SMS1抑制癌细胞增殖从而改善神经胶质瘤患者预后[9]。SMS1水平可影响癌细胞的增殖、侵袭和迁移。本实验结果显示,HO8910肿瘤细胞中SMS1 mRNA及蛋白表达水平高于正常卵巢细胞,在卵巢中可能SMS1水平的升高影响细胞是否发生癌变,对于卵巢癌的检测意义重大。转染48 h后,siRNA-SMS1组卵巢癌细胞中SMS1酶活降低,验证siRNA-SMS1转染HO8910细胞成功。转染siRNA-SMS1后,HO8910细胞增殖能力、迁移、侵袭能力均降低,提示沉默SMS1基因导致一系列信号传导调节细胞增殖分化的作用而抑制,最终实现抑制卵巢癌HO8910细胞增殖,降低其迁移及侵袭能力,但是具体作用机制还有待于进一步验证。

表3 siRNA-SMS1转染后HO8910细胞中SM、PC、Cer水平
SMS1活性改变可能会影响细胞内Cer、PC、SM及DAG等水平变化,进一步影响细胞功能。可催化其底物Cer及PC,生成SM及DAG。Cer、DAG可能与细胞凋亡、老化有关。其中Cer作为体内重要的生物活性物质,可特异性连接细胞外信号转导,参与多种生物学反应[10]。吕勇刚等[11]的研究结果证明,Cer可呈剂量依赖性地促进细胞凋亡,降低细胞存活率;可能作为抑癌脂质,参与细胞自噬调控,导致细胞死亡[12];Cer可能通过PI3K/mTOR等信号途径参与肝癌[13]、子宫内膜癌[14]等疾病的发生、发展。此外,Cer还可能与细胞迁移、粘连、分化、衰老有关,可能与细胞增殖、侵袭有关[15-16]。SM是组成细胞质、膜的主要磷脂之一,参与调节多种基质蛋白及受体的活动,与信号转导、调控有关,可通过多个信号通路调节细胞凋亡[17-18],参与肿瘤的发生、发展;水平变化可能与神经细胞增殖、迁移有关[19]。本实验结果显示,HO8910转染siRNA-SMS1后,siRNA组HO8910细胞中SM水平显著降低,Cer水平显著升高,提示沉默SMS1表达使SMS1催化作用减弱,对Cer的作用减弱,对其消耗量减少,导致其在细胞内积累,进而抑制卵巢癌HO8910细胞增殖、侵袭与迁移;同时SM因Cer的催化作用减弱,生成SM的量降低,同样抑制卵巢癌HO8910细胞增殖、侵袭与迁移。
综上所述,SMS1基因沉默后卵巢癌HO8910细胞增殖活性降低,细胞迁移、侵袭能力下降,可能与SMS1基因沉默引起SM水平降低、Cer水平升高有关,本实验初步观察SMS1对卵巢癌表观指标的影响,具体机制有待于进一步分析。

