高强度超声对鹰嘴豆分离蛋白结构和功能特性的影响
望运滔 - 王营娟 - 田金风 - 白艳红 - 赵电波 -
(1. 郑州轻工业大学食品与生物工程学院,河南 郑州 450000;2. 河南省冷链食品质量安全控制重点实验室,河南 郑州 450000;3. 河南省食品生产与安全协同创新中心,河南 郑州 450000)
消费者对植物蛋白食品原料的兴趣日益增强[1],其中鹰嘴豆蛋白可作为大豆蛋白的潜在替代品[2]。鹰嘴豆主要分布于新疆、青海、甘肃和云南等地[3],其分离蛋白具有产量高、成本低、必需氨基酸组成平衡性好、生物利用度高、致敏性低等优点[4-6],而植物蛋白的功能特性会影响其在食品工业中的应用[2]。Boye等[7]研究表明,鹰嘴豆分离蛋白具有有限的功能特性。
超声技术是一项新兴的绿色技术,已被广泛应用于各个领域[8-10],其超声波通常被分为高频率低场强和低频率高场强两种范围。高频率低场强通常指频率为0.1~1.0 MHz,场强<1 W/cm2,低强度超声常用于评价食品的理化性质,如酸度、糖含量、硬度、成熟度等[11];低频率高场强是指频率为20~100 kHz,场强为10~1 000 W/cm2,高强度超声产生的空化作用和机械效应可以改变食品的物理和化学性质[11-12]。研究表明,高强度超声对卵清蛋白[13]、肌原纤维蛋白[14]、大豆蛋白[15]等蛋白质结构和功能性质存在影响,且差异显著。例如,超声处理对卵清蛋白乳化性无明显影响[10],但能显著提高鸡肉肌原纤维蛋白的乳化性[14]。此外,超声处理可增加大豆分离蛋白自由巯基含量[15],同时减少牛血清蛋白自由巯基含量[16]。试验拟探讨高强度超声对鹰嘴豆分离蛋白结构和功能特性的影响,旨在为生产具有特定功能性质的鹰嘴豆分离蛋白提供理论指导。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
卡布里鹰嘴豆(CicerarietinumLinn.):云南省文州自治区丘北市天星乡;
正己烷、氢氧化钠、盐酸:分析纯,国药集团化学试剂有限公司;
磷酸氢二钠、磷酸二氢钠氢、十二烷基硫酸钠、甘氨酸、5,5-二巯基-2,2-二硝基苯甲酸:上海源叶生物科技有限公司。
1.1.2 主要仪器设备
分析天平:AB265-S型,梅特勒—托利多仪器(上海)有限公司;
电子天平:JA3003N型,上海菁海仪器有限公司;
锤式实验粉碎磨:LM3100型,伊伊西科技(北京)有限公司;
水浴锅:HH-42型,常州万科仪器科技有限公司;
质构分析仪:TA-XT Plus型,英国Stable Micro System公司;
冷冻干燥机:Lab-1-50型,北京博医康实验仪器有限公司;
超声波破碎仪:VC-750型,美国SONICS公司;
纳米粒度电位仪:Zetasizer Nano ZS型,英国马尔文仪器设备有限公司。
1.2 试验方法
1.2.1 鹰嘴豆分离蛋白的提取 将鹰嘴豆于50 ℃烘箱中烘干,粉碎,过80目筛,采用正己烷脱脂,得脱脂粉。采用碱溶酸沉法提取鹰嘴豆分离蛋白,透析,冷冻干燥,得鹰嘴豆蛋白粉末。其蛋白质含量为81.9%,灰分为3.8%,水分为6.3%,脂肪为1.9%。
1.2.2 超声处理 配置质量分数为8%的鹰嘴豆分离蛋白溶液,采用超声设备对其进行超声处理,冷冻干燥,备用。超声波探头直径13 mm,频率20 kHz,功率450 W,超声时间分别为5,10,20 min;脉冲工作时间2 s,间歇时间4 s。
1.2.3 鹰嘴豆分离蛋白理化性质测定
(1) 溶解度:根据文献[17]略作修改。将1%的蛋白悬浊液于8 000 r/min离心15 min,取1 mL上清液加入到4 mL双缩脲试剂中,混匀,避光反应30 min,测定540 nm 处吸光率。
(2) 粒径和电位:配置浓度为1 mg/mL的鹰嘴豆分离蛋白溶液,采用激光粒度仪测量鹰嘴豆分离蛋白粒径和zeta电位。
1.2.4 蛋白质界面性质测定
(1) 乳化性:取1%的蛋白溶液15 mL,加入5 mL大豆油,10 000 r/min高速搅拌2 min,制备乳液。立即取100 μL乳液加入至5 mL 0.1% SDS溶液中,振荡混匀,测定500 nm处吸光度。乳液静置10 min后,取100 μL乳液至5 mL 0.1% SDS溶液中,振荡混匀,测定吸光度。按式(1)、(2)计算乳化活性和乳化稳定性[18]。
(1)
(2)
式中:
EAI——乳化性,m2/g;
ESI——乳化稳定性,min;
N——稀释倍数;
A0——0 min时吸光度;
A10——10 min时吸光度;
c——蛋白浓度,g/mL;
θ——油体积分数。
(2) 起泡性和泡沫稳定性:取5%的鹰嘴豆分离蛋白分散液15 mL,8 000 r/min均质2 min(均质20 s停20 s,共6次),然后快速转入量筒中,分别记录2,30 min时泡沫体积[13]。按式(3)、(4)计算起泡性和泡沫稳定性。
(3)
(4)
式中:
FA——起泡性,%;
FS——泡沫稳定性,%;
V0——2 min时泡沫体积,mL;
V30——30 min时泡沫体积,mL。
1.2.5 蛋白质凝胶性质测定
(1) 凝胶保水性:配置质量分数为14%的鹰嘴豆分离蛋白溶液,90 ℃水浴1 h,冷却,于4 ℃冷藏过夜。将制备好的凝胶于8 000 r/min离心15 min,用滤纸拭干凝胶表面水分,称重,按式(5)计算持水量。
(5)
式中:
WHC——保水性,%;
m1——初始凝胶质量,g;
m2——离心后凝胶质量,g。
(2) 凝胶破裂力:使用质构仪和P/0.5柱形铝探针进行测量。预试速度1.0 mm/s,测试速度1.0 mm/s,上试速度2.0 mm/s,测试距离10.0 mm,触发力10 g。
1.2.6 超声处理对鹰嘴豆分离蛋白结构的影响
(1) SDS-聚丙烯酰胺凝胶电泳:制备12%分离胶和5%浓缩胶,将40 μL浓度为4 mg/mL的鹰嘴豆分离蛋白溶液加至40 μL还原液中,震荡混匀,100 ℃水浴5 min,冷却。取10 μL混合物加至浓缩凝胶中,80 V下电泳30 min,再110 V电泳1.5 h,用考马斯亮蓝G250染色30 min,脱色。
(2) 圆二色谱:用磷酸缓冲液(10 mmol/L,pH 7)配制浓度为1 mg/mL的鹰嘴豆分离蛋白溶液。10 000 r/min离心15 min,采用双缩脲试剂法测定上清液蛋白溶解度。将蛋白用磷酸盐缓冲液稀释至0.1 mg/mL,带宽1.0 nm,光谱测量范围190~260 nm[13]。
(3) 内源荧光:鹰嘴豆分离蛋白(0.1 mg/mL)的制备方法同1.2.6(1),激发波长290 nm,发射波长298~400 nm,发射狭缝宽度2.5 nm,扫描速度1 200 nm/min。
(4) 表面疏水性:根据文献[16]并修改。用磷酸缓冲液(0.01 mol/L,pH 7)配置浓度为1 mg/mL的鹰嘴豆分离蛋白溶液,并分别稀释至0.100,0.050,0.025,0.005,0.001 mg/mL。将ANS溶于磷酸缓冲液(0.01 mol/L,pH 7),取30 μL ANS溶液加至3 mL蛋白溶液中,用荧光分光光度计测量荧光值。激发波长385 nm,发射波长490 nm。通过线性回归分析将荧光强度和蛋白浓度的初始斜率作为表面疏水性。
(5) 自由巯基:取0.1 g鹰嘴豆分离蛋白溶于50 mL Tris-HCl缓冲液(含86 mmol/L Tris,90 mmol/L甘氨酸,4 mmol/L DTNB,pH 8),用磁力搅拌器搅拌30 min, 10 000 r/min离心15 min。取50 μL DTNB溶液(4 mg/mL)加至5 mL蛋白上清液中,避光反应15 min,测定412 nm处吸光度。按式(6)计算巯基。
(6)
式中:
SH——巯基,μmol/g;
D——稀释倍数;
C——蛋白浓度,g/mL;
A——412 nm处反应液与蛋白空白溶液吸光度的差值。
1.2.7 数据处理 所有试验重复3次,数据用平均值±标准差表示。采用Origin 9软件作图。采用SPSS 21.0软件进行统计分析,利用单因素方差分析(ANONA)对数据进行统计分析,采用Duncan’s方法对均值进行多重比较分析,字母不同表示差异显著(P<0.05)。
2 结果与讨论
2.1 对鹰嘴豆分离蛋白理化性质的影响
2.1.1 溶解度 由图1(a)可知,超声处理可显著提高鹰嘴豆分离蛋白溶解度,且随超声处理时间的延长而增大。当超声时间为20 min时,鹰嘴豆分离蛋白溶解度达最大值9.2 mg/mL。超声的空化和机械效应可将粒径较大的蛋白质聚集体解聚成粒径较小的蛋白质颗粒,从而降低蛋白质聚集体粒径,增强蛋白质与水的相互作用,使蛋白质溶解度增加[19]。
2.1.2 粒径 由图1(b)可知,超声处理降低了鹰嘴豆分离蛋白团聚体在溶液中的粒径,是由于超声处理过程中产生的空化、剪切力和湍流作用加速了蛋白质团聚体的碰撞和聚集速度,不稳定的蛋白质团聚体被解聚成更小的蛋白质颗粒[20]。此外,超声处理过程中产生的能量破坏了蛋白质的非共价相互作用,如氢键和疏水相互作用,从而降低蛋白质分子间作用力,进而降低蛋白质颗粒的粒径[21]。

图1 超声处理对鹰嘴豆分离蛋白理化性质的影响
2.1.3 电位 由图1(c)可知,高强度超声处理使蛋白质表面净电荷的绝对值降低,表明超声处理使鹰嘴豆分离蛋白基团的电离程度减弱,可能是因为超声处理过程中暴露了更多的正电荷基团,中和了蛋白质表面的部分负电荷[22]。此外,亲疏水基团之间的平衡也会影响蛋白质的表面电荷[13]。
2.2 对鹰嘴豆分离蛋白界面性质的影响
2.2.1 泡沫性质 由图2(a)可知,鹰嘴豆分离蛋白起泡性随超声时间的增加显著增强,而泡沫稳定性无明显变化。当超声时间为20 min时,起泡性达最大值163.33%,是未处理组的2.33倍,可能是因为超声的空化作用降低了鹰嘴豆分离蛋白分子的聚集程度,从而增强了蛋白质的柔韧性,使鹰嘴豆分离蛋白更容易吸附在气—水界面[13]。Xiong等[13]研究表明表面疏水性的增加和表面净电荷的减少有利于增强蛋白质的起泡性。
2.2.2 乳化性 由图2(b)可知,超声处理后鹰嘴豆分离蛋白的乳化活性略高于未处理组,可能是由于蛋白质结构和表面基团发生了变化。此外,溶解度的增加也有助于改善蛋白质的乳化活性,因为更多的可溶性团聚体会使蛋白质与水之间的相互作用增强,使蛋白质在油水界面迅速扩散和吸收,从而有利于提高蛋白质在油水界面的吸附能力[23-24]。

图2 超声处理对鹰嘴豆分离蛋白界面性质的影响
2.3 对鹰嘴豆分离蛋白凝胶特性的影响
2.3.1 凝胶破裂力 由图3(a)可知,与未处理组相比,热诱导凝胶的破裂力随超声时间的延长而增大,可能是因为超声预处理改变了蛋白质的非共价相互作用。一方面,溶解度的增加会产生更多的可溶性蛋白团聚体,这些团聚体加热后会形成密度更大的蛋白凝胶网络。此外,粒径的减小会使凝胶网络结构更加致密均匀,进一步提高其凝胶破裂力。另一方面,超声处理后,鹰嘴豆分离蛋白溶液在加热形成凝胶时产生更多的二硫键[10],使凝胶结构更加稳定,凝胶破裂力增强[25]。
2.3.2 保水性 由图3(b)可知,凝胶保水性随超声时间的延长而增大。超声处理后,鹰嘴豆分离蛋白溶解度增大,粒径减小,从而使凝胶网密度增大,结构更加致密,蛋白凝胶能结合更多水[26]。

图3 超声处理对鹰嘴豆分离蛋白凝胶特性的影响
2.4 对鹰嘴豆分离蛋白结构的影响
2.4.1 电泳 还原条件下,鹰嘴豆分离蛋白的主要亚基结构分别是convicilin和vicilin[27]。由图4可知,70 kD处条带代表的是aconvicilin[27-29],50 kDa处条带代表的是vicilin;超声处理组与未超声处理组的鹰嘴豆分离蛋白之间的条带差异不显著,说明超声处理并没有改变蛋白亚基的种类、数量和分子量[13]。

M. 蛋白Marker 1. 超声0 min 2. 超声5 min 3. 超声10 min 4. 超声20 min
2.4.2 圆二色谱 由表1和图5(a)可知,相比于未处理组,超声处理后鹰嘴豆分离蛋白的圆二色谱峰值强度略有增强。未处理组的α-螺旋、β-折叠、β-转角和无规则卷曲含量分别为17.7%,32.5%,16.5%,33.0%。超声处理后,鹰嘴豆分离蛋白的α-螺旋含量略有增加,β-折叠含量减少,β-转角和无规则卷曲含量无显著变化,与Vere等[30]的结论一致。而Zhu等[23]研究发现超声处理使蛋白质的β-折叠含量增多,α-螺旋含量减少,可能是由于超声条件和蛋白质类型的不同所致。综上,高强度超声处理改变了鹰嘴豆分离蛋白的二级结构。
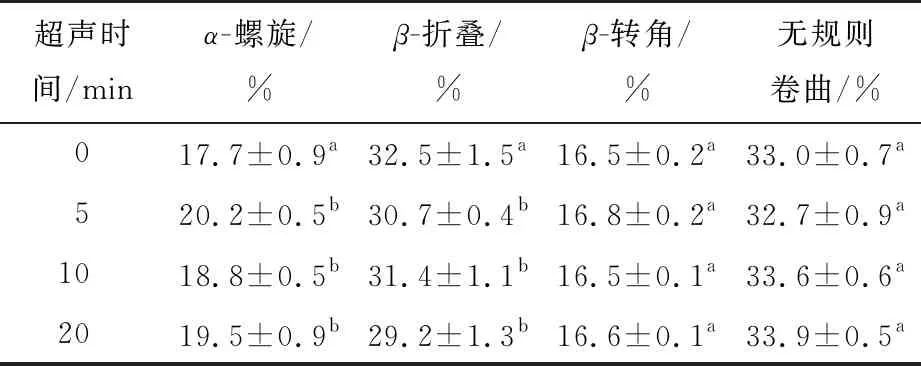
表1 超声时间对鹰嘴豆分离蛋白二级结构的影响
2.4.3 内源荧光 由图5(b)可知,未处理组的最大荧光强度波长为326 nm,超声处理后该波长为331 nm,表明超声处理使蛋白的发射波长红移5 nm,发射波长红移可以反映蛋白质构象的变化,说明位于蛋白质内部的芳香氨基酸分子侧链基团逐渐暴露于水溶液中,其环境极性逐渐增大;超声处理后鹰嘴豆分离蛋白的荧光强度降低。综上,超声处理改变了蛋白质的三级结构。
2.4.4 巯基 由图5(c)可知,游离巯基含量随超声时间的延长先增加后减少,是由于原本位于鹰嘴豆分离蛋白内部的巯基经超声处理后逐渐暴露于蛋白分子表面,从而使巯基含量增加;但随着超声时间的继续延长,游离巯基含量逐渐减小,主要是因为长时间高强度超声处理会产生过氧化氢,使游离巯基被氧化,进而降低游离巯基含量[16]。蛋白质中游离巯基含量反映了其空间结构的变化,巯基含量增多,证明蛋白质结构展开,蛋白质分子柔性增加,进而有利于蛋白质溶解性和乳化性的提高,并且在热诱导凝胶形成过程中,游离巯基可以转化为二硫键,二硫键是维持凝胶形成的主要作用力,有利于形成致密的空间网状结构,进而有助于提高鹰嘴豆分离蛋白凝胶的保水性和破裂力。

图5 超声处理对鹰嘴豆分离蛋白结构的影响
2.4.5 表面疏水性 由图5(d)可知,超声处理后鹰嘴豆分离蛋白的表面疏水性高于未处理组。蛋白质表面疏水性的增加可以提高蛋白质在油—水和气—水界面的吸附特性,从而有利于改善蛋白质的乳化性和起泡性。
3 结论
450 W高强度超声可以显著改善鹰嘴豆分离蛋白的溶解度、乳化性、起泡性以及热致凝胶性。此外,超声处理使蛋白的表面游离巯基含量和表面疏水性显著增大,粒径和电位绝对值显著降低,并且改变了蛋白质的二级和三级结构。试验研究了高强度超声处理对鹰嘴豆蛋白功能性质的影响,而未详细研究此处理改变功能性质的机制,因此后续研究应进一步详细深化此部分研究。

