稀土钕尘肺工人血清中IL-10、IFN-γ的表达及其DNA 甲基化分析
宋统球,高艳荣,王素华,白宇超,贾玉巧
包头医学院毒理教研室(公共卫生学院),内蒙古 包头 014060
尘肺病呈进行性加重且不可逆转,不仅造成职业病病人健康损害,又给国家带来巨大的医疗经济负担。长期吸入稀土粉尘可引起肺的纤维性变,称为稀土尘肺[1]。Th1/Th2 型细胞因子反应失衡是肺纤维化的研究热点之一[2]。研究中发现[3]:Th2 型细胞因子在肺纤维化中起主要作用,可促进成纤维细胞活化、增生,使胶原蛋白合成增加,并抑制其降解,最终导致基质蛋白沉积和纤维组织生成;Th1 型细胞因子可以抑制成纤维细胞的增殖和纤维组织的生成,并能抑制Th2 型细胞因子的释放,减少纤维化。DNA 甲基化可以调节细胞因子基因活性,影响Th1、Th2 型细胞因子的转录,导致Th1/Th2 细胞因子间失衡,IFN-γ基因启动子区域发生甲基化时会导致其分泌减少甚至不分泌[4],IL-10启动子区存在CpG 位点,且启动子区甲基化与IL-10 的表达呈明显负相关[5],因此,本研究拟通过测定尘肺工人外周血钕含量和Th1 型细胞因子IFN-γ及Th2 型细胞因子IL-10 的表达,并检测它们启动子区的甲基化水平,了解尘肺工人暴露水平及机体免疫状况,从分子水平探讨钕粉尘致尘肺机理。
1 对象与方法
1.1 对象
收集某稀土厂钕作业尘肺病患者22 例作为尘肺组,均符合《GBZ70-2015 尘肺诊断标准》中尘肺病诊断标准,选取年龄、工龄相匹配的无粉尘暴露的行政管理人员22 例作为对照组。所选研究对象均为男性,排除吸烟、肺结核、肺炎及其他纤维化及结缔组织疾病,并进行健康体检。该研究经包头医学院伦理委员会论证通过,所有研究对象均签署知情同意书。
1.2 方法
1.2.1 问卷调查 采用统一设计的调查表,按照统一的方法及标准,由经培训的调查员对调查对象进行问卷调查,调查内容包括年龄、工龄、职业史、既往史、吸烟情况等。
1.2.2 血液样品的采集 经知情同意,采用专用的抗凝采血管采集清晨空腹全血样5.0 mL,另采集5.0 mL 全血自然凝固后取血清。所有标本皆-80 ℃冷冻保存。
1.2.3 全血钕浓度测定 全血采用混合酸温控湿式消解法[6]预处理血样,用钕标准液(1000 μg/mL,国家有色金属及电子材料测试中心)配制标准系列工作曲线溶液,浓度为5、10,20,30,40,50,100µg/L。采用iCAP Q 等离子质谱仪(Thermofisher,美国)测定钕的含量,以响应值(Y)为纵坐标,相应质量浓度(X)为横坐标,绘制标准溶液工作曲线。通过标准曲线方程计算得相应的元素含量。
1.2.4 血清中IL-10 和IFN-γ含量检测 将血清样本至于温室复融,严格按照ELISA 试剂盒说明书(南京建成,中国)操作,加入显色剂后用全波长酶标仪(BIO-TEK,美国)测波长450 nm 的光密度值,根据标准曲线计算血清中的含量。
1.2.5 IFN-γ和IL-10 启动子甲基化检测 在NCBI 上截取基因转录起始位点的上游5000 bp 至下游1000 bp 序列,利用CpG 岛在线预测网站http://www.ebi.ac.uk/Tools/seqstats/emboss_cpgplot/预测序列潜在的CpG 岛,没有发现潜在CpG 岛。根据Mikeska 等[7]提出的引物设计的一般规则和建议,用sequenom®EpiDesigner 程序对序列进行引物方案设计,设计引物序列(由北京博淼生物公司合成)。使用血液基因组DNA 提取试剂盒(DP318,北京天根生化科技有限公司)提取基因组DNA。NanoDrop 1000 分光光度计(Thermo Fisher Scientific,USA)检测提取的DNA 纯度、浓度。纯度要求A260/A280在1.7~2.0 之间,DNA 浓度大于30 ng/µL;样本体积大于50µL。并用1%琼脂糖凝胶电泳,并观察电泳条带有无明显降解。采用美国Zymo Research公司的EZ DNA Methylation-Gold Kit试剂盒对DNA样品进行转化。回收的DNA 按表1 所列引物和反应条件进行扩增,扩增产物以1.5%琼脂糖凝胶电泳电泳检测,见图1。
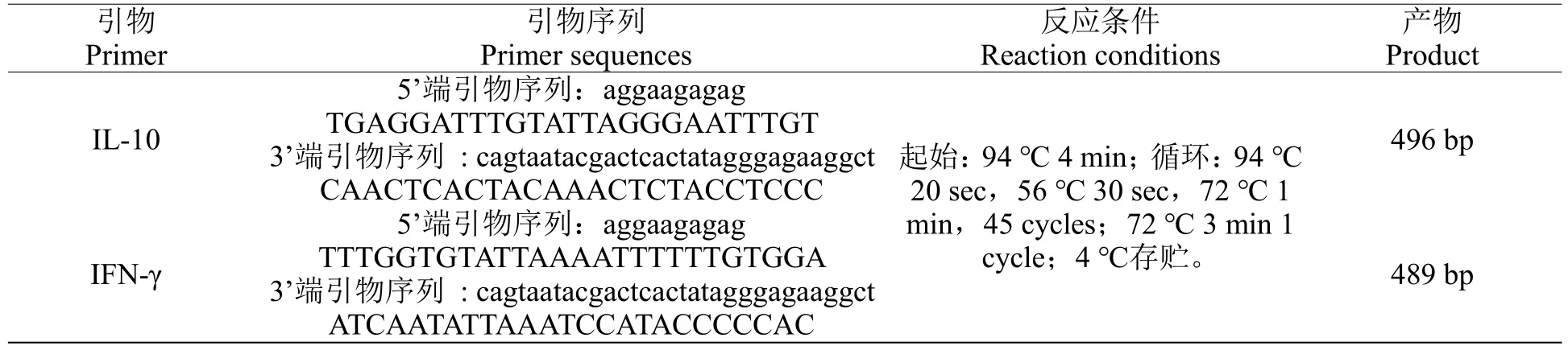
表1 IL-10、IFN-γ甲基化引物序列和反应条件Table 1 IL-10、IFN-γ methylation primer sequences and reaction conditions

图1 启动子甲基化电泳图(部分)Fig.1 Promoter methylation electrophoresis(part)
1.3 统计学分析
用SPSS 21.0 软件进行统计分析,正态分布资料,数据的统计描述以(±s)表示,组间比较采用t检验。不符合正态分布时以中位数和四分位间距M(Q)表示,组间比较采用Wilcoxon 秩和检验,相关性采用多重线性回归分析,检验水准α=0.05。
2 结果与分析
2.1 研究对象一般情况
尘肺组与对照组两组人员年龄、工龄经两独立样本t检验,差异均无统计学意义(P>0.05)。体检异常项目经x2检验,差异无统计学意义(P>0.05),因此两组资料具有可比性(见表2)。

表2 尘肺组与对照组一般资料比较Table 2 Comparison of general data between pneumoconiosis group and control group
2.2 血液中钕及血清细胞因子含量比较
尘肺组全血钕含量高于对照组,差异有统计学意义,尘肺组血清IL-10 含量及IL-10 与IFN-γ的比值高于对照组,差异有统计学意义,尘肺组血清IFN-γ含量低于对照组,差异有统计学意义(表3)。
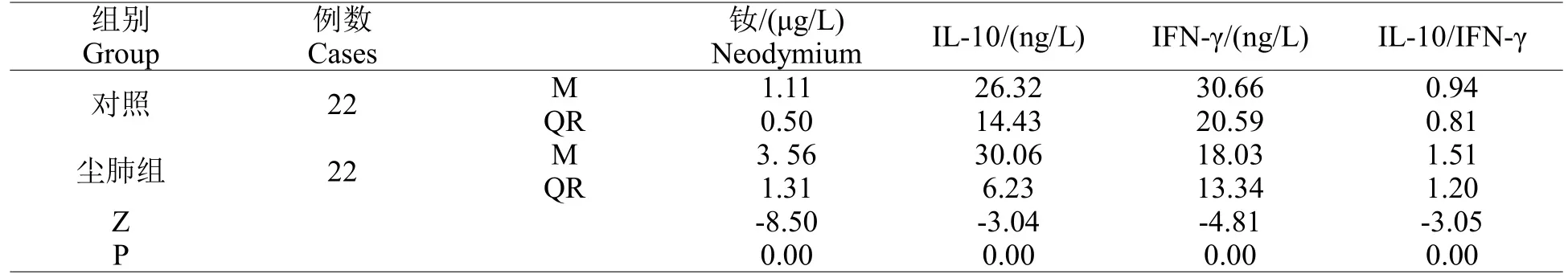
表3 血液中钕及血清细胞因子含量比较Table 3 Comparison of neodymium and serum cytokines in blood
2.3 IFN-γ和IL-10 启动子甲基化状态
根据MassARRY EpiTYPER 质谱仪分析提供的图谱数据,精确定位到基因片段每个CpG 单位的甲基化状态,用甲基化率量化每个CpG 单位。本实验检测IFN-γ基因启动子区CpG 位点总数7 个,全部检出。IL-10 基因启动子区CpG 位点总数16 个,其中的CpG5 和CpG6 因为酶切之后产生的片段分子量大小一样,因而产物峰落在同一位置而被合并检出,最终显示的结果为上5、6 点的平均甲基化程度,CpG10 未检出,CpG_11 超过30%未检出,故剔除[8]。利用聚类分析法分析IFN-γ和IL-10基因启动子区CpG 位点甲基化率在两样本中的分布趋势,采用Cluster 3.0 软件、TreeView 软件进行分层聚类分析,发现尘肺组IFN-γ启动子区甲基化率要高于对照组,IL-10 启动子区甲基化率要低于对照组,(见图2,3)。

图2 尘肺组和对照组IFN-γ基因启动子区各CpG 位点甲基化率聚类分析Fig.2 Cluster analysis of methylation rate of CpG loci in IFN—γ promoter region of pneumoconiosis group and control group

图3 尘肺组和对照组IL-10 基因启动子区各CpG 位点甲基化率聚类分析Fig.3 Cluster analysis of methylation rate of CpG loci in IL-10 promoter region in pneumoconiosis group and control group
经正态性检验发现IFN-γ和IL-10 甲基化的数据非正态,采用Mann-Whitney U 检验比较甲基化的差异。IFN-γ启动子7 个CpG 位点中:CpG1、CpG4、CpG7 的甲基化水平高于对照组(P<0.05),而其它的CpG 单位CpG2,CpG3,CpG5,CpG6 则没有显著差异性(P>0.05)。IL-10 启动子13 个CpG 位点中:CpG1、CpG5.6、CpG9、CpG15 的甲基化水平明显低于正常对照组(P<0.05),而其它的CpG 单位CCpG2、CpG3、CpG4、CpG7、CpG8、CpG12、CpG13、CpG14 和CpG16 则没有显著差异性(P>0.05)(见表4、5)。
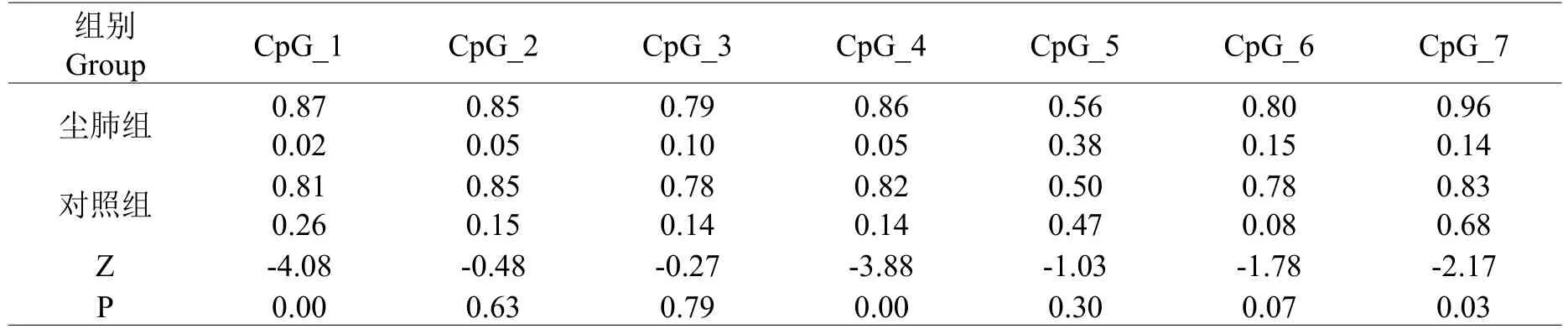
表4 IFN-γ基因甲基化检测结果M(Q)Table 4 IFN-γ gene methylation test results M(Q)

表5 IL-10 基因甲基化检测结果M(Q)Table 5 IL-10 gene methylation test results M(Q)
2.4 多重线性回归分析
以IFN-γ和IL-10 基因启动子区有差异的CpG 位点作为因变量,以工龄、年龄、血液中钕含量、血清细胞因子含量及IL-10 与IFN-γ的比值作为自变量,多重线性回归分析采用逐步法,结果显示:IFN-γ的CpG1、CpG7 和IL-10/IFN-γ的比值存在线性相关,IL-10 中的CpG1、CpG5.6 和IL-10/IFN-γ的比值存在线性相,CpG15 和IL-10、IL-10/IFN-γ的比值存在线性相关(见表6、7、8)。

表6 IFN-γ基因启动子区有差异的CpG 位点与各因素多重线性回归分析结果Table 6 Multiple linear regression analysis of different CpG loci and factors in IFN-γ gene promoter region

表7 IL-10 基因启动子区有差异的CpG 位点与各因素多重线性回归分析结果Table 7 Multiple linear regression analysis of different CpG loci and factors in IL-10 gene promoter region
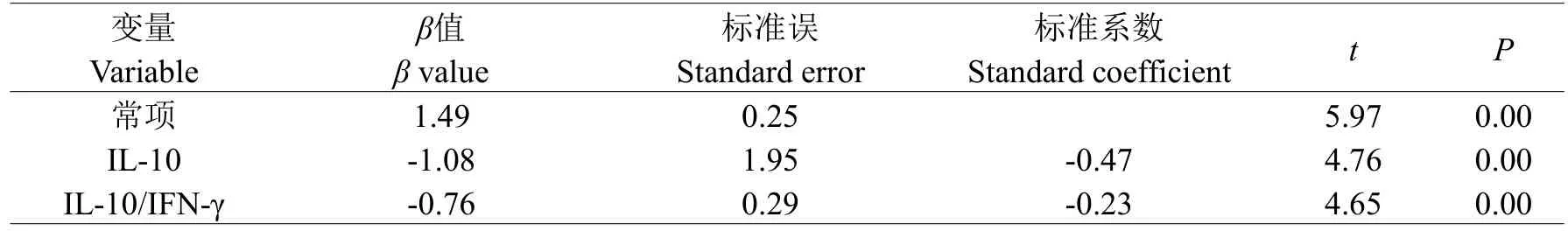
表8 IL-10 基因启动子区CpG15 位点与各因素多重线性回归分析结果Table 8 Multiple linear regression analysis of CpG15 loci and factors in IL-10 gene promoter region
3 讨论
氧化钕粒径小于0.2µm,研究表明,粒径小于25µm 的颗粒物,能够进入肺泡沉积在肺部,是导致尘肺病的主要元凶[9]。由于粉尘无法排出体外,肺组织会不断吞噬和释放粉尘,尘肺患者虽脱离粉尘环境,病变仍会不断进展,通过肺灌洗可以从尘肺患者肺中洗出大量粉尘[10]。本研究显示,尘肺组工人血中钕水平明显高于对照组,表明尘肺患者肺组织中存在大量氧化钕粉尘,是稀土钕作业工人患尘肺病的主要致病因素。
研究表明,尘肺患者体内存在Th1 和Th2 免疫失衡[11],Annacker 等[12]证实Th2 型细胞因子IL-10可以抑制Th1 型细胞因子IFN-γ的产生,王海椒等[13]发现尘肺患者肺部存在明显的Th2 免疫优势表达,同时患者血清中IL-10 的含量高于正常人群;杨霞[14]在对二氧化硅致大鼠肺纤维化中发现,随着染毒时间延长,IFN-γ处于平稳降低状态;暴磊等[15]研究显示,在大鼠矽肺形成后期,IFN-γ表达减弱,IL-10 表达显著增强。本研究显示尘肺组IL-10 含量大于与对照组,IFN-γ含量低于对照组,IL-10/IFN-γ在尘肺组中占优势,这表明尘肺患者IL-10 优势表达,IFN-γ受抑制。已有研究证实:IL-10可下调IFN-γ产生,促进肺部纤维化反应,同时诱导Th0 细胞向Th2 细胞分化[16],INF-γ可以抑制Th2细胞因子的释放,对肺纤维化具有抑制作用[17]。
DNA 甲基化可以在不改变序列的情况下改变DNA 分子的活性,它可以调节基因活性并影响许多关键过程。研究发现[18]:基因启动子可通过高甲基化进行基因沉默,使其丧失转录活性,同样可通过去甲基化促进基因的表达,本研究发现,尘肺患者IFN-γ基因启动子甲基化率高于正常人群,而IL-10 基因启动子甲基化率低于正常人群,表明,IFN-γ基因表达受抑制,IL-10 基因表达异常增强。研究发现IFN-γ启动子区域发生甲基化时会导致其分泌减少甚至不分泌[19],Gonsky 等[20]在对炎性肠炎的研究中发现,IFN-γ启动子DNA 每降低5%甲基化百分比,IFN-γ基因表达水平升高将近3 倍,宋阳等[21]发现:大鼠腹腔巨噬细胞分泌IL-10 降低与其启动子区域高甲基化密切相关,付丽红[22]用5-氮杂胞苷处理单个核细胞,可以逆转IL-10 启动子区甲基化状态并使其表达升高。本研究血清中IFN-γ、IL-10 的水平与其基因启动区甲基化率具有一致性,与上述相符。
多重线性回归分析发现,IFN-γ的CpG1、CpG7 甲基化水平和IL-10/IFN-γ的比值呈正相关(P<0.05),IL-10 中的CpG1、CpG5.6 水平和IL-10/IFN-γ的比值呈负相关(P<0.05),CpG15 和IL-10、IL-10/IFN-γ的比值呈负相关(P<0.05),提示细胞因子失衡,对甲基化具有反向作用。这可能与CD4辅助T 细胞极化有关,高浓度的IL-10 诱导CD4 辅助T 细胞向Th2 方向极化,同时抑制其向Th1方向极化,向Th2 方向极化时IFN-γ启动子区域发生甲基化,并可遗传给子代细胞[19]。
4 结论
综上所述,IL-10 与IFN-γ失衡及其基因启动子区的甲基化水平在钕尘肺的病情进展中有重要的作用。

