银杏叶提取物中三种黄酮对3T3-L1 细胞成脂代谢的影响
卜 素,薛 泉,袁春颖,陈 颖,曹福亮
1.南京林业大学生物与环境学院,江苏 南京 210037
2.南京林业大学南方现代林业协同创新中心,江苏 南京 210037
肥胖症是一种慢性疾病,且会引起高血压、心脑血管疾病、慢性炎症和癌症等多种并发症,且发病率正逐年提高[1,2]。脂肪细胞是人体脂肪组织内的一种重要细胞,具有储存能量、支持缓冲、提供产热的作用。但脂肪细胞数量的过度增加,前脂肪细胞向成熟脂肪细胞分化引起胞内脂质的过度积累而导致的体积增大会导致肥胖症的发生[3]。脂肪沉积被认为是肥胖发展的关键步骤,控制这一步骤将能够有效地控制肥胖的进程[4]。
3T3-L1 细胞是一种分离自小鼠胚胎的前脂肪细胞,能够特异性分化为成熟脂肪细胞,是一种国际公认的研究细胞脂质代谢的模式细胞[5]。在3T3-L1 前脂肪细胞的分化过程中,多种转录因子和酶在脂质的生成和代谢中起重要作用。当转录因子CAAT 增强子结合蛋白α(CAAT-enhancer-bindingprotein α,C/EBPα)[6]、过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)[7]和固醇调节元件结合蛋白-1c(sterol regulatory element-binding protein 1c,SREBP-1c)[8]被激活后,位于其下游的一些与脂肪合成相关的酶和蛋白被激活,胞内的脂质开始积累[9]。其中,乙酰辅酶A羧化酶1(acetyl-CoA carboxylase 1,ACC1)是脂肪酸合成第一阶段的关键限速酶,能够促进长链脂肪酸的合成,用于合成甘油三酯和磷脂[10],脂肪酸合成酶(fatty acid synthase,FASN)是一种催化脂肪酸合成的关键酶,催化丙二酰辅酶A和乙酰辅酶A生成长链脂肪酸[11]、葡萄糖转运蛋白4(glucose transporter type 4,GLUT-4)主要存在于脂肪细胞和肌肉细胞中,在受到胰岛素刺激后,由胞内转移到细胞膜上进行葡萄糖转运[12]、脂滴包被蛋白(lipid droplet-associated protein A,Perilipin A)是一种细胞分化后期覆盖于脂滴表面,防止脂质被胞内脂肪酶水解的重要蛋白[13],以上都是脂质合成过程的关键酶和蛋白。
银杏(Ginkgo biloba)作为一种药食同源的植物,在我国已有数千年的利用历史,上世纪六七十年代,德国科学家Willmar Schwabe 首先开发了一种银杏叶提取物(EGB761),对其主要活性成分的含量都做出了规定,其中银杏黄酮的含量不低于24%,银杏内酯的含量不低于6%,银杏酚酸的含量小于0.001‰。EGB761 被证明具有抗氧化、抗衰老和保护心脑血管等药理作用[14-17]。黄酮类化合物是广泛存在于自然界的一种化合物[18],EGB 中三种主要黄酮类成分是槲皮素、山奈酚和异鼠李素,它们也存在于很多天然植物中,且具有多种生物活性[19-21]。研究证实,银杏叶提取物对3T3-L1前脂肪细胞有一定的增殖抑制作用[22-24],但是其中主要活性单体对3T3-L1 细胞脂质积累的影响和机理还未得到充分阐述。抑制脂肪组织中脂肪细胞的数量增多(细胞增殖)和体积增大(细胞分化和脂质积累)是肥胖防治中的重要靶点之一。本研究将系统评估EGB 中三种银杏黄酮对3T3-L1 前脂肪细胞增殖以及成脂分化方面的影响,并检测对成脂分化起关键作用的转录因子及相关基因在转录水平上的变化,为后续深入阐明银杏黄酮调控脂质代谢的机理奠定基础。
1 材料与方法
1.1 材料
3T3-L1 前脂肪细胞株购自美国菌种保存中心(ATCC);槲皮素、山奈酚和异鼠李素购自上海同田生物科技有限公司;DMEM 培养基、DPBS 磷酸盐缓冲液、0.25%含EDTA 胰酶、青霉素和链霉素双抗和胎牛血清购自美国Gibco 公司;噻唑蓝(MTT)、胰岛素(Insulin)、地塞米松(DEX)、3-异丁基-1-甲基黄嘌呤(IBMX)和油红O 粉末购自美国Sigma 公司;RNA 提取试剂盒(MiniBEST Univrsal RNA Extraction Kit)、逆转录试剂盒(PrimeScriptTMRT Master Mix)、qPCR 试剂盒(TB GreenTM Premix Ex TaqTM Ⅱ)购自日本TaKaRa 公司;多功能酶标仪(FilterMax F5)购自美国Molecular Devices、实时荧光定量PCR 仪(Step One Plus)购自美国Applied Biosystems 公司,引物由南京擎科生物有限公司合成。
1.2 3T3-L1 前脂肪细胞的培养和诱导分化
在DMEM 培养基中加入10%胎牛血清、1%青霉素和链霉素双抗使其终浓度分别为100 U/mL和100 μg/mL,于37 ℃、5%CO2和一定湿度的条件下培养3T3-L1 细胞。在细胞长满2 d 后,加入细胞分化液一(DMEM 高糖培养基、10%胎牛血清、1%双抗、10 μg/mL 胰岛素、1 μmol/L DEX、0.5 mM IBMX)诱导分化3 d。3 d 后换用细胞分化液二(DMEM 高糖培养基、10%胎牛血清、1%双抗、10 μg/mL 胰岛素)继续诱导分化2 d,2 d 后换用分化液三(DMEM 高糖培养基、10%胎牛血清、1%双抗)继续培养,每2~3 d 换液至分化结束[25]。
1.3 MTT 法检测三种黄酮对3T3-L1 细胞活性的影响
当3T3-L1 前脂肪细胞在96 孔板中的融合率达到70%时,换用含有不同浓度(0.5、1、10、25、50 和100 μmol/L)三种黄酮(槲皮素、山奈酚、异鼠李素)的DMEM 低糖培养基(10%胎牛血清,1%双抗)培养处理细胞24 h。处理结束后,在每孔中加入50 μL 浓度为1 mg/mL 的MTT 溶液,在37 ℃培养箱中孵育4 h。倒去废液,每孔加入200 μL 的DMSO 溶液,37 ℃,800 rpm 恒温震荡10 min,使结晶甲瓒充分溶出后,用酶标仪于595 nm 处检测吸光值。对于成熟脂肪细胞,当3T3-L1 细胞分化为成熟脂肪细胞后,将培养基换为含有不同浓度各单体的DMEM 高糖培养基(10%胎牛血清,1%双抗),在给药处理24 h 后,用和前脂肪细胞相同的方法检测吸光值[26]。细胞活力计算公式为:细胞活力=(每个样品读数-调零平均)/(对照组平均-调零平均)×100%
1.4 油红O 染色及脂质积聚半定量检测
细胞分化过程中,在换分化液二和分化液三时,同时分别添加50 μmol/L 的槲皮素、山奈酚和异鼠李素直至细胞分化结束。用PBS 清洗细胞2 次后,用10%的甲醛水溶液固定细胞1 h,后用浓度为0.3 mg/mL 的新鲜配制的油红O 染色液与超纯水按照3:2 的比例混匀,配制成油红O 工作液,对固定好的细胞进行染色。室温染色2 h,用蒸馏水洗去浮色并拍照[27]。拍照结束,加入异丙醇溶解细胞中的油红O,吸出溶解液,在酶标仪中于510 nm 处测定吸光值[28],给药组和对照组(未经给药处理)吸光值的比值(%)为细胞内脂质积聚的半定量结果。
1.5 逆转录和实时荧光定量
按照试剂盒说明提取对照组和分化过程中给药组3T3-L1 细胞的RNA,用微量分光光度计测定RNA 的浓度和纯度。按照试剂盒说明书进行逆转录(20 μL 体系,500 ng RNA,37 ℃45 mins,85 ℃1 min),合成cDNA。qPCR 按照20 μL 的反应体系进行。反应条件如下:95 ℃预变性30 s;95 ℃5 s,60 ℃30 s,共40 个循环。采用相对定量法(ΔΔCT)进行数据分析,以甘油醛-3-磷酸脱氢酶(GAPDH)作为内参计算目的基因的表达量变化(2-ΔΔCT)[29]。荧光定量引物序列见表1。
1.6 统计分析
采用统计软件Excel 对实验结果进行分析,结果以均值±标准差表示,每个实验都进行了3 次重复。数据经过t检验分析,*表示P<0.05,**表示P<0.01,***表示P<0.001。
2 结果与分析
2.1 EGB 中三种黄酮对3T3-L1 细胞活力的影响
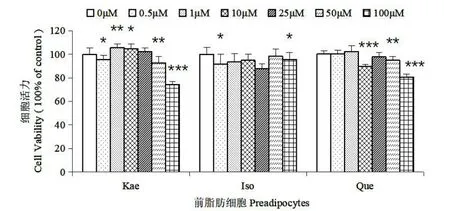
图1 银杏叶提取物中三种黄酮对3T3-L1 前脂肪细胞的增殖抑制影响Fig.1 Inhibitory effect of three flavonoids in Ginkgo biloba extract on the proliferation of 3t3-l1 preadipocytes
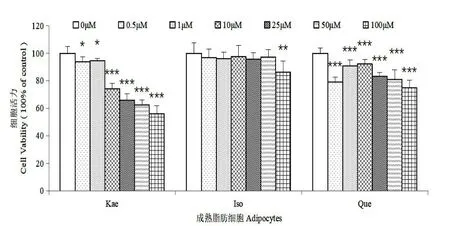
图2 银杏叶提取物中三种黄酮对3T3-L1 成熟脂肪细胞的毒性影响Fig.2 Cytotoxicity of three flavonoids from Ginkgo biloba extract on 3T3-L1 mature adipocytes
2.2 EGB 中三种黄酮对3T3-L1 细胞分化过程中胞内脂质积累的影响
如图1,前脂肪细胞的MTT 结果显示,山奈酚(Kae)和槲皮素(Que)在100 μmol/L 的条件下,对细胞的增殖起一定的抑制作用;异鼠李素(Iso)则在0~100 μmol/L 的处理条件下对前脂肪细胞的增殖基本没有影响;在低浓度处理条件下,三种银杏黄酮则对前脂肪细胞的增殖几乎没有抑制作用。说明3T3-L1 前脂肪细胞的增殖受三种银杏黄酮的影响不大,仅山奈酚和槲皮素在高浓度(100 μmol/L)下有一定的抑制作用。如图2,成熟脂肪细胞的MTT 结果显示,山奈酚对成熟脂肪的毒性呈梯度依赖,当给药浓度越高,表现出的细胞毒性越大,100 μmol/L 浓度的山奈酚处理后,细胞毒性达到44%;异鼠李素仅在100 μmol/L 的浓度下表现出了14%的细胞毒性;槲皮素在0.5 μmol/L 和100 μmol/L 的条件下表现出了较高的细胞毒性,细胞毒性分别为21%和25%。异鼠李素和槲皮素在实验中的其余浓度下细胞毒性不明显。因此,高浓度的槲皮素、异鼠李素和山奈酚对成熟脂肪细胞有一定的细胞毒性,且山奈酚的细胞毒性较大。但槲皮素在微量浓度下也具有一定的细胞毒性,其具体作用机制暂不明确,还需要进一步的研究来证明其具体作用机制。
如图3,经过三种银杏黄酮处理的3T3-L1 细胞,其与对照组相比,细胞内脂滴的数量明显减少,细胞的分化状态较差,只有少部分的细胞成功分化。如图4,油红半定量结果显示:在相同的浓度下(50 μmol/L),异鼠李素对细胞脂质积累的抑制效果最明显(43%),山奈酚次之(29%),槲皮素的作用效果较弱(17%),且都有统计学意义。以上结果提示,三种银杏黄酮对3T3-L1 前脂肪细胞的分化均起抑制作用,且在相同浓度下对脂质积累的抑制程度各不相同。
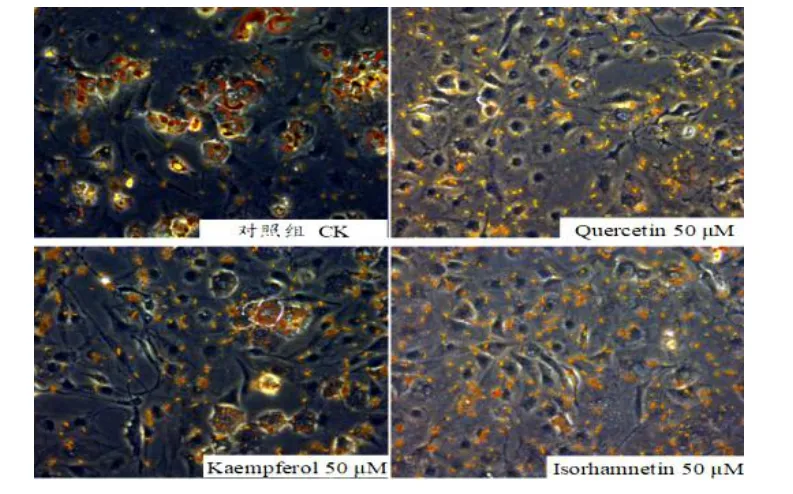
图3 三种银杏黄酮处理后3T3-L1 细胞的油红O 染色结果(200×)Fig.3 Oil Red O staining results of 3t3-l1 cells treated with three ginkgo flavones(200×)
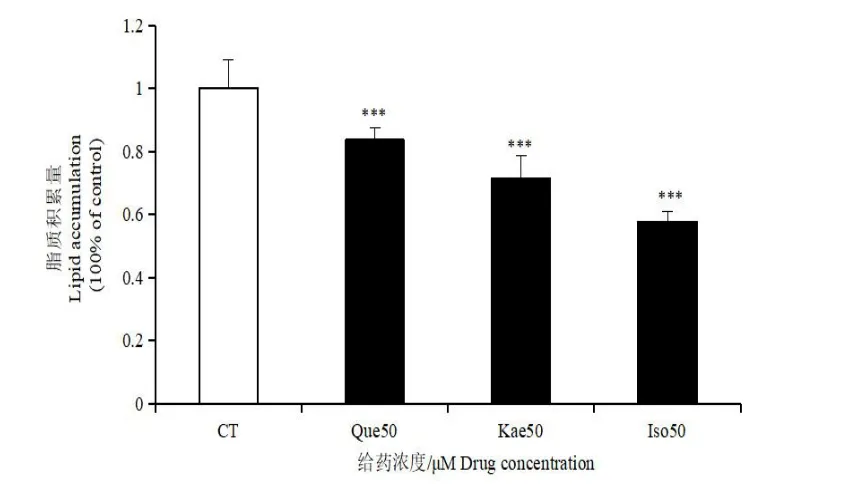
图4 银杏叶提取物中三种黄酮对3T3-L1 前脂肪细胞成脂分化的影响Fig.4 Effects of three flavonoids in Ginkgo bilobaextract on adipogenic differentiation of 3t3-l1 preadipocytes
2.3 EGB 中三种黄酮对3T3-L1 前脂肪细胞分化中转录因子mRNA 水平的影响
如图5,槲皮素、山奈酚和异鼠李素在低浓度(0.5 μmol/L)和较高浓度(50 μmol/L)给药的条件下都能显著降低C/EBPα的表达水平,其相对表达量都为对照组的10%左右,且均具有统计学意义。如图6,槲皮素和异鼠李素在低浓度时对转录因子PPARγ的影响不明显,山奈酚在0.5 μmol/L 时,对PPARγ的表达有一定的促进作用,但无统计学意义;但在50 μmol/L 浓度给药时,槲皮素和山奈酚能够较明显地抑制PPARγ的表达。如图7,三种黄酮在低浓度时对SREBP-1c 的表达量影响不大,在50 μmol/L 的浓度下,对SREBP-1c 有一定的抑制作用,其中槲皮素和异鼠李素有相近的抑制效果,山奈酚的抑制效果较次。以上结果表明,三种银杏黄酮在低浓度下对转录因子C/EBPα的抑制作用明显,而对PPARγ和SPEBP-1c 的抑制作用不明显;在较高浓度下,三种银杏黄酮对C/EBPα、PPARγ和SPEBP-1c 这三个转录因子的表达均能显著地抑制其表达。

表1 实时荧光定量PCR 引物序列Table 1 Primer sequence of real-time fluorescence quantification PCR
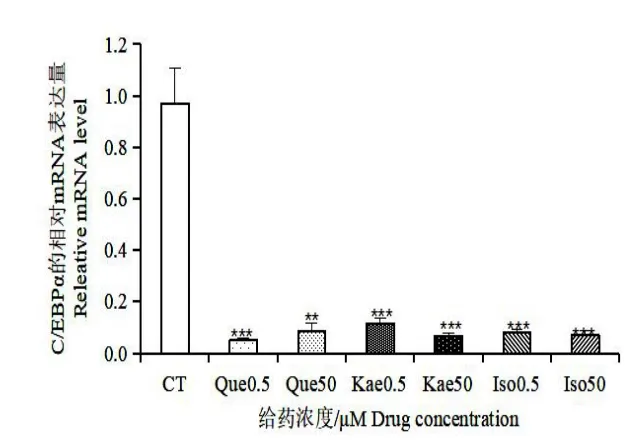
图5 银杏叶提取物三种黄酮对转录因子C/EBPα的影响Fig.5 Effect of three flavonoids inGinkgo bilobaextract on C/EBPα
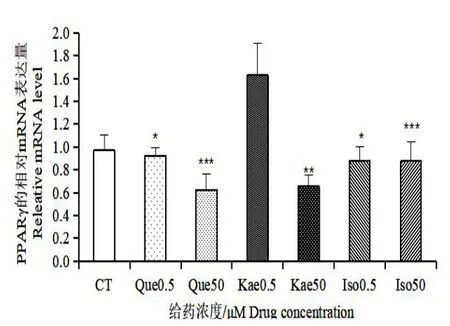
图6 银杏叶提取物三种黄酮对转录因子PPARγ的影响Fig.6 Effect of three flavonoids inGinkgo bilobaextract on PPARγ
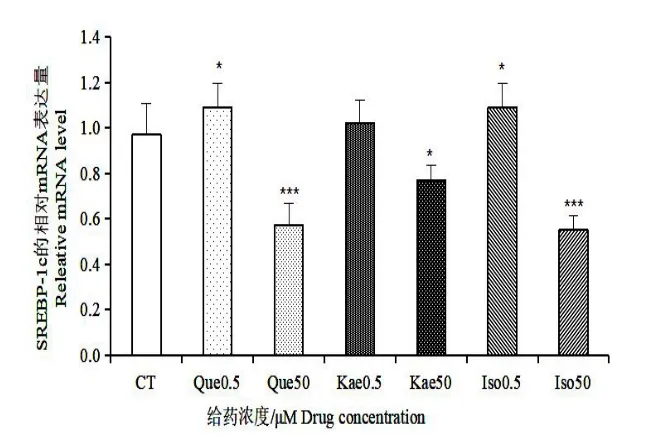
图7 银杏叶提取物三种黄酮对转录因子SREBP-1c的影响Fig.7 Effects of three flavonoids fromGinkgo bilobaextracton
2.4 EGB 中三种黄酮对成脂基因表达量的影响
如图8,与对照组相比,槲皮素和异鼠李素在0.5 μmol/L 的低浓度下,对ACC1 的表达有少许促进作用,山奈酚在此浓度下对ACC1 的表达影响不大,然而在50 μmol/L 的浓度下,三种银杏黄酮对ACC1 的表达都表现出了一定的抑制作用。如图9 和10 所示,三种银杏黄酮处理后FASN 和GLUT-4 的表达都下调,且三种黄酮对GLUT-4 基因表达的抑制作用都呈现剂效关系。如图11,槲皮素对Perilipin A 的表达起抑制作用,0.5 μmol/L 浓度的山奈酚对Perilipin A 的表达起一定的促进作用,异鼠李素对其表达没有明显影响。以上结果提示,三种银杏黄酮在50 μmol/L 较高浓度下,均能够通过下调ACC1 和FASN 的表达来抑制胞内脂肪酸的合成,同时能够通过下调GLUT-4 的表达来减少细胞对外界葡萄糖的转运,从而减少胞内脂质合成的能量来源。槲皮素能够下调Perilipin A的表达,减少对胞内脂滴的保护作用,此结果提示槲皮素可能对胞内脂质的水解有促进作用,而山奈酚和异鼠李素不能抑制Perilipin A 的表达。在0.5 μmol/L 的低浓度下,ACC1 的表达未被抑制,说明在该浓度下,三种银杏黄酮对脂肪酸的从头合成无显著影响。
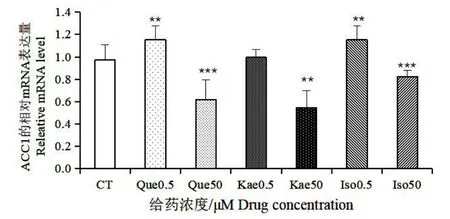
图8 银杏叶提取物中三种黄酮对ACC1 的影响Fig.8 Effects of three flavonoids in Ginkgo biloba extract on ACC1
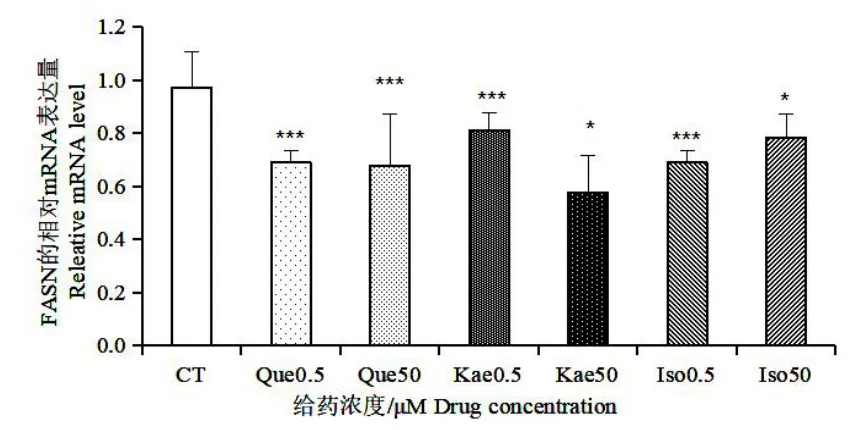
图9 银杏叶提取物主要黄酮对FASN 的影响Fig.9 Effects of main flavonoids in Ginkgo biloba extract on FASN
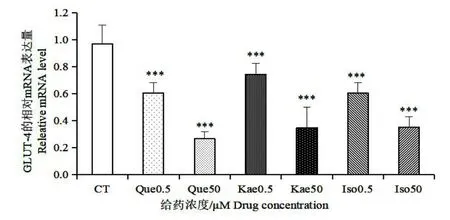
图10 银杏叶提取物主要黄酮对GLUT-4 的影响Fig.10 Effect of Three Flavonoids in Ginkgo biloba extract on GLUT-4
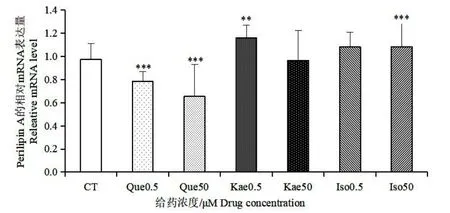
图11 银杏叶提取物主要黄酮对Perilipin A 的影响Fig.11 Effect of main flavonoids in Ginkgo biloba extract on Perilipin A
3 讨论
肥胖是一种全球范围内发病率不断增高的慢性疾病[30-32],前脂肪细胞的增殖和脂肪细胞中脂质的增加是导致肥胖症发病的主要原因,因此,抑制前脂肪细胞的增殖和改善脂肪细胞中的脂质代谢是治疗肥胖的两个主要的方向。有研究表明,银杏叶提取物对3T3-L1 前脂肪细胞的增殖有抑制作用,但是其主要活性单体的作用和机理还未得到详尽的阐述。
C/EBPα和PPARγ是调控3T3-L1 前脂肪细胞分化为成熟脂肪细胞的关键转录因子,在细胞分化的终末期大量表达。C/EBPα和PPARγ两者存在相互作用的关系,PPARγ的表达会诱导C/EBPα的表达[33]。转录因子SREBP-1c 对FASN 的激活起着重要作用,SREBP-1c 表达量的上调会促进FASN 的合成,以促进细胞内脂质的积累[34]。GLUT-4 是位于细胞膜上的葡萄糖转运蛋白,C/EBPα、PPARγ和SREBP-1c 均可与其启动子结合以激活其表达[35]。
ACC1 在脂肪细胞中大量表达,催化生成的丙二酰辅酶A 是长链脂肪酸合成和延伸的重要C2底物,是影响3T3-L1 细胞脂质代谢的关键蛋白[36,37]。Perilipin A 则是细胞分化终末期的脂滴包被蛋白,对分化终末期脂质的积累起重要作用,能够将胞内的脂滴包裹起来,避免胞内的脂肪水解酶的水解以维持胞内脂质代谢的平衡偏向脂质积累[38]。
本研究的实验结果表明,山奈酚和槲皮素都对前脂肪细胞的增殖有一定的抑制作用,山奈酚对成熟脂肪细胞表现出浓度依赖的细胞毒性,槲皮素对成熟脂肪细胞具有没有剂量关系的细胞毒性,而异鼠李素在仅在高浓度时对成熟脂肪细胞有细胞毒性。在mRNA 水平,三种黄酮在较高浓度处理后,均会下调3T3-L1 细胞分化过程中关键转录因子的表达水平,尤其是C/EBPα,其相对表达量仅为对照组的10%左右,并由此导致这些转录因子下游与脂质积聚相关蛋白和酶的基因表达也受到一定的抑制。三种黄酮在较低浓度时,对其下游的抑制作用表现不明显。异鼠李素在50 μmol/L 的较高浓度下,通过抑制C/EBPα、SREBP-1c、ACC1、FASN 和GLUT-4 的表达来抑制胞内的脂质合成和细胞分化进程。槲皮素与山奈酚在mRNA 层面与异鼠李素有类似的作用效果,且在高浓度时二者能够下调转录因子PPARγ的表达,同时槲皮素还对Perilipin A 的表达也有较好的抑制效果。在细胞水平,三种黄酮对3T3-L1 前脂肪细胞分化过程中脂质的积累都起到了一定程度的抑制作用。综上所述,槲皮素、异鼠李素和山奈酚这三种银杏黄酮能够抑制3T3-L1 细胞的成脂分化,但其抑制效果和抑制方式各不相同。本结果初步评估了银杏叶提取物中三种黄酮对3T3-L1 脂肪细胞脂质代谢的影响,深入的作用机制和对肥胖症的影响还需要进一步的实验来证明。
4 结论
本研究系统评估了银杏叶提取物中三种黄酮——山奈酚、异鼠李素和槲皮素对3T3-L1脂肪细胞成脂代谢的影响。结果表明三种银杏黄酮对3T3-L1细胞的主要影响方式是对成熟脂肪的细胞毒性、较高浓度时对前脂肪细胞的增殖抑制、以及下调主导脂肪细胞分化的转录因子及脂质生成相关基因的表达。三种黄酮对3T3-L1细胞的成脂分化作用各有不同,我们推测在银杏叶提取物中,黄酮类组分通过协同效应达到改善脂质代谢和脂质过度积累的效果,同时提示杏叶提取物在肥胖的预防治疗中具有潜在的价值。

